2020-12-21
FDA одобрило применение препарата Саксенда (лираглутид) для лечения подростков, страдающих ожирением
 | FDA одобрило препарат Саксенда (лираглутид; зарегистрирован в РФ) от датской фармацевтической компании Novo Nordisk для лечения подростков в возрасте от 12 до 17 лет, страдающих ожирением, чей индекс массы тела составляет больше 30 кг/м2, а вес – больше 60 кг. |
2020-12-21
Минздрав прорабатывает вопрос включения в стандарты препаратов off-label
 | Препараты off-label планируют включить в стандарты медицинской помощи, чтобы обеспечить доступность таких лекарств. Об этом на заседании экспертного совета по здравоохранению при Комитете Совета Федерации по социальной политике сказал советник министра здравоохранения России Сергей Глаголев. |
2020-12-21
Правительство изменило правила формирования ограничительный перечней лекарственных препаратов
 | В России теперь есть только три лекарственных перечня: ЖНВЛП, дорогостоящих лекарств и минимальный ассортимент аптек. |
2020-12-21
Бавенсио® (авелумаб) в сочетании с акситинибом (Инлита®) одобрен для лечения почечно-клеточного рака
 | Министерство здравоохранения РФ одобрило применение Бавенсио® (авелумаб) в сочетании с акситинибом (Инлита®) в первой линии терапии пациентов с распространённым или метастатическим почечно-клеточным раком. Минздрав РФ впервые одобрил анти-PD-L1 препарат в составе комбинированной схемы лечения пациентов с распространённым почечно-клеточным раком. |
2020-12-21
Фостемсавир получил поддержку Европейского агентства по лекарственным средствам
 | Таблетки Rukobia (фостемсавир) компании ViiV Healthcare, получили положительное заключение Комитета Европейского агентства по лекарственным средствам (EMA) для использования человеком (CHMP). Фостемсавир в сочетании с другими антиретровирусными препаратами показан для лечения взрослых с инфекцией ВИЧ-1 и множественной лекарственной устойчивостью. |
2020-12-21
"Вектор" заявил об эффективности российской вакцины от ВИЧ
 | Вакцина от вируса иммунодефицита человека (ВИЧ), разработанная научным центром "Вектор" Роспотребнадзора, способна вырабатывать антитела к вирусу, что подтвердилось в ходе первой фазы клинических испытаний у 100% добровольцев. |
2020-12-21
С 2021 года сообщать о неблагоприятных событиях при использовании медизделий надо по новому порядку
 | Минздрав определил правила представления информации о неблагоприятных последствиях и осложнениях, которые возникли при применении медизделий. Речь идёт о выявленных побочных действиях, которые не указаны в инструкции по применению, о нежелательных реакциях при эксплуатации медизделия, особенностях взаимодействия медизделий между собой, о фактах и обстоятельствах, создающих угрозу жизни и здоровью граждан и медработников. |
2020-12-21
Руководство ICH E5(R1) «Этнические факторы, влияющие на приемлемость зарубежных клинических данных» в открытом доступе на русском языке
 | Выложен в открытом доступе перевод руководства Международного совета по гармонизации (ICH) E5 «Этнические факторы, влияющие на приемлемость зарубежных клинических данных», действующая версия которого датируется 1998 годом. |
2020-12-21
В Минздраве обсуждают введение порога готовности платить за один сохраненный год жизни пациента
 | Центр экспертизы и контроля качества предлагает установить порог готовности государства платить за препараты. Такой показатель может составить 2,5 млн руб. за один год сохранённой качественной жизни пациента. На него можно будет ориентироваться при включении препаратов в список ЖНВЛП. Это предложение обсудят в Минздраве. Авторы инициативы утверждают, что введение такого порога не будет усложнять процесс включения препаратов в перечень, напротив, он упростит процедуру для определённых лекарств. Производители в свою очередь опасаются, что это может негативно сказаться на доступности дорогостоящих инновационных препаратов. |
2020-12-21
Первые данные по CAR Т-клеточной терапии фолликулярной лимфомы: ZUMA-5
 | ZUMA-5 представляет собой многоцентровое исследование фазы 2 с участием одной группы пациентов, страдающих рецидивирующей или рефрактерной iNHL, которые ранее получали как минимум две линии терапии. |
2020-12-21
FDA одобрило первое геномное изменение домашних свиней
 | FDA предоставило «Revivicor Inc.» одобрение первого в своём роде преднамеренного геномного изменения в линии домашних свиней под названием GalSafe, которое можно использовать в пищевых или медицинских целях. Технология заключается в удалении альфа-галового сахара с поверхности клеток свиней. Это может быть значимо для лиц с аллергическими реакциями от лёгкой до тяжёлой степени на данный углевод, содержащийся в красном мясе (например говядине, свинине и баранине). |
2020-12-21
Элисо® (талиглюцераза альфа) для терапии взрослых и детей с подтверждённым диагнозом болезни Гоше включён в программу 14 ВЗН
 | Подписано распоряжение Правительства РФ о расширении государственной программы льготного лекарственного обеспечения «14 высокозатратных нозологий». В числе новых препаратов с начала 2021 г. в список войдёт талиглюцераза альфа (Элисо®) для терапии взрослых и детей с подтверждённым диагнозом болезни Гоше I типа, а также детей в возрасте от 2 до 18 лет с висцеральными или гематологическими проявлениями болезни Гоше. |
2020-12-21
Предложены меры по повышению доступности клеточной терапии CAR-T в России
 | На площадке XI Всероссийского конгресса пациентов, который ежегодно проводит Всероссийский союз пациентов, состоялся круглый стол «Перспективы применения клеточной терапии в клинической практике» с участием представителей органов исполнительной власти, научных организаций, компаний-производителей, а также медицинского и пациентского сообществ. Ключевым для обсуждения экспертов стал вопрос о повышении доступности для российских пациентов инновационных возможностей лечения злокачественных заболеваний, в частности CAR-T терапии. |
2020-12-21
Виндакель® (тафамидис) – новый препарат для лечения транстиретиновой амилоидной полинейропатии
 | Сегодня тафамидис – единственный селективный стабилизатор транстиретина, одобренный в РФ для лечения транстиретиновой амилоидной полинейропатии. |
2020-12-21
Сетмеланотид – новый препарат для лечения редкого тяжелого генетического ожирения
 | Сетмеланотид, агонист рецепторов меланокортина-4, для лечения пациентов с дефицитом проопиомеланокортина или рецепторов лептина, у которых вскоре после рождения развивается стойкое тяжёлое ожирение. |
2020-12-10
Долгосрочная безопасность и эффективность нинтеданиба (Варгатефа) у пациентов с интерстициальными заболеваниями лёгких при системной склеродермии
 | Промежуточный анализ продемонстрировал долгосрочный благоприятный профиль безопасности и устойчивое влияние нинтеданиба (Варгатеф) на замедление скорости снижения функции лёгких у пациентов с интерстициальными заболеваниями лёгких при системной склеродермии. Согласно данному анализу, профиль безопасности и эффективности нинтеданиба соответствует результатам исследования III фазы SENSCIS®. |
2020-12-10
В исследовании III фазы NAVIGATOR по препарату тезепелумаб достигнуто снижение частоты обострений у пациентов с тяжёлой бронхиальной астмой
 | В исследовании NAVIGATOR была достигнута первичная конечная точка при добавлении тезепелумаба к поддерживающей терапии бронхиальной астмы (БА) – статистически достоверное и клинически значимое снижение ежегодной частоты обострений БА в общей популяции пациентов по сравнению с группой плацебо. |
2020-12-10
В России одобрен препарат Полайви® для лечения рецидивирующей или рефрактерной диффузной B-крупноклеточной лимфомы
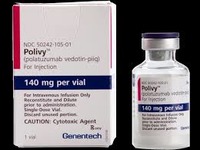 | Министерство здравоохранения РФ одобрило лекарственный препарат полатузумаб ведотин (торговое наименование Полайви®) компании «Рош» для применения в комбинации со стандартной терапией бендамустином и ритуксимабом у взрослых пациентов с рецидивирующей или рефрактерной диффузной B-крупноклеточной лимфомой, которым не показана трансплантация гемопоэтических стволовых клеток. |
2020-12-10
В России зарегистрирован пероральный препарат рисдиплам (Эврисди®) для лечения спинальной мышечной атрофии у взрослых и детей с двух месяцев
 | Министерство здравоохранения РФ одобрило препарат рисдиплам для лечения спинальной мышечной атрофии (СМА) у взрослых и детей с двух месяцев. Препарат может потенциально помочь до 4,9 тысяч российских пациентов со СМА разной степени тяжести, включая 1-й, 2-й, 3-й и 4-й типы. |
2020-12-10
Интервью Ситниковой Марии о перспективах терапии сердечной недостаточности в России
 | Интервью Марии Ситниковой по теме терапии хронической сердечной недостаточности в России. |
2020-11-26
Тикагрелор одобрен FDA для вторичной профилактики инсульта
 | FDA одобрило для тикагрелора новое показание – вторичную профилактику инсульта у пациентов, перенёсших острый ишемический инсульт или транзиторную ишемическую атаку. |
2020-11-26
Предложения FDA по увеличению разнообразия среди участников клинических исследований
 | Для дальнейшего укрепления и защиты общественного здоровья важно, чтобы люди, участвующие в клинических исследованиях, представляли те группы населения, которые с наибольшей вероятностью будут использовать разрабатываемый метод лечения. |
2020-11-26
Биктегравир и долутегравир связаны с метаболическими побочными эффектами
 | Ингибиторы интегразы биктегравир и долутегравир связаны с неблагоприятными метаболическими явлениями, в частности с диабетом и гипергликемией. |
2020-11-26
FDA присвоило статус прорывной терапии инъекционному каботегравиру для доконтактной профилактики ВИЧ
 | FDA присвоило статус прорывной терапии инъекционному препарату длительного действия каботегравиру, применяемому в качестве доконтактной профилактики ВИЧ, говорится в сообщении компании ViiV Healthcare. |














































