ОТ ГЛАВНОГО РЕДАКТОРА
ФАРМАКОЭКОНОМИКА
Проблема эффективного контроля сахарного диабета является актуальной в том числе и с точки зрения оптимального расходования ресурсов здравоохранения. Агонисты рецепторов глюкагоноподобного пептида-1 (арГПП-1) являются одной из наиболее современных опций для контроля гликемии при сахарном диабете 2 типа (СД 2) и входят во все современные рекомендации по управлению заболеванием. Экономические сравнительные аспекты применения этих препаратов в отечественных условиях не изучались. Материал и методы. На основе опубликованных данных клинических исследований проведена сравнительная экономическая оценка применения инсулина гларгин + ликсисенатид (иГлаЛикси), Эксенатида (Экс), дулаглутида (Дула), лираглутида (Лира) и комбинаций этих арГПП-1 с иГла 100 ЕД/мл. Критерием эффективности выбрано число больных (в %), достигших целевого уровня компенсации СД по гликированному гемоглобину (HbA1c) менее 7 %. Проведено непрямое сравнение с расчётом отношения шансов (OR) получения клинического эффекта. С помощью моделирования определены прямые (расходы на лекарства и лечение сердечно-сосудистых осложнений) и непрямые медицинские (оплата листков нетрудоспособности), а также непрямые немедицинские (потери ВВП) затраты. Проведён анализ чувствительности полученных результатов. Результаты. Фармакоэкономический анализ, основанный на непрямых сравнениях эффективности иГлаЛикси и Дула (оба препарата входят в Перечень ЖНВЛП), а также Лира и Экс (не входят в Перечень ЖНВЛП), показал экономические преимущества эффективного контроля СД 2. иГлаЛикси продемонстрировал существенные экономические преимущества как при сравнении с применением только арГПП-1 (снижение прямых затрат в сравнении с Экс на 23,8 %, с Дула — на 15,6 %, с Лира — на 54,4 %), так и их комбинаций с инсулином гларгин 100 ЕД/мл (снижение прямых затрат в сравнении с иГла + Экс на 16,2 %, с иГла + Дула — на 15,2 %). Общие расходы (прямые + непрямые) иГла Ликси снижал в большей степени в сравнении с Экс, Дула и Лира (на 19,9, 9,3 и 45,2 %, соответственно). Заключение. Эффективный контроль СД 2 с помощью современных арГПП-1 и препаратов на их основе является экономически выгодным с позиции государства вследствие уменьшения расходов на предупреждаемые осложнения заболевания.
Актуальность. Вирусная пандемия, вызванная коронавирусом SARS-CoV-2, привела к развитию новой коронавирусной болезни-2019 (COVID-19). Пандемия COVID-19 вынудила мобилизовать все доступные ресурсы систем здравоохранения. Имеются отдельные публикации о снижении риска развития коронавирусной инфекции у лиц, вакцинированных против гриппа. Цель: исследование экономической эффективности противогриппозной вакцинации в условиях «первой» волны СOVID-19. Материалы и методы. Были проанализированы архивные данные 2452 человек из числа заболевших работников ОАО «РЖД». Контрольную группу составили 2911 работников, не заболевших COVID-19, сравнимых по полу, возрасту и территории проживания. Для всех лиц рассчитывались баллы по шкале коморбидности Чарлсон. Фармакоэкономическую стоимость лечения пациента прогнозировали с использованием марковской модели. Результаты. Наличие прививки от гриппа в 1,3 раза снижало вероятность заболеть COVID-19. При наличии диагноза коронавирусной инфекции стационарное лечение привитым от гриппа требовалось в 2 раза реже, чем непривитым. По сравнению с ситуацией отсутствия вакцинированных лиц, в «первую волну» расчётная экономия средств на лечение пациентов с коронавирусной инфекцией составила 124 млн руб. При возрастании числа баллов по шкале коморбидности с 1 до 8 средняя стоимость лечения пациентов без предшествующей вакцинации против гриппа возрастала в 2 раза, а при наличии вакцинации средняя стоимость лечения возрастала в 1,7 раза. Заключение. Таким образом, в настоящем исследовании показано, вакцинация против гриппа обладает экономической эффективностью в отношении COVID-19. Эффект достигается за счёт снижения вероятности заболеть коронавирусной инфекцией при наличии прививки от гриппа.
Цель: обобщение информации об эффективности и потреблении препаратов октоког альфа и руриоктоктог альфа пэгол при стандартной профилактической терапии и профилактической терапии с использованием индивидуализированного подхода у пациентов с гемофилией А на основании опубликованных международных данных. Материалы и методы: был проведён систематический поиск и обзор литературы. Из выявленных в ходе систематического поиска 25 источников было отобрано 7 релевантных источников, описывающих результаты сравнения терапии препаратами октоког альфа и руриоктоког альфа пэгол у взрослых и детей с тяжёлой и среднетяжёлой формами гемофилии А с использованием персонифицированной оценки фармакокинетической кривой на основе программного обеспечения myPKFiT и стандартным режимом дозирования. Проводили объединение и анализ данных об отдельных пациентах во вторично выделяемых подгруппах, в том числе по возрасту, наличию кровотечений, риску кровотечений, связанному с повседневной физической активностью пациентов. Результаты. В наблюдательных исследованиях пересмотр режима дозирования октокога альфа на основании персонифицированной оценки фармакокинетической кривой с использованием myPKFiT привёл к сокращению объёма потребления лекарственных препаратов и/или к повышению эффективности профилактики кровотечений у пациентов с тяжёлой гемофилией А — сокращению среднегодовой частоты кровотечений. В продлённом контролируемом клиническом исследовании применения myPKFiT при терапии руриоктокогом альфа пэгол по сравнению с отсутствием персонификации выявлена тенденция к снижению частоты кровотечений и увеличению среднегодового потребления лекарственного препарата. В исследованиях по оценке одномоментного среза применение myPKFiT приводило к пересмотру режима применения менее чем у четверти пациентов. Заключение. Использование дозирования лекарственных препаратов октоког альфа и руриоктоког альфа пэгол на основе персонифицированной оценки фармакокинетической кривой с применением фармакокинетической популяционной модели приводит к обоснованному корректированию дозы и улучшению исходов.
ФАРМАКОЭПИДЕМИОЛОГИЯ
В современном мире одной из важных проблем оказания медицинской помощи в амбулаторных условиях остаётся бактериальная внебольничная пневмония (ВБП). Несмотря на высокую выявляемость и современные методы лечения, данное заболевание сохраняет за собой первое место среди причин смерти в категории инфекционных заболеваний. В медицинском вузе приобретаются необходимые знания о рациональном применении лекарственных препаратов, которые станут основой дальнейшей работы практикующего врача. Цель исследования: оценить сформированность навыка рационального выбора выпускниками медицинского вуза антимикробного препарата (АМП) для лечения нетяжёлой ВБП в амбулаторных условиях у пациентов без сопутствующих заболеваний и без факторов риска. В исследовании, проведённом в феврале-апреле 2019 г., приняли участие 240 студентов-медиков выпускного курса Московского государственного медико-стоматологического университета им. А.И. Евдокимова: 178 женщин (74,17 %) и 62 мужчины (25,83 %). Средний возраст опрошенных составил 24,8±3,3 года. Респондентам было предложено письменно указать АМП для стартовой амбулаторной терапии ВБП у молодого, ранее здорового мужчины. Был получен 271 вариант назначений АМП, причём 152 (56,1 %) были даны по международному непатентованному наименованию и 119 (43,9 %) — по торговому наименованию. АМП, рекомендованные для лечения нетяжёлой ВБП в амбулаторных условиях, указали только 46,2 % респондентов. Особое беспокойство вызывает то, что назначение АМП при ВБП выпускниками медицинских вузов лишь в 40—50 % соответствует клиническим рекомендациям, действующим в РФ. Правильный выбор АМП, основанный на ключевых критериях доказательной медицины, становится необходимым условием эффективной и безопасной антибиотикотерапии у пациентов с ВБП. Сегодня, кроме известных клинических аспектов, необходимо учитывать фармакоэкономические параметры обоснованного лечения ВБП. К таковым относятся не только прямые финансовые расходы, которые несут пациенты при покупке рекомендованного АМП, но также неоправданная лекарственная нагрузка, повышающая продолжительность лечения, риск нежелательных побочных явлений и, в конечном итоге, снижающая качество оказания медицинской помощи, что в свою очередь напрямую влияет на ожидаемый результат лечения. В современных реалиях выпускнику медицинского вуза необходимо приступать к практической работе в первичном звене здравоохранения с собственным формуляром лекарственных средств, который формируется на принципах рациональной фармакотерапии, согласовывая свои назначения в дальнейшем с актуальными положениями клинических рекомендаций.
БЕЗОПАСНОСТЬ ЛЕКАРСТВ
Поражение интерстиция лёгочной ткани является одной из причин дыхательной недостаточности. Лекарственные средства являются модифицируемым этиологическим фактором поражения лёгких. К препаратам, наиболее часто вызывающим лекарственно-индуцированные интерстициальные заболевания лёгких, относятся противоопухолевые препараты, болезнь-модифицирующие антиревматические препараты и амиодарон. Согласно последним литературным данным, описанная ранее связь между антиревматическими препаратами и интерстициальными заболеваниями лёгких весьма противоречива, и может даже наблюдаться протективное влияние препаратов данной группы на лёгочную ткань. Также является сложной и до конца не понятной взаимосвязь между приёмом статинов и поражением интерстиция. Как и в других группах пациентов, у лиц, принимающих статины, необходимо тщательно оценивать появление жалоб со стороны дыхательной системы и при необходимости назначать дополнительные методы диагностики для тщательного мониторинга и предотвращения токсического действия данных препаратов. Указанные меры, а также возможное назначение лекарственной терапии ГКС и изменение подходов к лечению основного заболевания являются важными факторами снижения случаев распространённости дыхательной недостаточности в популяции.
Вопрос подбора рациональной и безопасной лекарственной терапии был и остаётся актуальным для специалистов практического здравоохранения. Так, частота госпитализаций в связи с развитием осложнений фармакотерапии с 2000 по 2015 гг. оценивалась в 6,3 (3,3—11,0 %) для развитых стран и 5,5 % (1,1—16,9 %) для развивающихся государств. Известно, что приём алкоголя является фактором риска развития многих социально значимых заболеваний, в том числе артериальной гипертензии, ишемической болезни сердца, хронической сердечной недостаточности и др., однако многие врачи уделяют недостаточно внимания тому факту, что многие лекарственные средства, например, бетаадреноблокаторы, антидепрессанты, безодизепины, антагонисты кальция при одновременном употреблении с алкоголем, могут вступать во взаимодействие с ним и, тем самым, риски развития нежелательных реакций повышаются. Различают 2 основных типа взаимодействий между алкоголем и ЛС: фармакокинетические (на уровне абсорбции, распределения, метаболизма и элиминации) и фармакодинамические (на уровне эффектов и рецепторов). Так, на фоне одновременного приёма алкоголя и парацетамола усиливается образование токсических метаболитов на фоне индукции изоферментов цитохрома Р450 алкоголем; снижение пресистемной элиминации и стимуляция метаболизма трициклических антидепрессантов; увеличение элиминации имипрамина и дезипрамина у пациентов с хроническим алкоголизмом после проведения дезинтоксикационной терапии и так далее. В данной статье авторами проведён анализ и систематизация данных открытых литературных источников с целью информирования специалистов практического здравоохранения о возможных рисках, обусловленных взаимодействием алкоголя и ЛС различных фармакологических групп.
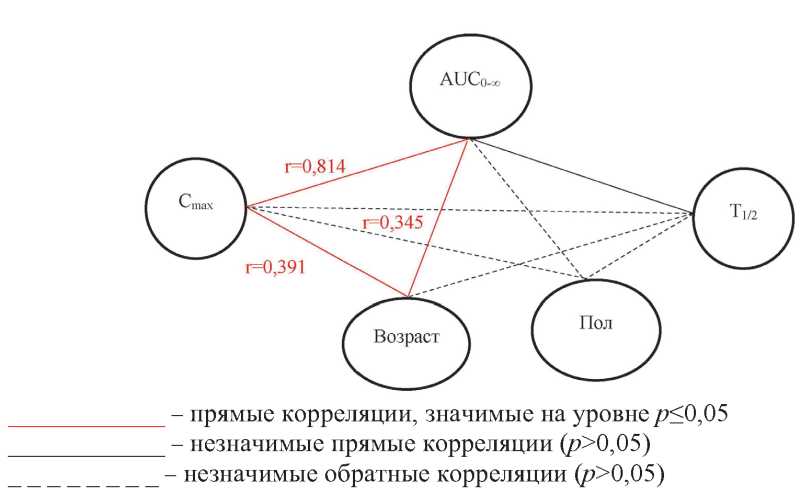
ФАРМАКОКИНЕТИКА
Флударабин является антиметаболитом из группы пуринов, обладает выраженным иммуносупрессивным эффектом. Ингибирующий эффект флударабина зависит от его концентрации в плазме крови. Кроме того, фенотипические характеристики пациентов оказывают влияние на фармакокинетический и фармакодинамический профиль лекарственного соединения, что обусловливает необходимость персонифицированного подхода к режиму дозирования. Для изучения индивидуальных показателей фармакокинетики у пациентов с В-клеточным хроническим лимфолейкозом при стандартном курсе лечения препаратом с международным непатентованным наименованием (МНН) флударабин был разработан и валидирован в соответствии с международными требованиями хромато-масс-спектрометрический метод количественного определения в плазме крови 2-фтор-ара-А — активного метаболита флударабина фосфата. Установлена значительная индивидуальная вариабельность основных фармакокинетических показателей у пациентов с В-клеточным хроническим лимфолейкозом при однократном приёме перорально препарата с МНН флударабин в дозе 40 мг/м2, так коэффициент вариабельности Cmax составил 42 %, Tmax – 92 %, AUC0-t — 45 %, Kel — 23 %, T1/2 — 26 %. Следует отметить и высокую межиндивидуальная вариабельность флударабина, к примеру, через 24 ч после приёма исследуемого препарата максимальная и минимальная концентрации в плазме крови метаболита флударабина 2-фтор-ара-А у разных пациентов с В-клеточным хроническим лимфолейкозом различалась в 9 раз. Индивидуальная вариабельность фармакокинетических параметров, характеризующих всасывание (Cmax/AUC0-t) и общий клиренс активного метаболита флударабина, статистически значимо связана с сочетанием гендерных и антропометрических факторов.
ФАРМАКОГЕНЕТИКА
Введение. Антипсихотики являются основными препаратами для лечения расстройств шизофренического спектра. Фармакодинамические генетические факторы активно изучаются для повышения точности подбора антипсихотиков на основе фармакогенетического тестирования. Цель настоящего исследования: установить ассоциации полиморфных вариантов генов DRD2, DRD3, DRD4, HTR2A, COMT, ZNF804A и ANKS1B с эффективностью и безопасностью антипсихотиков у подростков с острым психотическим эпизодом в течение 28 дней наблюдения. Материалы и методы. В исследование были включены 68 подростков с установленным диагнозом острое полиморфное психотическое расстройство на момент поступления (F23.0-9 по МКБ-10). Все пациенты получали антипсихотик в качестве основной терапии. Наблюдение за пациентами проводилось в течение 28 дней. Эффективность антипсихотиков оценивалась при помощи шкал Children’s Global Assessment Scale (CGAS), Positive and Negative Symptoms Scale (PANSS), Clinical Global Impression Severity (CGI-S) and Improvement (CGI-I). Безопасность фармакотерапии оценивалась по шкалам UKU Side Effects Rating Scale (UKU SERS), Sympson-Angus Scale (SAS), Barnes Akathisia rating scale (BARS). Определение полиморфных вариантов генов DRD2 rs1800497 (C>T), DRD3 rs6280 (C>T), DRD3 rs324026 (C>T), DRD4 rs1800955 (C>T), HTR2A rs6313 (T>C), COMT rs4680 (Val158Met, G>A), ZNF804A rs1344706 (A>C), ANKS1B rs7968606 (C>T) осуществлялось методом полимеразной цепной реакции (ПЦР) в реальном времени. Результаты. У носителей аллели T DRD2 rs1800497 подшкала PANSS «Продуктивная симптоматика» сильнее редуцировалась на 14-й (Me=-7,0 [-9,0;-5,0] vs. Me=-7,0 [-8,0; -2,0]; p=0,018) и 28-й день наблюдения (Me=-11,0 [-9,0;-5,5] vs. Me=-8,0 [-8,0; -2,0]; p=0,019). Также более выраженное улучшение состояния по шкале CGAS на 14-й день наблюдения было отмечено у носителей TC+CC HTR2A rs6313 (Me=2,0 [1,0; 3,0] vs. Me=2,0 [1,0; 2,0]; p=0,029). У гомозиготных носителей DRD3 rs324026 (TT) на 28-е сутки терапии был значимо ниже балл шкалы SAS (Me=0,5 [0,0; 1,0] vs. Me=1,0 [0,0; 5,0]; p=0,016) и подшкалы UKU «Неврологические нарушения» на 28-е сутки приёма антипсихотиков (Me=0,0 [0,0; 0,0] vs. Me=1,0 [0,0; 3,8]; p=0,005). Также у носителей DRD3 rs324026 (TT) была ниже выраженность акатизии по шкале BARS. У носителей аллели T DRD4 rs1800955 балл шкалы SAS на 28-е сутки терапии был выше по сравнению с гомозиготами CC (Me=1,0 [0,0;4,0] vs. Me=0,0 [0,0; 1,0]; p=0,036). Заключение. Полиморфный вариант DRD2 rs1800497 был предиктором лучшей редукции продуктивной симптоматики, аналогичную связь продемонстрировал HTR2A rs6313. DRD3 rs324026 и HTR2A rs6313 были ассоциированы с меньшей частотой неврологических нежелательных реакций и акатизии. Напротив, носители полиморфного варианта DRD4 rs1800955 были более склонны к нежелательным реакциям на фоне фармакотерапии.
БИОМЕДИЦИНСКАЯ ЭТИКА
В данной статье изложены вопросы биоэтики, связанные с применением технологии Интернета тела (Internet of Bodies; IoB) в здравоохранении, т. н. медицинских IoB-изделий. Производители медицинских IoB-изделий обещают обеспечить существенную пользу для здоровья, улучшить результаты лечения и другие преимущества, но такие IoB также несут и серьёзные риски для здоровья и жизни, включая риски взлома (киберхакинга), неисправности, получения ложноположительных результатов измерений, нарушения конфиденциальности, умышленного вторжения в частную жизнь. Кроме того, медицинские IoB-изделия могут напрямую причинить физический вред человеческому телу. По мере того, как человеческая плоть будет переплетаться с оборудованием, программным обеспечением и алгоритмами, IoB будет проверять наши общественные моральные ценности и этические нормы. В частности, IoB бросят вызов представлениям о человеческой автономии и самоуправлении, поскольку они создают определённую угрозу автономии человека. Таким образом, защита автономии человека должна стать основным этическим принципом применения медицинских IoB-изделий.
ISSN 2618-8473 (Online)