Перейти к:
Индивидуальные особенности фармакокинетики флударабина фосфата при лечении пациентов с хроническим лимфолейкозом
https://doi.org/10.37489/2588-0519-2021-2-67-77
Аннотация
Флударабин является антиметаболитом из группы пуринов, обладает выраженным иммуносупрессивным эффектом. Ингибирующий эффект флударабина зависит от его концентрации в плазме крови. Кроме того, фенотипические характеристики пациентов оказывают влияние на фармакокинетический и фармакодинамический профиль лекарственного соединения, что обусловливает необходимость персонифицированного подхода к режиму дозирования. Для изучения индивидуальных показателей фармакокинетики у пациентов с В-клеточным хроническим лимфолейкозом при стандартном курсе лечения препаратом с международным непатентованным наименованием (МНН) флударабин был разработан и валидирован в соответствии с международными требованиями хромато-масс-спектрометрический метод количественного определения в плазме крови 2-фтор-ара-А — активного метаболита флударабина фосфата. Установлена значительная индивидуальная вариабельность основных фармакокинетических показателей у пациентов с В-клеточным хроническим лимфолейкозом при однократном приёме перорально препарата с МНН флударабин в дозе 40 мг/м2, так коэффициент вариабельности Cmax составил 42 %, Tmax – 92 %, AUC0-t — 45 %, Kel — 23 %, T1/2 — 26 %. Следует отметить и высокую межиндивидуальная вариабельность флударабина, к примеру, через 24 ч после приёма исследуемого препарата максимальная и минимальная концентрации в плазме крови метаболита флударабина 2-фтор-ара-А у разных пациентов с В-клеточным хроническим лимфолейкозом различалась в 9 раз. Индивидуальная вариабельность фармакокинетических параметров, характеризующих всасывание (Cmax/AUC0-t) и общий клиренс активного метаболита флударабина, статистически значимо связана с сочетанием гендерных и антропометрических факторов.
Ключевые слова
Для цитирования:
Родионов Г.Г., Шантырь И.И., Василюк В.Б., Колобова Е.А., Светкина Е.В., Фарапонова М.В., Верведа А.Б., Сыраева Г.И., Захаров К.А. Индивидуальные особенности фармакокинетики флударабина фосфата при лечении пациентов с хроническим лимфолейкозом. Качественная клиническая практика. 2021;(2):67-77. https://doi.org/10.37489/2588-0519-2021-2-67-77
For citation:
Rodionov G.G., Shantyr I.I., Vasilyuk V.B., Kolobova E.A., Svetkina E.V., Faraponova M.V., Verveda A.B., Syraeva G.I., Zakharov K.A. Individual features of the pharmacokinetics of fludarabin phosphate in the treatment of patients with chronic lymphocytic leukemia. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2021;(2):67-77. (In Russ.) https://doi.org/10.37489/2588-0519-2021-2-67-77
Введение / Introduction
Универсальный механизм метаболизма лекарственного средства в каждом конкретном случае реализуется в зависимости от функционального статуса организма, который в свою очередь определяется особенностями его гено- и фенотипа.
Несомненно, велико значение генетических полиморфизмов ферментов метаболизма ксенобиотиков в формировании индивидуального ответа на фармакотерапию. Эти генетические факторы представляют собой полиморфные участки генов, которые обусловливают особенности белкового синтеза, определяющего через ферментативную систему фармакодинамику и фармакокинетику [1—5].
Персонализация лекарственной терапии с помощью генотипирования на практике не оправдала надежд [6]. Это обусловлено тем, что в процессе жизни наслаивается приобретаемый динамичный детоксикационный потенциал ко всем ксенобиотикам, в том числе лекарственным средствам. На первый план выступает индивидуальный фенотип метаболизма, который в каждый конкретный момент зависит от множества факторов, предсказать и учесть которые практически невозможно. В первую очередь реакция на действие лекарственного препарата зависит от функционального состояния органов, отвечающих за метаболизм и элиминацию — печень, почки, кишечник.
Также широко известно, что фармакологический ответ в ходе применения лекарственных препаратов у различных больных неодинаков и зависит от антропометрических характеристик, образа жизни, характера питания, сопутствующих заболеваний [7][8].
Таким образом, индивидуальный фармакодинамический профиль конкретного лекарственного соединения оказывает существенное влияние на эффективность проводимой терапии, что вызывает необходимость персонифицированного подхода к режиму его дозирования и введения [9]. Особенно это актуально для лекарственных средств с узким терапевтическим диапазоном и при тех заболеваниях, от эффективности терапии которых зависит жизнь пациента. Прежде всего это касается онкологической патологии.
В последние годы в лечении лимфопролиферативных заболеваний достигнуты определённые успехи благодаря введению в стандарты терапии новых химиопрепаратов. Один из них: флударабин — цитостатик, имеющий благоприятный профиль безопасности и переносимости.
Флударабин (F-ara-A) представляет собой пуриновый аналог, обычно используемый для лечения В-клеточных злокачественных новообразований, который влияет на различные этапы синтеза ДНК и РНК.
Целью настоящего исследования явилось изучение влияния на модельные параметры фармакокинетики индивидуальных характеристик пациентов с В-клеточным хроническим лимфолейкозом при стандартном курсе лечения препаратом МНН флударабин.
Материалы и методы / Material and methods
Настоящее исследование проводилось в соответствии с международными стандартами, а также в соответствии с этическими принципами, изложенными в Хельсинской декларации [10]. В исследование было включено 36 пациентов обоего пола с В-клеточным хроническим лимфолейкозом в возрасте от 45 до 65 лет включительно. Диагноз В-клеточного хронического лимфолейкоза (ХЛЛ) установлен согласно рекомендациям рабочей группы NCI (англ. National Cancer Institute) [11]. Установленный диагноз В-клеточного ХЛЛ был подтверждён результатами биопсии костного мозга и иммунофенотипирования, давностью не более 3 месяцев, на стадии А или В по классификации Binet, требующий лечения. Балл по шкале ECOG составил 0—2. Клинические ковариаты для стандартного пациента были основаны на средней оценке дозы, рассчитанной по площади поверхности тела (ППТ) в соответствии с клиническими рекомендациями. Так как флударабин вводился в виде монофосфатной формы, основанная на модели доза F-ara-A была умножена в 1,28 раза для преобразования в эквивалентные дозы F-ara-AMP (на основе соотношения молекулярных масс) [12].
Все пациенты получали препарат c МНН флударабин в дозе 40 мг/м2 один раз в день перорально в течение 5 дней подряд натощак. Дозы исследуемого препарата были рассчитаны исходя из количества миллиграммов флударабина фосфата на квадратный метр ППТ, измеренной перед назначением исследуемого препарата (мг/м2). ППТ пациента была вычислена согласно методу Mosteller: ППТ (м2) = V (рост пациента (см) × масса тела (МТ) (кг))/3600. Выбранная доза препарата и продолжительность курса лечения пациентов полностью соответствовали утверждённой инструкции по медицинскому применению [13].
Согласно исследованиям фармакокинетики и фармакодинамики, в организме человека флударабин быстро и полностью дефосфорилируется до активного метаболита — нуклеозида 2-фтор-арабинофуранозиладенин (2-фтор-ара-А). После приёма внутрь флударабина максимальные уровни 2-фтор-ара-А в плазме достигаются через 1—2 часа. Средняя биодоступность 2-фтор-ара-А находится в пределах 50—65 %. Терминальный период полувыведения 2-фтор-ара-А составляет примерно 20 часов [14][15].
Забор образцов крови для определения концентрации 2-фтор-ара-А (основного метаболита флударабина) в первый день приёма препарата производился непосредственно перед приёмом и спустя 15 мин, 30 мин, 45 мин, 1, 1½, 2, 3, 4, 6, 8, 10 и 24 часа после приёма. Забор образцов крови производился в подписанные 5 мл пробирки c антикоагулянтом (ЭДТА, этилендиаминтетраацетат), предназначенным для получения плазмы крови. Плазму немедленно отделяли центрифугированием при 10 ºС, 2500 оборотах в течение 15 минут.
Для изучения индивидуальных показателей фармакокинетики у пациентов с В-клеточным хроническим лимфолейкозом при стандартном курсе лечения препаратом с международным непатентованным наименованием (МНН) флударабин был разработан и валидирован в соответствии с требованиями Европейского экономического сообщества (ЕЭС) и Европейского агентства лекарственных средств (англ. European Medicines Agency; EMA) хромато-масс-спектрометрический метод количественного определения в плазме крови 2-фтор-ара-А — активного метаболита флударабина фосфата [4, 16]. В качестве основы для разработки метода взяты данные публикаций [17][18]. Методика реализована на высокоэффективном жидкостном хроматографе «Agilent 1200» с тройным квадруполем «Agilent 6460», США. Валидация методики включала: линейность метода; установление пределов количественного определения; точность и достоверность внутри аналитической серии; точность и достоверность между аналитическими сериями; селективность; стабильность аналита. Линейный диапазон метода составил — 2,5—500 нг/мл, R^2>0,99. 2-фтор-ара-А экстрагировали из образцов плазмы крови объёмом 200 мкл путём осаждения белков ацетонитрилом, содержащим 0,1 % муравьиной кислоты. В качестве внутреннего стандарта использовался кладрибин. Разделение осуществлялось на аналитической колонке Zorbax Eclipse Plus C18 Analytical 250 мм × 4,6 мм × 5 мкм в изократическом режиме со скоростью потока 0,5 мл/мин. В качестве элюента использовалась смесь ацетонитрила и воды, содержащей 0,1 % муравьиной кислоты в соотношении 1:3. Использовали систему ионизаций электроспрей в положительной полярности (ESI +) и мониторинг множественных реакций (MRM). Для количественного определения выбраны ионные пары 286,1/154,1 для 2-фтор-ара-А и 286,1/170,0 для внутреннего стандарта. Время удержания 2-фтор-ара-А составляло 5,03 мин. Общее время анализа — 6,5 минут. Используемый простой способ осаждения белков при приготовлении образцов и быстрое хроматографическое разделение аналита и эндогенных компонентов плазмы крови показал приемлемый результат без каких-либо значимых эффектов наложения. Воспроизводимость, прецизионность и правильность достигалась во всём интервале концентраций. Аналит оставался стабильным как при краткосрочном, так и при долгосрочном хранении. Отклонения результатов анализа образцов, прошедших 3 цикла заморозки и разморозки, от свежеприготовленных образцов не превышали 15 %. Готовые к анализу образцы плазмы с добавлением оставались стабильны после 24 часов хранения в автосамплере при комнатной температуре.
Математико-статистический анализ результатов осуществляли с использованием пакетов Microsoft Excel 2013, STATISTICA 10.0 и программы PKSolver [19].
Фармакокинетические параметры (ФКП) рассчитывали с применением модельно-независимого подхода [20], а также использовали одно- и двухкамерных моделей, построенных с применением программы PKSolver.
Для оценки возможной связи индивидуальных особенностей исследуемых лиц (антропометрических факторов) с ФКП использовали коэффициент ранговой корреляции Спирмена (для количественных переменных) и точечно-бисериальный коэффициент корреляции (взаимосвязь дихотомических переменных (гендерной принадлежности) и ФКП).
Эффекты взаимодействия антропометрических факторов и их возможное влияние на ФКП оценивали с использованием модуля GLM (Общие линейные модели) программы STATISTICA 10.0
Результаты / Results
Результаты измерения концентрации 2-фторара-А в плазме крови пациентов с В-клеточным хроническим лимфолейкозом при однократном приёме перорально препарата с МНН флударабин в дозе 40 мг/м2 представлена на рис. 1.
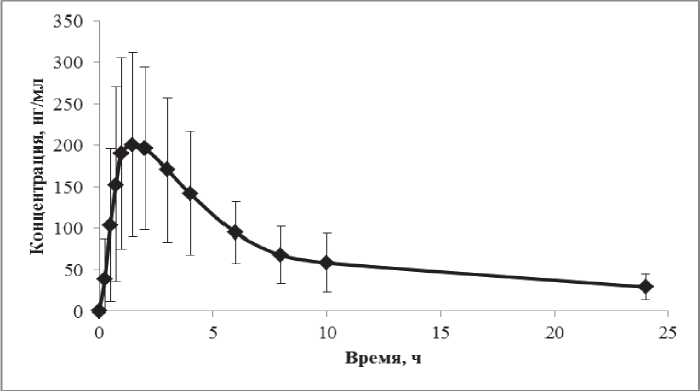
Рис. 1. Усреднённые значения концентрации 2-фтор-ара-А в плазме крови пациентов с В-клеточным хроническим лимфолейкозом при однократном приёме перорально препарата с МНН флударабин в дозе 40 мг/м2
Figure 1. Mean of the concentration of 2-fluoro-ara-A in the blood plasma of patients with B-cell chronic lymphocytic leukemia aft er a single oral administration of the drug with INN fl udarabine at a dose of 40 mg/m2
Отмеченные на рис. 1 значительные стандартные отклонения концентрации 2-фтор-ара-А во всех временных точках забора крови свидетельствуют о его значительной индивидуальной вариабельности. Это подтверждается статистическими показателями, приведёнными в табл. 1.
Таблица 1
Статистические показатели, характеризующие фармакокинетику и индивидуальные различия концентрации 2-фтор-ара-А в плазме крови пациентов с В-клеточным хроническим лимфолейкозом при однократном пероральном приёме препарата с МНН флударабин
Table 1
Statistics of pharmacokinetics and individual diff erences concentration of 2-fluoro-ara-A in the blood plasma of patients with B-cell chronic lymphocytic leukemia aft er a single oral admission of the drug with the INN fludarabine

Примечания: Cmax — максимальное значение концентрации; Tmax — время достижения максимальной концентрации; AUC0-t — площадь под фармакокинетической кривой начиная с момент приёма препарата до последнего забора крови; Kel — константа выведения; T1/2 — период полувыведения препарата.
Notes: Cmax — maximum concentration value; Tmax — time to reach maximum concentration in plasma; AUC0-t — area under the curve from the moment of taking the drug until the last blood sampling; Kel — derivation constant; T1/2 — elimination half-life.
Приведённые в табл. 1 статистические данные убедительно показывают вариабельность откликов организма отдельных пациентов на одинаковую дозу принимаемого препарата. Разброс крайних значений, приведённый в последней строке таблицы по всем показателям фармакокинетической кривой и графически отражённый на рис. 2, даёт основание для вывода о необходимости использования индивидуального подбора эффективной дозы.

Рис. 2. Крайние значения фармакокинетики концентрации 2-фтор-ара-А в плазме крови пациентов с В-клеточным хроническим лимфолейкозом при однократном приёме перорально препарата с МНН флударабин в дозе 40 мг/м2
Figure 2. Th e extreme pharmacokinetics values of 2-fl uoro-ara-A in the blood plasma of patients with B-cell chronic lymphocytic leukemia aft er a single oral admission of the drug with the INN fl udarabine at a dose of 40 mg/m2
Обращает на себя внимание, что через 24 ч после однократного приёма препарата с МНН флударабин в дозе 40 мг/м2 максимальная концентрация 2-фтор-ара-А в плазме крови разных пациентов с В-клеточным хроническим лимфолейкозом составляла 92,9 нг/мл, а минимальная — 10,3 нг/мл, т. е. различалась в 9 раз. С учётом того, что продолжительность курса лечения пациентов составляет 5 дней, последующий приём препарата будет наслаиваться на остаточную его дозировку от предыдущего приёма, а значит, индивидуальные различия в концентрации 2-фтор-ара-А в плазме крови пациентов будут только увеличиваться.
Принимая во внимание возможное влияние антропометрических характеристик пациентов на индивидуальный фармакокинетический профиль, проводили анализ их взаимосвязи с применением корреляционного анализа. В качестве основных индивидуальных показателей использовали пол и возраст, т. к. дозирование препарата с учётом площади тела априори учитывало рост и массу тела (МТ) пациентов.
Анализ корреллограммы основных ФКП и гендерно-возрастных переменных (рис. 3) показал, что прямая, статистически значимая (р≤0,05) корреляционная связь высокой тесноты по шкале Чеддока (rs равен 0,814) отмечена только между фармакокинетическими показателями Cmax и AUC0-∞. Между возрастными данными и Cmax, AUC0-∞ также установлены прямые статистически значимые связи (р≤0,05), однако сила связи по шкале Чеддока отнесена к категории «умеренная» (от 0,3 до 0,5). Между гендерно-возрастными переменными и периодом полувыведения, а также другими ФКП, не представленными на рис. 3, статистически значимых выраженных связей установлено не было.
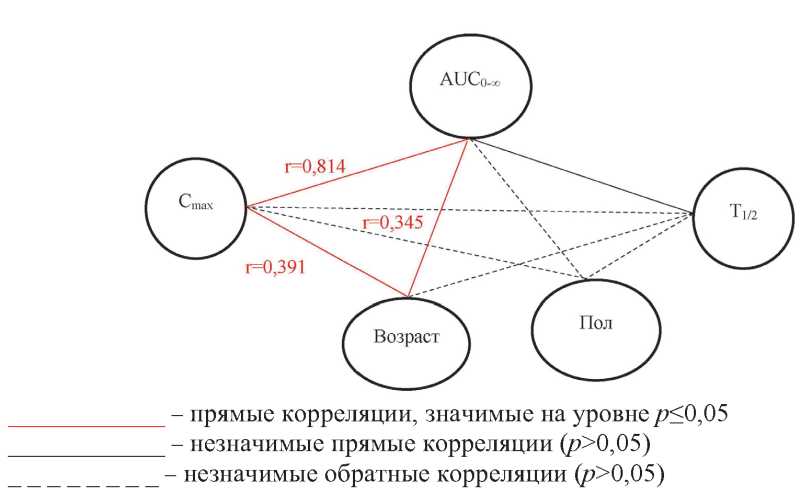
Рис. 3. Коррелограмма ФКП и гендерно-возрастных переменных пациентов при однократном приёме препарата с МНН флударабин в дозе 40 мг/м2
Figure 3. Correlogram of pharmacokinetics and gender-age variables of patients with a single dose of the drug with INN fludarabine at dose of 40 mg/m2
Приведённые на рис. 3 данные свидетельствовали о том, что анализируемые параметры зависели от фенотипических особенностей организма, включающих антропометрических характеристики пациентов, которые целесообразно учитывать при дозировании. Однако уровень взаимосвязи отдельных признаков выражен незначительно, что требует комплексного учёта влияния гендерно-антропометрических переменных.
Для оценки возможного влияния на ФКП как отдельных показателей (факторов), характеризующих пациентов на организменном уровне, так и их взаимодействия применяли модуль GLM (Общие линейные модели) программы STATISTICA 10.0. Модуль GLM предоставляет различные модели для анализа планов дисперсионного анализа с непрерывными и категориальными предикторами. В качестве зависимых переменных выступали отдельные ФКП, в качестве категориального предиктора — пол, в качестве непрерывных предикторов — возраст и масса тела.
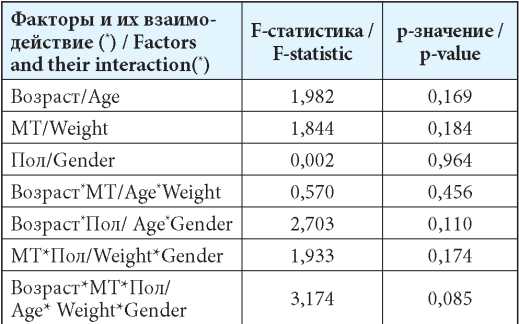
Результаты факторного дисперсионного анализа с использованием модуля GLM показали (табл. 2), что ни один из анализируемых факторов, а также их взаимодействие не оказали статистически значимого влияния на уровень AUC0-∞.
Таблица 2
Результаты факторного дисперсионного анализа значений фармакокинетического параметра AUC0-∞ с использованием модуля GLM
Table 2
The results of the factorial analysis of variance of the values of the pharmacokinetic parameter AUC0-∞ using the GLM module
Аналогичные результаты были получены в отношении значительной части изучаемых ФКП — AUC0-t, Cmax, T1/2 и Kel. Однако на часть показателей, рассчитываемых с использованием модельно-независимого метода — MRT (среднее время удержания препарата в крови), Cl/F (общий клиренс без учёта абсолютной биодоступности (F)), Cmax/AUC0-t (показатель относительной скорости всасывания) — анализируемые факторы оказали статистически значимое воздействие (табл. 3—5).
Таблица 3
Результаты факторного дисперсионного анализа значений фармакокинетического параметра MRT с использованием модуля GLM
Table 3
Results of the factorial dispersive analysis of the values of the pharmacokinetic parameter MRT using the GLM module
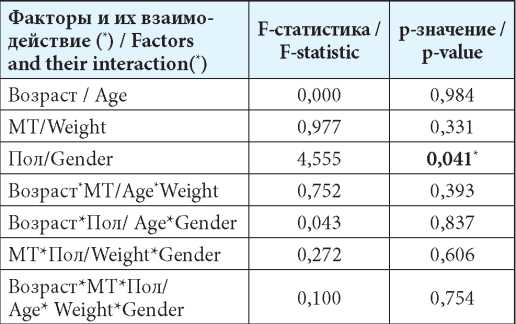
Примечание: * — влияние фактора (взаимодействия факторов) на ФКП статистически значимо (р≤0,05).
Note: * — the infl uence of the factor (interactions of factors) on the pharmacokinetics is statistically signifi cant (p≤0.05).
Таблица 4
Результаты факторного дисперсионного анализа значений фармакокинетического параметра Cl/F с использованием модуля GLM
Table 4
Results of the factorial dispersive analysis of the values of the pharmacokinetic parameter CI/F (total clearance excluding absolute bioavailability) using the GLM module
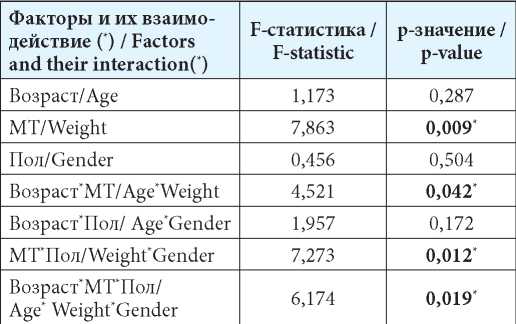
Примечание: * — влияние фактора (взаимодействия факторов) на ФКП статистически значимо (р≤0,05).
Note: * — the infl uence of the factor (interactions of factors) on the pharmacokinetics is statistically signifi cant (p≤0.05).
Таблица 5
Результаты факторного дисперсионного анализа значений фармакокинетического параметра Cmax/AUC0-t с использованием модуля GLM
Table 5
The results of the factorial dispersive analysis of the values of the pharmacokinetic parameter Cmax/AUC0-t using the GLM module
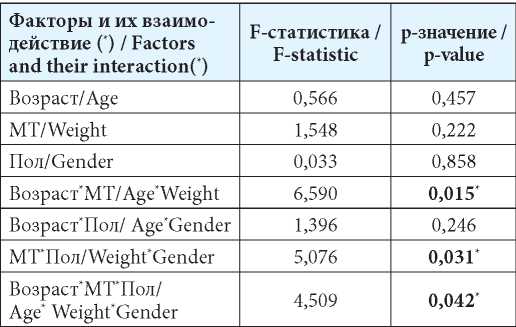
Примечание: * — влияние фактора (взаимодействия факторов) на ФКП статистически значимо (р≤0,05).
Note: * — the infl uence of the factor (interactions of factors) on the pharmacokinetics is statistically signifi cant (p≤0.05).
Представленные в таблицах 3—5 данные подтверждали гипотезу, высказанную по результатам проведения корреляционного анализа, о необходимости учёта гендерно-антропометрических признаков пациентов, включая их взаимодействие, при назначении и корректировке дозировки препарата с МНН флударабин.
Целесообразность персонифицированного подхода к режиму дозирования и введения определяет как необходимость проведения терапевтического лекарственного мониторинга (ТЛМ), так и, в качестве альтернативы, применение математического моделирования параметров фармакокинетики.
К известным примерам фармакокинетического моделирования относится применение медицинских калькуляторов [21]. Часто в качестве основы при математическом моделировании лекарственных препаратов с узким терапевтическим диапазоном используют однокамерную модель [22].
Для решения задач настоящей работы на основе данных о концентрации 2-фтор-ара-А в плазме крови пациентов были получены одно- и двухкамерные модели. В качестве показателей качества построенной модели использовали коэффициент детерминации (R2), представляющий долю дисперсии зависимой переменной (концентрации), объясняемой рассматриваемой моделью, и среднеквадратическую ошибку модели (MSE), которая представляет собой отклонения экспериментальных данных от полученных в ходе оптимизации теоретических кривых. Полученные результаты сравнительной оценки свидетельствовали о более высоком качестве двухкамерной модели как в целом (табл. 6), так и, в частности, на терминальном участке фармакокинетической кривой (рис. 4). Согласно приведённым раннее данным, терминальный период полувыведения 2-фтор-ара-А составляет примерно 20 часов [16, 17]. В настоящем исследовании усреднённые значения представленного показателя составили для бескамерной, одно- и двухкамерных моделей, соответственно, 12,2; 3,5 и 19,0 ч.
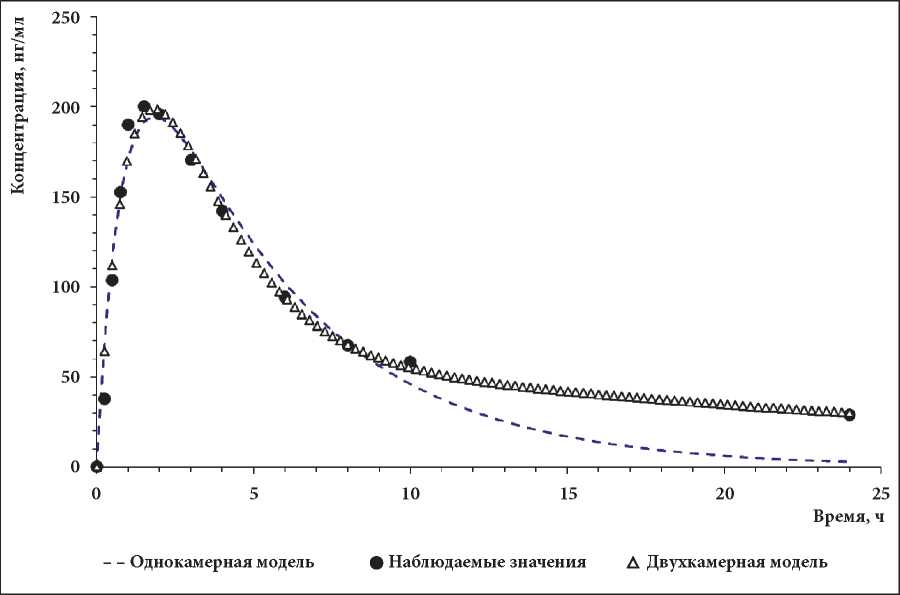
Рис. 4. Модельные (однокамерная и двухкамерная модели) и наблюдаемые усреднённые значения концентрации 2-фтор-ара-А в плазме крови пациентов с В-клеточным хроническим лимфолейкозом при однократном приёме перорально препарата с МНН флударабин в дозе 40 мг/м2
Figure 4. Model (one-chamber and two-chamber models) and observed averaged values of the concentration of 2-fluoro-ara-A in the blood plasma of patients with B-cell chronic lymphocytic leukemia aft er a single oral admission of the drug with the INN fludarabine at a dose of 40 mg/m2
Таблица 6
Параметры качества одно- и двухкамерных моделей зависимости концентрации 2-фтор-ара-А в плазме крови пациентов при однократном приёме перорально препарата с МНН флударабин в дозе 40 мг/м2
Table 6
Quality parameters of one- and two-chamber models of the concentration of 2-fl uoro-ara-A in the blood plasma of patients with a single oral admission of the drug with the INN fl udarabine at a dose of 40 mg/m2
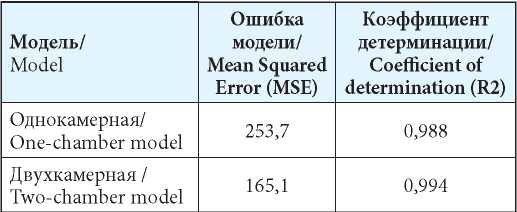
Результаты анализа взаимосвязей индивидуальных ФКП и возможностей их аппроксимации свидетельствовали о том, что для корректировки терапии необходим как учёт клинико-физиологических особенностей пациентов, так и применение математических моделей фармакокинетики. Для случая перорального приёма препарата с МНН флударабин в дозе 40 мг/м2 в качестве основы целесообразно использовать двухкамерную модель.
Обсуждение / Discussion
Как правило, для определённого лекарственного препарата или его активного метаболита имеется субстратная специфичность, которая обусловлена генои фенотипом организма пациента, индивидуальную активность которых можно оценить лабораторными методами. В результате на основании оценки в динамике концентрации конкретного метаболита в плазме крови пациента формируется индивидуальная фармакокинетика лекарственного препарата [2].
Сложная система кинетики лекарственного препарата зависит от генотипических и фенотипических особенностей конкретного человека, которые необходимо учитывать при реализации одного из основополагающих принципов персональной медицины: «подходящая доза подходящего лекарства для данного пациента». Внедрение принципов персонализированной медицины естественно направлено на повышение качества лечения [23]. Для приемлемой клинической аппроксимации с целью индивидуального выбора дозировки целесообразно использование фармакокинетических моделей, позволяющих, в отличие от бескамерного подхода, количественно оценивать все основные этапы метаболизма лекарственного препарата [24].
Проведённое нами исследование, изложенное в данной статье, убедительно показывает необходимость индивидуального подбора эффективной дозы лечения. В нашем случае даже учёт площади поверхности тела пациента при расчёте необходимой дозы препарата не ликвидировал значительные индивидуальные различия метаболического профиля медикаментозной субстанции. Это входит в некоторое противоречие с постулированными стандартными схемами лечения препаратами, особенно с узким терапевтическим диапазоном.
Использованная в исследовании аналитическая технология высокоэффективной жидкостной хроматографии с тандемным масс-спектрометрическим детектированием позволяет адекватно оценить индивидуальный метаболический фенотип и реализовать на практике концепцию фармакометаболомики персональной лекарственной терапии, сформулированной авторами [25].
Выводы / Conclusion
1. Разработанная и валидированная методика количественного определения концентрации 2-фтор-ара-А — активного метаболита флударабин фосфата в плазме крови человека методом высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием — позволила достичь цели исследования.
2. Установлена значительная индивидуальная вариабельность основных фармакокинетических показателей при однократном приёме перорально препарата с МНН флударабин в дозе 40 мг/м2, так коэффициент вариабельности Cmax составил 42 %, Tmax — 92 %, AUC0-t — 45 %, Kel — 23 %, T1/2 — 26 %. Через 24 ч после приёма исследуемого препарата максимальная и минимальная концентрации в плазме крови метаболита флударабина 2 у пациентов с В-клеточным хроническим лимфолейкозом различалась в 9 раз.
3. Индивидуальная вариабельность отдельных фармакокинетических параметров, в частности, характеризующих всасывание (Cmax/AUC0-t) и общий клиренс активного метаболита флударабина, статистически значимо связана с сочетанием гендерно-антропометрических факторов.
4. При пероральном приёме препарата с МНН флударабин в дозе 40 мг/м2 концентрация 2-фторара-А в плазме крови пациентов достаточно адекватно аппроксимируется двухкамерной фармакокинетической моделью.
5. Подбор индивидуального курса терапии пациентов с В-клеточным хроническим лимфолейкозом препаратом с МНН флударабин целесообразно осуществлять на основании учёта гендерно-антропометрических характеристик и математического моделирования показателей фармакокинетики активного метаболита флударабин фосфата.
Список литературы
1. Баранов В.С., Баранова Е.В., Иващенко Т.Э., Асеев М.В. Геном человека и гены «предрасположенности». Введение в предиктивную медицину. — СПб.: Интермедика; 2000.
2. Кукес В.Г. Метаболизм лекарственных средств: клинико-фармакологические аспекты. — М.: Реафарм; 2004.
3. Кукес В.Г., Грачев С.В., Сычев Д.А., Раменская Г.В. Метаболизм лекарственных средств: научные основы персонализированной медицины. — М.: ГЭОТАР-Медиа; 2008.
4. Правила проведения исследований биоэквивалентности лекарственных препаратов в рамках Евразийского экономического союза, утверждены Решением Совета Евразийской экономической комиссии от 3 ноября 2016 г. № 85. Доступно по: http://docs.cntd.ru/document/456026107 Ссылка активна на 01.06.2021.
5. Bogni A, Monshouwer M, Moscone A, Hidestrand M, IngelmanSundberg M, Hartung T, Coecke S. Substrate specific metabolism by polymorphic cytochrome P450 2D6 alleles. Toxicol in Vitro. 2005:19(5):621-9. doi: 10.1016/j.tiv.2005.04.001.
6. Nicholson JK, Wilson ID. Opinion: understanding ‘global’ systems biology: metabonomics and the continuum of metabolism. Nat Rev Drug Discov. 2003;2(8):668-76. doi: 10.1038/nrd1157.
7. Сычев Д.А. Клиническая фармакогенетика как путь к персонализированной медицине: оправданы ли надежды? Клиническая фармакология и терапия. 2005;14(5):77-83.
8. Карабекова Б.А. Персонализированная медицина. Путь к эффективной и безопасной фармакотерапии. Наука, техника и образование. 2018;3(44):66-68.
9. Jain KK. Personalised medicine for cancer: from drug development into clinical practice. Expert Opin Pharmacother. 2005;6(9):1463-76. doi: 10.1517/14656566.6.9.1463
10. WHO. Int [Internet]. World Health Organization Available from: https://www.who.int/bulletin/archives/79(4)373.pdf
11. Сancer.gov [Internet]. U.S. National Cancer Institute at the National Institutes of Health Available from: https://www.cancer.gov/about-cancer/treatment/clinical-trials/nci-supported/nci-match
12. Ivaturi V, Dvorak CC, Chan D, Liu T, Cowan MJ, Wahlstrom J, LongBoyle J. Pharmacokinetics and model-based dosing to optimize fludarabine therapy in pediatric hematopoietic cell transplant recipients. Biol Blood Marrow Transplant. 2017;23(10):1701-1713. doi: 10.1016/j.bbmt.2017.06.021.
13. Инструкция по медицинскому применению препарата Флударабел® Доступно по: http://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=0a4eb8fc8b89-40ff-82e9-fb59c9fd90e5&t=Ссылка активна на 01.06.2021.
14. Medicines.org.uk [Internet]. EMA. Arch Intern Med., 15, 868-881 (1915)., Fludara oral 10 mg film-coated tablet. Available from: https://www.medicines.org.uk/emc/product/1288/smpc
15. Punt AM, Langenhorst JB, Egas AC, Boelens JJ, van Kesteren C, van Maarseveen EM. Simultaneous quantification of busulfan, clofarabine and F-ARA-A using isotope labelled standards and standard addition in plasma by LC—MS/MS for exposure monitoring in hematopoietic cell transplantation conditioning. J Chromatogr B Analyt Technol Biomed Life Sci. 2017;1055-1056:81-85. doi: 10.1016/j.jchromb.2017.04.025.
16. Guidline on bioanalytical method validation [Internet]. EMEA/ CHMP/EWP/192217/2009 Rev/1 Corr.2,21.07.2011. Available from: https://www.ema.europa.eu/en/documents/scientific-guideline/guidelinebioanalytical-method-validation_en.pdf.
17. Huang L, Lizak P, Dvorak CC, Aweeka F, Long-Boyle J. Simultaneous determination of fludarabine and clofarabine in human plasma by LC—MS/ MS. J Chromatogr B Analyt Technol Biomed Life Sci. 2014;960:194-9. doi: 10.1016/j.jchromb.2014.04.045.
18. Ng ESM, Kangarloo SB, Daly A. Improved quantitative method for fludarabine in human plasma by liquid chromatography and tandem mass spectrometry. J Chromatogr B Analyt Technol Biomed Life Sci. 2013;931:103-10. doi: 10.1016/j.jchromb.2013.05.012.
19. Zhang Y, Huo M, Zhou J, Xie S. JCm, biomedicine pi PKSolver: An add-in program for pharmacokinetic and pharmacodynamic data analysis in Microsoft Excel. Comput Methods Programs Biomed. 2010;99(3):306-14. doi: 10.1016/j.cmpb.2010.01.007.
20. Мирошниченко И.И. Основы фармакокинетики. — М.: ГЭОТАР-МЕД; 2002. — 192 с.
21. Adane ED, Herald M, Koura F. Pharmacokinetics of Vancomycin in extremely obese patients with suspected or confirmed staphylococcus aureus infections. Pharmacotherapy. 2015;35(2):127-39. doi: 10.1002/phar.1531.
22. Раменская Г.В., Шохин И.Е., Лукина М.В., Андрущишина Т.Б., Чукина М.А., Царев И.Л., Вартанова О.А., Морозова Т.Е. Математическое моделирование параметров фармакокинетики ванкомицина: возможности и сравнение с результатами терапевтического лекарственного мониторинга. Биомедицина. 2018;(4):51-62.
23. Пальцев М.А., Белушкина Н.Н. Научные основы эффективности и безопасности лекарственных средств / Материалы Научной сессии Общего собрания членов РАН «Научные основы эффективности и безопасности лекарственных средств»; Декабря 8, 2015; Москва. Доступно по: https://istina.msu.ru/collections/155590118/ Ссылка активна на 01.06.2021
24. Бондарева И.Б. Математическое моделирование в фармакокинетике и фармакодинамике: Автореф. дис. … д-ра биол. наук. — М.: 2001. Доступно по: https://elibrary.ru/item.asp?id=19171468
25. Clayton TA, Lindon JC, Cloarec O, Antti H, Charuel C, Hanton G, Nicholson JK. Pharmaco-metabonomic phenotyping and personalized drug treatment. Nature. 2006; 440(7087):1073-7. doi: 10.1038/nature04648.
Об авторах
Г. Г. РодионовРоссия
Родионов Геннадий Георгиевич, д. м. н., доцент, заведующий научно-исследовательской лабораторией токсикологии и лекарственного мониторинга научно-исследовательского отдела биоиндикации, в. н. с. SPIN-код: 6471-3933
Санкт-Петербург
И. И. Шантырь
Россия
Шантырь Игорь Игнатьевич, д. м. н., профессор, заведующий научно-исследовательским отделом биоиндикации, г. н. с. SPIN-код: 8038-2999
Санкт-Петербург
В. Б. Василюк
Россия
Василюк Василий Богданович, д. м. н., профессор кафедры токсикологии, экстремальной и водолазной медицины ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; управляющий ООО «НИЦ Эко-безопасность». SPIN-код: 1459-5548
Санкт-Петербург
Е. А. Колобова
Россия
Колобова Екатерина Алексеевна, к. х. н., с. н. с. научно-исследовательской лаборатории токсикологии и лекарственного мониторинга научно-исследовательского отдела биоиндикации. SPIN-код: 6323-8882
Санкт-Петербург
Е. В. Светкина
Россия
Светкина Екатерина Владимировна, врач клинической лабораторной диагностики лаборатории цитологических, гематологических и общеклинических методов исследования отдела лабораторной диагностики. SPIN-код: 4224-5518
Санкт-Петербург
М. В. Фарапонова
Россия
Фарапонова Мария Валерьевна, заместитель управляющего по научной работе. SPIN-код: 9006-2074
Санкт-Петербург
А. Б. Верведа
Россия
Верведа Алексей Борисович, к. м. н, в. н. с. лаборатории лекарственной токсикологии ФГБУ НКЦТ им. С.Н. Голикова ФМБА России; с. н. с., научно-исследовательского отдела ООО «НИЦ Эко-безопасность»
Санкт-Петербург
Г. И. Сыраева
Россия
Сыраева Гульнара Ислямовна, заместитель управляющего по качеству ООО «НИЦ Эко-безопасность»; очный аспирант кафедры клинической фармакологии и доказательной медицины ФБГОУ ВО ПСПбГМУ им. И.П. Павлова Минздрава России. SPIN-код: 9650-5671
Санкт-Петербург
К. А. Захаров
Россия
Захаров Константин Анатольевич, заместитель управляющего. SPIN-код: 2537-4635
Санкт-Петербург
Рецензия
Для цитирования:
Родионов Г.Г., Шантырь И.И., Василюк В.Б., Колобова Е.А., Светкина Е.В., Фарапонова М.В., Верведа А.Б., Сыраева Г.И., Захаров К.А. Индивидуальные особенности фармакокинетики флударабина фосфата при лечении пациентов с хроническим лимфолейкозом. Качественная клиническая практика. 2021;(2):67-77. https://doi.org/10.37489/2588-0519-2021-2-67-77
For citation:
Rodionov G.G., Shantyr I.I., Vasilyuk V.B., Kolobova E.A., Svetkina E.V., Faraponova M.V., Verveda A.B., Syraeva G.I., Zakharov K.A. Individual features of the pharmacokinetics of fludarabin phosphate in the treatment of patients with chronic lymphocytic leukemia. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2021;(2):67-77. (In Russ.) https://doi.org/10.37489/2588-0519-2021-2-67-77

















































