Перейти к:
Клинико-экономическая оценка применения комбинации атезолизумаб + наб-паклитаксел в терапии неоперабельного местнораспространённого или метастатического тройного негативного рака молочной железы
https://doi.org/10.37489/2588-0519-2020-1-4-21
Аннотация
Цель. Определить фармакоэкономическую целесообразность применения комбинации атезолизумаб + наб-паклитаксел в 1-й линии терапии неоперабельного местнораспространённого или метастатического тройного негативного рака молочной железы (ТНРМЖ) у взрослых PD-L1 позитивных пациентов в условиях здравоохранения РФ.
Материалы и методы. Использована модель «анализа принятия решений» и марковское моделирование для экономической оценки лекарственных препаратов (ЛП) в лечении метастатического ТНРМЖ. Применяли анализ «затраты-эффективность», анализ влияния на бюджет (АВБ). Оценивали два терапевтических подхода: применение комбинированной терапии атезолизумаб + наб-паклитаксел и монотерапия наб-паклитакселом. В анализ включали прямые затраты. Дополнительно выполнялось сравнение полученных фармакоэкономических показателей применения комбинации атезолизумаба и наб-паклитаксела и других ЛП для лечения местнораспространённого и метастатического рака молочной железы.
Результаты. Использование в лечении метастатического ТНРМЖ оцениваемых терапевтических подходов характеризовалось следующими затратами: при горизонте моделирования 1 год затраты при применении атезолизумаба в комбинации с наб-паклитакселом составили 5 076 321 руб. в расчёте на одного пациента. Затраты при применении монотерапии наб-паклитакселом были на 60 % меньше — 2 020 038,78 руб. При этом эффективность терапии комбинацией атезолизумабом и наб-паклитакселом клинически значимо превосходила монотерапию наб-паклитакселом: на 38 % снижался риск смерти или прогрессирования, в 10 раз увеличивалась частота полного ответа на терапию (10 vs 1 %) и на 7 месяцев увеличивалась медиана общей выживаемости (25 vs 18 месяцев). Экономическая оценка комбинации атезолизумаба с наб-паклитакселом была проведена с расчётом инкрементного показателя «затраты-эффективность» (ICER) — расчёт дополнительной стоимости на каждый дополнительный год жизни в сравнении со стандартной терапией. Ввиду того, что на текущий момент в России для пациенток с метастатическим ТНРМЖ нет аналогичных по эффективности режимов терапии, инкрементный показатель ICER для комбинации атезолизумаб + наб-паклитаксел сравнили с ICER для палбоциклиба в сочетании с фулвестрантом (препаратов, показавших улучшение общей выживаемости в клинических исследованиях и включённых в клинические рекомендации для лечения заболеваний из того же класса МКБ-10 — местнораспространённого и метастатического РМЖ). Показатель ICER по критерию общей выживаемости на конец первого года наблюдения для атезолизумаба + наб-паклитаксел и палбоциклиба + фулвестрант составил 30,5 млн руб. и 47,4 млн руб. соответственно. Для комбинации атезолизумаб + наб-паклитаксел показатель затрат ICER ниже аналогичного ICER для режима палбоциклиб + фулвестрант на 36 %. Анализ тенденции изменений средневзвешенных затрат на системное патогенетическое лечение рака молочной железы (РМЖ) демонстрирует следующее: расширение использования комбинации атезолизумаб + наб-паклитаксел для лечения пациентов с метастатическим ТНРМЖ (мТНРМЖ) не приводит к значимому росту затрат на терапию у больных с РМЖ — при предоставлении терапии до 1 400 пациентам, что включает всю целевую популяцию больных с мТНРМЖ и экспрессией PD-L1 в РФ, изменения затрат на химиотерапию и иммунотерапию РМЖ останется в пределах 2,6 %.
Заключение. Фармакоэкономические показатели применения атезолизумаба в сочетании наб-паклитакселом отличаются большей эффективностью затрат в сравнении с иными дорогостоящими схемами терапии рака молочной железы, так и опухолей иных локализаций, активно используемых в текущей практике, что позволяет говорить о приемлемости и целесообразности внедрения и расширения применения данной терапевтической опции в целевой популяции.
Ключевые слова
Для цитирования:
Колбин А.С., Вилюм И.А., Проскурин М.А., Балыкина Ю.Е., Павлыш А.В. Клинико-экономическая оценка применения комбинации атезолизумаб + наб-паклитаксел в терапии неоперабельного местнораспространённого или метастатического тройного негативного рака молочной железы. Качественная клиническая практика. 2020;(1):4-21. https://doi.org/10.37489/2588-0519-2020-1-4-21
For citation:
Kolbin A.S., Vilyum I.A., Proskurin M.A., Balikina Yu.E., Pavlysh A.V. Pharmacoeconomic analysis of atezolizumab plus nab-paclitaxel in the treatment of the advanced or metastatic triple-negative breast cancer. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2020;(1):4-21. (In Russ.) https://doi.org/10.37489/2588-0519-2020-1-4-21
Актуальность
Рак молочной железы (РМЖ) является одной из самых распространённых злокачественных опухолей у женщин во всем мире. В структуре онкологической заболеваемости у женщин РМЖ занимает 1-е место, и частота его неуклонно растёт. В 2018 г. в России зарегистрированы 70 682 новых больных раком молочной железы, при этом за последние 10 лет наблюдается прирост в 35 % [1].
Тройной негативный рак молочной железы (ТНРМЖ) составляет от 11 до 22 % всех гистологических вариантов РМЖ [3—6]. ТНРМЖ по сравнению с другими фенотипами является самым агрессивным вариантом болезни и сопряжён с высоким риском рецидива и смерти: 88 % рецидивов развивается в первые 5 лет от постановки диагноза [7—9]. Неблагоприятный прогноз при ТНРМЖ связан с недостаточным ответом на стандартную химиотерапию (ХТ) и ранним висцеральным метастазированием [10—17].
Отдаленное метастазирование для ТНРМЖ фиксируется в течение 1—3 лет после начала лечения, при этом для ТНРМЖ характерно метастазирование в следующие органы: лёгкие (40 %), головной мозг (30 %), костный мозг (20 %), печень (20 %) [18]. В структуре общего числа выявленных пациенток с метастатическим ТНРМЖ (мТНРМЖ) 75 % рецидивировали с ранних стадий болезни и 25 % имели впервые выявленный метастатический рак [19]. Медиана выживаемости при 4-й стадии ТНРМЖ составляет 12-18 месяцев.
Метастатический ТНРМЖ затрагивает группу трудоспособных пациенток в возрасте до 50 лет и остаётся большой проблемой, несмотря на применение современных лекарственных препаратов (ЛП) с различным механизмом действия (эрибулин, олапариб, цетуксимаб, комбинированные схемы с таксанами, антрациклинами, бевацизумабом, бикалутамидом, энзалутомид и др.) [20—27].
С возрастающим пониманием молекулярных взаимосвязей, которые управляют развитием и прогрессированием опухоли, появляются новые механизмы противоопухолевой терапии. Актуальной становится иммунохимиотерапия в мТНРМЖ — направление в лечении злокачественных новообразований, которое в короткий промежуток времени преобразило основы терапии метастатических опухолей различных локализаций.
Эффективность иммунохимиотерапии значительно возрастает при наличии установленных мишеней в молекулярно-генетическом профиле опухолей. У пациентов с ТНРМЖ мишенью является лиганд программируемой клеточной смерти 1 (PD-L1), который экспрессируется на иммунных и опухолевых клетках. PD-L1 при взаимодействии с рецепторами PD-1 на поверхности Т-клеток ингибирует противоопухолевый иммунный ответ (PD-L1 — это точка иммунного контроля). Таким образом, терапевтическая мишень PD-L1 — новая стратегия в лечении онкологии, направленная на восстановление иммунного ответа организма [28—33]. Внедрение в клиническую практику анти-PD-L1 терапии обусловлено следующими предпосылками: 1) высокие показатели экспрессии PD-L1 при ТНРМЖ [34, 35]; 2) PD-L1 экспрессируется примерно в 30-40 % при тройных негативных опухолях [36, 37]; 3) Экспрессия PD-L1 связана с базальноподобным подтипом опухоли [38] и коррелирует с высокой злокачественностью и высокой пролиферативной активностью [39].
В настоящее время первым и единственным зарегистрированным в РФ онкоиммунологическим препаратом для терапии первой линии PD-L1-позитивных пациентов с мТНРМЖ является атезолизумаб [40]. Атезолизумаб — моноклональное антитело, которое избирательно блокирует PD-L1, предотвращая взаимодействие этого лиганда с рецептором PD-1 на поверхности Т-лимфоцитов, тем самым реактивируя противоопухолевый иммунный ответ [41].
Показания, согласно инструкции по применению, для атезолизумаба включают неоперабельный местнораспространённый или метастатический ТНРМЖ в первой линии терапии в комбинации с наб-паклитакселом при наличии экспрессии PD-L1 ≥1 % на иммунокомпетентных клетках, инфильтрирующих ткань опухоли (PD-L1-позитивный статус) [41].
Эффективность и безопасность комбинации атезолизумаба с наб-паклитакселом по сравнению с комбинацией плацебо с наб-паклитакселом изучена у пациентов с местнораспространённым или метастатическим ТНРМЖ, которые не получали предшествующего системного лечения мТНРМЖ (исследование IMpassion 130) [30, 42]. Применение атезолизумаба с наб-паклитакселом в сравнении с монотерапией наб-паклитакселом сопровождалось значимым снижением риска прогрессирования заболевания или смерти в популяции пациенток с PD-L1-позитивным статусом (медиана выживаемости без прогрессирования = 7,5 vs 5,0 месяцев; снижение относительного риска на 38 %, p<0,0001). Также применение атезо- лизумаба позволило каждой второй пациентке с метастатическим PD-L1+ ТНРМЖ преодолеть 2-летний рубеж общей выживаемости: медиана общей выживаемости в группе атезолизумаба и плацебо составила 25 и 18 месяцев соответственно (ОР= 0,71; 95 % ДИ 0,54-0,93).
Атезолизумаб входит в перечень жизненно необходимых и важнейших лекарственных препаратов (ЖНВЛП) и доступен в рамках программы государственных гарантий оказания бесплатной медицинской помощи и в рамках оказания медицинской помощи за счёт средств обязательного медицинского страхования, также атезолизумаб включён в группировщик клинико-статистических групп (по КСГ) [43, 44]. Наб-паклитаксел не включён в перечень ЖНВЛП, но доступен для применения по КСГ. В связи с изменениями правил одобрения клинических рекомендаций и формирования модели КСГ комбинированная схема атезолизумаб + наб-паклитаксел не вошла в группировщик КСГ на 2020 год. Однако среди не менее 147 схем, доступных для лечения РМЖ, в рамках оказания помощи по КСГ отсутствует комбинация атезолизумаба с наб-паклитакселом как наиболее эффективной терапии для трудно курабельной субпопуляции пациентов трудоспособного возраста. В этой связи целесообразно провести клинико-экономическое исследование по оценке фармакоэкономиче- ской целесообразности применения комбинированного лечения атезолизумабом и наб-паклитакселом неоперабельного местнораспространённого или метастатического ТНРМЖ в условиях отечественного здравоохранения и рассмотреть включение рассматриваемой схемы в систему ОМС (КСГ).
Материалы и методология
При методологии клинико-экономического анализа будут использованы отраслевые стандарты «Клинико-экономического исследования» применяемые в РФ и рекомендации по проведению фармако-экономической оценки [45—50].
При проведении фармакоэкономического анализа был применён анализ «затраты-эффективность» (англ. cost-effectiveness analysis, CEA) с расчётом показателя соотношения затрат и достигнутого эффекта (англ. cost-effectiveness ratio, CER). Формула:
CER = ПЗ/ЭФ
(прямые затраты (ПЗ), деленные на эффективность (ЭФ)). При превышении эффективности и прямых затрат одного из исследуемых режимов по сравнению с другим использовали инкрементальный анализ с расчётом соответствующего коэффициента (incremental cost-effectiveness ratios — ICERs). Формула:
ICER = (ПЗ 1 метода — ПЗ 2 метода) / (ЭФ 1 метода — ЭФ 2 метода)
Данный анализ проводили для определения дополнительных затрат (стоимости) для предотвращения 1 случая смерти и/или 1 года сохранённой жизни (или других показателей). Выполняли анализ влияния на бюджет (АВБ) с годичной и трёхлетней перспективой. Указанные временные промежутки выбраны в соответствии с принятым способом формирования бюджета с точки зрения краткосрочной перспективы: годовой бюджет здравоохранения, плановый период для реализации многоэтапных целевых программ. АВБ выполнен с использованием утверждённых Методических рекомендаций [49].
С учётом того, что на текущий момент в России не зарегистрировано аналогичных лекарственных препаратов для лечения местнораспространённого неоперабельного или метастатического ТНРМЖ, для проведения сравнения были взяты ЛП, включённые в клинические рекомендации и применяющиеся при местнораспространённом и метастатическом РМЖ — палбоциклиб с фулвестрантом. В связи с этим показатели CER и ICER были рассчитаны для палбоциклиба + фулвестрант в соответствии с принятой методикой настоящего клинико-экономического исследования по отношению к ЛП сравнения в исследовании для дальнейшего анализа полученных показателей для комбинированной терапии атезолизумабом и наб-паклитакселом.
Использовали следующий перечень оцениваемых затрат: стоимость лечения основного заболевания (ТНРМЖ) — затраты на ЛП для ХТ ТНРМЖ; стоимость консультативно-диагностической помощи; стоимость лечения в случае неэффективности терапии оцениваемыми ЛП — прогрессирование заболевания; стоимость лечения в случае развития нежелательных явлений (НЯ). Моделирование затрат осуществлялось с учётом рекомендаций по формированию затрат при выполнении клинико-экономического анализа [50].
Затраты на лечение были оценены на основании данных Государственного реестра предельных отпускных цен [40], на основании Постановления Правительства РФ от 10.12.2018 N 1506 «О Программе государственных гарантий бесплатного оказания гражданам медицинской помощи на 2019 год и на плановый период 2020 и 2021 годов» (ПГГ) [43], Генерального тарифного соглашения на 2019 г. (ГТС) [51] и других источников [52—54].
Критерии эффективности. Основная задача лечения ТНРМЖ — предупреждение замедление темпов прогрессирования заболевания и увеличение продолжительности жизни. В фокусе исследования — неоперабельный местнораспространённый или мТНРМЖ в первой линии терапии в комбинации с наб-паклитакселом при наличии экспрессии PD-L1≥1 % на иммунокомпетентных клетках, инфильтрирующих ткань опухоли, как наиболее эффективная по ответу на рассматриваемую терапию группа пациентов. Критерием эффективности выбрана общая выживаемость (%) на конец первого года наблюдения.
Структура анализа
На первом этапе фармакоэкономического анализа с использованием литературных данных была построена модель оказания помощи пациентам с мТ- НРМЖ. «Модель анализа решений» основана на данных клинического исследования [30, 42], с помощью которого определены демографические показатели оцениваемой когорты пациентов, и клинических рекомендациях профессиональных сообществ [55].
Модель начинали с выбора ЛП для терапии рассматриваемой нозологии. Для оцениваемых ЛП известны следующие режимы терапии:
- комбинация атезолизумаб + наб-паклитаксел: 840 мг в/в каждые 2 недели (1-й и 15-й день цикла) или 1 200 мг в/в каждые 3 недели, наб-паклитаксел по 100 мг/кг в 1-й, 8-й и 15-й дни цикла;
- наб-паклитаксел по 100 мг/м2 в 1-й, 8-й и 15-й дни цикла.
Далее пациенты входили в цикл Маркова. Предполагались следующие состояния пациента в структуре модели: стабильное состояние, прогрессирование заболевания, несмотря на активное лечение, оцениваемыми режимами терапии, и конечное состояние цикла Маркова — смерть пациента. Конечным состоянием цикла Маркова считали смерть пациента после применения одной из схем фармакотерапии или вследствие прогрессирования заболевания. Длительность цикла — 3 месяца, максимальный горизонт моделирования — 12 месяцев.
Схематическое представление модели «дерева решений» и цикла Маркова для модели пациентов с неоперабельным ТНРМЖ приведено на рис. 1 и 2.

Рис. 1. Модель анализа решений для оценки фармакоэкономической целесообразности применения стратегий при ТНРМЖ
Примечания: ТНРМЖ — тройной негативный рак молочной железы; Атезолизумаб + наб-паклитаксел: атезолизумаб 840 мг в/в каждые 2 недели (1-й и 15-й день цикла) или 1 200 мг в/в каждые 3 недели, наб-паклитаксел по 100 мг/м2 в 1-й, 8-й и 15-й дни цикла; наб-паклитаксел: наб-паклитаксел по 100 мг/м2 в 1-й, 8-й и 15-й дни цикла.

Рис. 2. Схематическое представление последовательностей переходов в цикле Маркова при использовании различных стратегий терапии ТНРМЖ
Источники данных для математического моделирования
Расчёт стоимости оказания медицинской помощи по различным стратегиям. Стоимость лечения основного заболевания — ТНРМЖ включает в себя затраты на ЛП оцениваемых стратегий, затраты на пребывание в условиях дневного стационара, необходимые пациенту в дни введения ЛП. Необходимость госпитализации в дневной стационар обусловлена тем, что инфузии атезолизумаба, согласно инструкциям по применению [41], следует проводить под тщательным наблюдением медицинского специалиста, имеющего опыт лечения противоопухолевыми средствами, в стационарных или амбулаторно-поликлинических условиях, введение наб-паклитаксела также подразумевает наличие необходимых условий в случае развития осложнений [56]. Таким образом, для каждого введения препарата требовалось пребывание в дневном стационаре. Стоимость 1 случая лечения в условиях дневных стационаров за счёт средств обязательного медицинского страхования составляет 19 266,10 руб. согласно ПГГ [43].
Расчёт стоимости ЛП сравниваемых стратегий терапии ТНРМЖ у больных, ранее получавших лечение, представлен в табл. 1.
Таблица 1
Стоимость терапии ЛП оцениваемых стратегий
Стратегия терапии | ЛП (МНН, торговое наименование) | Форма выпуска | Цена/упаковка (руб.) | Стоимость на курс, руб.*** |
|---|---|---|---|---|
Атезолизумаб + наб-паклитаксел^, 840 мг в/в каждые 2 недели (1-й, 15-й день цикла); 100 мг/м2, 1-й, 8-й и 15-й дни цикла соответственно | Атезолизумаб, Тецентрик® | Концентрат для приготовления раствора для инфузий 12 00 мг/20 мл (1) | 215 930,09* (стоимость 1 мг — 179,94) | 372 439,20 |
Паклитаксел + Альбумин, Абраксан® | Лиофилизат для приготовления суспензии для инфузий, 100 мг (1) | 48 425,69** | 319 609,56 | |
Наб-паклитаксел, 100 мг/м2, 1-й, 8-й и 15-й дни цикла | Паклитаксел + Альбумин, Абраксан® | Лиофилизат для приготовления суспензии для инфузий, 100 мг (1) | 48 425,69 | 319 609,56 |
Примечания: МНН — международное непатентованное наименование; ЛП — лекарственный препарат; Λатезолизумаб + наб-паклитаксел: атезолизумаб может применяться в режиме 840 мг в/в каждые 2 недели (1-й и 15-й день цикла) или 1 200 мг в/в каждые 3 недели, наб-паклитаксел по 100 мг/м2 в 1-й, 8-й и 15-й дни цикла; наб-паклитаксел: наб-паклитаксел по 100 мг/ м2 в 1-й, 8-й и 15-й дни цикла; * — по данным Реестра предельных отпускных цен [40]; ** — по данным аналитической компании IMS, дата выгрузки 28.07.2019 г. [53]; *** — с НДС и торговой надбавкой в 12 %.
Затраты на оказание медицинской помощи вследствие прогрессирования заболевания — неэффективности ЛП оцениваемых стратегий
В случае прогрессирования патологического процесса, несмотря на проведённую терапию оцениваемыми стратегиями, предполагалось, что пациенту требовалось оказание медицинской помощи. Затраты на оказание медицинской помощи больным будет включать госпитализацию для оценки соматического статуса и продолжения лечения в рамках тарифов, предусмотренных методическими рекомендациями о способах оплаты медицинской помощи, «Лекарственная терапия при злокачественных новообразованиях (кроме лимфоидной и кроветворной тканей), взрослые уровень 6» стоимостью 102 900,00 [44].
Стоимость оказания медицинской помощи в случае развития нежелательных явлений
При расчёте стоимости коррекции нежелательных явлений (НЯ) в группах сравнения исходили из того, что в случае развития реакции лёгкой и средней степени тяжести (<3 степени) необходимо амбулаторное лечение, предусмотренное в ГТС по соответствующей нозологии или клиническому состоянию. При отсутствии достоверных данных о порядке оказания медицинской помощи и длительности госпитализации при осложнениях лечения указана средняя длительность госпитализации по сходным КСГ (клинико-статистическая группа) [44].
Частота развития НЯ определена в соответствии с рандомизированным клиническим исследованием (РКИ), включённым в настоящее моделирование [30, 42].
Дополнительные затраты в терминальной стадии заболевания
В случае прогрессирования патологического процесса, требующего терапии рецидива, предполагалось, что больному дополнительно однократно требовалось оказание медицинской помощи в объёме, предусмотренном тарифом на оплату видов высокотехнологичной медицинской помощи, оказываемой в стационарных условиях «Дистанционная, внутритканевая, внутриполостная, стереотаксическая, радионуклидная лучевая терапия в радиотерапевтических отделениях, высокоинтенсивная фокусированная ультразвуковая терапия при злокачественных новообразованиях», стоимостью 269 170,00 руб. [43].
Для расчёта затрат на паллиативную терапию в стационарах (включая хосписы и больницы сестринского ухода) использовали тариф ПГГ, составляющий 2 022,90 руб. за 1 койко-день [43], при среднем пребывании пациента 30 дней стоимость составляет 30 343,50 руб.
Сравнение фармакоэкономических показателей применения комбинации атезолизумаба и наб-паклитаксела и других ЛП для лечения онкологических заболеваний
Сравнение фармакоэкономических показателей применения комбинации атезолизумаба и наб-паклитаксела и других ЛП для лечения метастатического РМЖ выполнено на примере палбоциклиба в комбинации с фулвестрантом. Модели построены в соответствии с методикой клиникоэкономического исследования использования комбинации атезолизумаба и наб-паклитаксела. В основе анализа лежат результаты рандомизированного клинического исследования палбоциклиба в комбинации с фулвестрантом при РМЖ [57, 58].
Анализ чувствительности
Был запланирован многосторонний анализ чувствительности, чтобы проверить устойчивость полученных результатов основного сценария к изменениям в таких ключевых параметрах, как эффективность ЛП, затраты, устанавливая параметры по одному от ± 25 % их ценностей от полученного результата.
Результаты
Затраты на лечение метастатического ТНРМЖ: при горизонте моделирования 1 год затраты при применении атезолизумаба в комбинации с наб-паклитакселом составляли 5 076 321 руб. в расчёте на одного пациента. Стоимость монотерапии наб-паклитакселом была на 60 % меньше и составляла 2 020 038,78 руб. (рис. 3).

Рис. 3. Сравнение структуры затрат: комбинация атезолизумаб + наб-паклитаксел и монотерапия наб-паклитакселом
Примечания: атезолизумаб + наб-паклитаксел: атезолизумаб 840 мг в/в каждые 2 недели (1-й и 15-й день цикла), наб-паклитаксел по 100 мг/м2 в 1-й, 8-й и 15-й дни цикла; наб-паклитаксел: наб-паклитаксел по 100 мг/кг в 1-й, 8-й и 15-й дни цикла; ДС — дневной стационар; ЛП — лекарственный препарат; НЯ — нежелательные явления.
Наибольшая разница возникала вследствие различной стоимости лечения основного заболевания. Так, в группе применения атезолизумаба в комбинации с наб-паклитакселом затраты на ЛП для лечения основного заболевания на конец периода моделирования составили 4 463 714,50 руб., в то время как в случае использования монотерапии наб-паклитакселом аналогичные затраты составили 1 467 008 руб.
Стоимость комбинации атезолизумаб + наб-паклитаксел для системной иммунохимиотерапии сложнокурабельной категории больных следует соотносить с эффективностью данной комбинации (рис. 4), которая на текущий момент имеет самые высокие показатели: медиана общей выживаемости при использовании комбинации атезолизумаб + наб-паклитаксел составляет 25 месяцев, тогда как аналогичный показатель для монотерапии наб-паклитакселом оценивается в 18 месяцев (добавление атезолизумаба к наб-паклитакселу ассоциируется со снижением риска смерти на 29 %). При этом общая выживаемость на конец 1-го года при применении комбинации атезолизумаб и наб-паклитаксел достигает 78 % (процент выживших пациентов). Кроме того, на протяжении всего периода наблюдения у пациентов после применения комбинации с атезолизумабом наблюдалась большая вероятность остаться в состоянии «стабилизация заболевания»

Рис. 4. Эффективность в группах сравнения — атезолизумаб + наб-паклитаксел и наб-паклитаксел в монотерапии
Примечания: атезолизумаб + наб-паклитаксел: атезолизумаб 840 мг в/в каждые 2 недели (1-й и 15-й день цикла), наб-паклитаксел по 100 мг/м2 в 1-й, 8-й и 15-й дни цикла; наб-паклитаксел: наб-паклитаксел по 100 мг/м2 в 1-й, 8-й и 15-й дни цикла.
Графическое представление итогов анализа «затраты-эффективность» для терапии различных стратегий представлено на рис. 5.

Рис. 5. Соотношение затрат и показателей эффективности
Примечания: атезолизумаб+наб-паклитаксел: атезолизумаб 840 мг в/в каждые 2 недели (1-й и 15-й день цикла), наб-паклитаксел по 100 мг/м2 в 1-й, 8-й и 15-й дни цикла; наб-паклитаксел: наб-паклитаксел по 100 мг/м2 в 1-й, 8-й и 15-й дни цикла.
Как видно из данных, представленных на рис. 5, с точки зрения соотношения затрат и эффективности, стратегия применения комбинации атезолизумаб + наб-паклитаксел обладала большей эффективностью по сравнению со стратегией монотерапии наб-паклитакселом, при этом суммарные затраты на неё были также выше.
Для анализа затрат был применён показатель CER (cost-effectiveness ratio), характеризующий соотношение стоимость терапии и её эффективности. При анализе эффективности относительно общей выживаемости на конец 1-го года показатели CER для стратегий монотерапии наб-паклитакселом и комбинации атезолизумаба с наб-паклитакселом составили 2 970 645 и 6 508 103 руб. соответственно.
Был проведён расчёт ICER (табл. 2).
Таблица 2
Коэффициенты ICER для стратегий сравнения (горизонт моделирования 1 год)
Стратегия | Затраты, руб. | Прирост затрат, руб. | Медиана ОВ (мес.) | Прирост эффект., мес. | ICER (руб./год ОВ) |
|---|---|---|---|---|---|
Атезолизумаб + наб-паклитаксел | 5 076 321 | 3 056 282 | 25 | 7 | 5 239 340 |
Наб-паклитаксел | 2 020 039 |
| 18 |
|
|
Стратегия | Затраты, руб. | Прирост затрат, руб. | ОВ, % | Прирост эффект., % | ICER (руб./год ОВ) |
Атезолизумаб + наб-паклитаксел | 5 419 200 | 3 040 698 | 78 | 10 | 30 562 818,34 |
Наб-паклитаксел | 2 378 502 | - | 68 |
|
|
Примечания: ОВ — общая выживаемость; ICER — инкрементный показатель; атезолизумаб + наб-паклитаксел: атезолизумаб 840 мг в/в каждые 2 недели (1-й и 15-й день цикла), наб-паклитаксел по 100 мг/м2 в 1-й, 8-й и 15-й дни цикла; наб-паклитаксел: наб-паклитаксел по 100 мг/м2 в 1-й, 8-й и 15-й дни цикла.
При сравнении с монотерапией наб-паклитакселом применения комбинации атезолизумаб + наб-паклитаксел в качестве терапии тройного негативного рака молочной железы стоимость была выше и вместе с тем комбинация была значимо эффективнее. В подобных условиях проводится расчёт инкрементного показателя «затраты-эффективность» (ICER), который демонстрирует размер дополнительных затрат на дополнительную единицу эффективности, в данном случае — дополнительный год жизни. На конец периода моделирования разница в затратах между комбинацией с атезолизумабом и монотерапией наб-пакли- такселом составила 3 056 282 руб./пац. При этом по показателю общей выживаемости (медиана мес.) разница в эффективности была равна 7 мес. (0,59 года) в пользу использования комбинации атезолизумаб + наб-паклитаксел. При таком приросте эффективности соответствующий ICER для комбинации атезолизумаб + наб-паклитаксел составил 5 239 340 руб./год общей выживаемости. По показателю общей выживаемости в % на конец первого года разница в эффективности составляла 14 % в пользу использования комбинации атезолизумаб + наб-паклитаксел. При таком приросте эффективности соответствующий ICER для комбинации атезолизумаб + наб-паклитаксел был равен 30 562 818,34 руб.
Эффективность и уникальность рассматриваемой терапии для пациентов с мТНРМЖ требуют расширенного анализа показателей эффективности затрат, полученных в ходе настоящего фармакоэкономического исследования. В связи с чем дополнительно было проведено сравнение показателей эффективности затрат применения комбинации атезолизумаб + наб-паклитаксел и другой дорогостоящей опции, доступной в системе ОМС и включённой в клинические рекомендации для лечения метастатического РМЖ — палбоциклиба в сочетании с фулвестрантом. Для этого было проведено отдельное клинико-экономическое моделирование эффективности применения палбоциклиба в комбинации с фулве- странтом в сравнении с монотерапией фулвестрантом при мРМЖ с расчётом соответствующего инкрементального коэффициента ICER.
На рис. 6 представлены результаты сравнения суммарных затрат рассматриваемых терапевтических альтернатив — палбоциклиб + фулвестрант vs фулвестрант.

Рис. 6. Суммарные затраты на лечение стратегиями сравнения в расчёте на 1 пациента, горизонт моделирования 1 год.
Примечания: ДС — дневной стационар; НЯ — нежелательные явления; ЛП — лекарственные препараты; палбоциклиб + фулве- странт: палбоциклиб 125 мг 1 раз в сутки в 1—21-й день цикла, фулвестрант 500 мг в/м в 1-й и 15-й дни цикла (затем 500 мг в 1-й день цикла); длительность цикла 28 дней; фулвестрант: фулвестрант по 500 мг в/м 1-й цикл — 1-й и 15-й день, со второго 500 мг в/м 1 раз в цикл; длительность 28 дней.
Как следует из данных, представленных на рис. 6, при горизонте моделирования 1 год издержки при использовании палбоциклиба в сочетании с фулвестрантом оценивались в 1 647 606,86 руб. в расчёте на одного пациента, фулвестранта в монорежиме — 699 031,55 руб. (в 2,3 раза дешевле). Соотношение суммарных затрат палбоциклиба + фулвестранта и фулвестранта практически не отличается от соответствующего соотношения между издержками ранее рассмотренных терапевтических альтернатив — лечение атезолизумабом в комбинации с наб-паклитакселом в 2,5 раза более ресурсоемко в сравнении с наб-паклитакселом. Различия в уровне затрат во всех случаях сравнения связано, прежде всего, со стоимостью системного медикаментозного лечения основного заболевания. Необходимо обратить внимание на соотношение между стоимостью ЛП в группах сравнения: при использовании комбинации палбоциклиба и фулвестранта затраты на ЛП для лечения основного заболевания на конец периода моделирования в 3,7 раза выше стоимости монотерапии фулвестрантом (1 067 266,84 и 288 304,63 руб. соответственно). При этом затраты на ЛП при использовании атезо- лизумаба с наб-паклитакселом в сравнении с монотерапией наб-паклитакселом отличались в 3 раза.
На рис. 7 приведены показатели эффективности для сравниваемых стратегий терапии [57, 58].

Рис. 7. Эффективность в группах сравнения, критерий — общая выживаемость, % на конец 1-го года
Примечания: палбоциклиб + фулвестрант: палбоциклиб 125 мг 1 раз в сутки в 1—21-й день цикла, фулвестрант 500 мг в/м в 1-й и 15-й дни цикла (затем 500 1 в 1-й день цикла); длительность цикла 28 дней; фулвестрант: фулвестрант по 500 мг в/м 1-й цикл — 1-й и 15-й день, со второго 500 мг в/м 1 раз в цикл; длительность 28 дней.
Как видно из данных, представленных на рис. 7, относительно общей выживаемости на конец 1-го года моделирования применение палбоциклиба и фулвестрантом при местнораспространённом и метастатическом РМЖ были более эффективны, чем ЛП сравнения [57, 58].
С точки зрения соотношения затрат и эффективности применение палбоциклиба в сочетании с фулвестрантом отличалось большей эффективностью по сравнению с ЛП сравнения — фулвестран- том соответственно, при этом суммарные затраты на их использование были значительно выше. При анализе эффективности относительно общей выживаемости на конец 1-го года показатели CER для стратегий палбоциклиб + фулвестрант и фулвестрант в монорежиме — 832 180 и 1 915 822 руб. соответственно.
Как видно из данных, представленных в табл. 3, при сопоставлении с ЛП сравнения применение палбоциклиба в комбинации с фулвестрантом соответствовало ICER по выбранному критерию эффективности, значительно превышающему порог готовности общества платить.
Таблица 3
Коэффициент ICER для стратегий сравнения (горизонт моделирования 1 год)
Стратегия | Затраты, руб. | Прирост затрат, руб. | ОВ, % | Прирост эффект., % [66, 67] | ICER (руб./год ОВ) |
|---|---|---|---|---|---|
Палбоциклиб + фулвестрант | 1 647 607 | 948 575 | 86,0 | 2,0 | 47 428 765,46 |
Фулвестрант | 699 032 |
| 84,0 | - | - |
Примечания: ОВ — общая выживаемость; ICER — инкрементный показатель; палбоциклиб + фулвестрант: палбоциклиб 125 мг 1 раз в сутки в 1—21-й день цикла, фулвестрант 500 мг в/м в 1-й и 15-й дни цикла (затем 500 1 в 1-й день цикла); длительность цикла 28 дней; фулвестрант: фулвестрант по 500 мг в/м 1-й цикл — 1-й и 15-й день, со второго 500 мг в/м 1 раз в цикл; длительность 28 дней.
Результаты анализа сравнения фармакоэкономических показателей терапии комбинацией атезолизумаба и наб-паклитаксела с альтернативной терапевтической опцией, применяемой в лечении местнораспространённого и метастатического РМЖ, приведены на рис. 8.

Рис. 8. Результаты проведённого сравнительного анализа ICER для комбинации атезолизумаба + наб-паклитаксела и дополнительной альтернативы комбинации палбоциклиба + фулвестранта
Примечания: ОВ — общая выживаемость; ICER — инкрементный показатель; атезолизумаб + наб-паклитаксел: атезолизумаб 840 мг в/в каждые 2 недели (1-й и 15-й день цикла), наб-паклитаксел по 100 мг/кг в 1-й, 8-й и 15-й дни цикла; палбоциклиб+- фулвестрант: палбоциклиб 125 мг 1 раз в сутки в 1—21-й день цикла, фулвестрант 500 мг в/м в 1-й и 15-й дни цикла (затем 500 1 в 1-й день цикла); длительность цикла 28 дней
По данным рис. 8, значение ICER в отношении ОВ на конец первого года наблюдения для комбинации атезолизумаб + наб-паклитаксел значительно ниже соответствующего инкрементного коэффициента эффективности затрат палбоциклиба в сочетании с фулвестрантом (рис. 8). Так, полученный показатель для комбинации атезолизумаб + наб-паклитаксел ниже аналогичного ICER для палбоциклиба в сочетании с фулвестрантом на 36 %.
Таким образом, ориентируясь на данные сравнения фармакоэкономических показателей эффективности применения другой дорогостоящей альтернативы, доступной в системе ОМС, можно заключить, что применение комбинации атезолизумаб + наб-паклитаксел в качестве терапии мТНРМЖ железы является экономически приемлемой и целесообразной.
Дополнительно необходимо отметить, что использование наиболее эффективной терапевтической опции в отношении лечения мТНРМЖ отличается фармакоэкономическими показателями, определяющие большую эффективность затрат на оцениваемую комбинацию атезолизумаб + наб-паклитаксел в сравнении с другим широко применяемым вариантом дорогостоящей терапии РМЖ на текущий момент.
С целью проверки результатов анализа в условиях изменения входных параметров был выполнен анализ чувствительности, который подтвердил устойчивость полученных результатов в настоящем клинико-экономическом исследовании.
Анализ влияния на бюджет — оценка экономических последствий включения комбинированного режима терапии атезолизумабом и наб-паклитакселом мТНРМЖ в ПГГ в системе ОМС. Целью проведения АВБ является оценка изменений экономических последствий включения и расширения применения комбинированной терапии атезолизумабом и наб-паклитакселом для больных с мТНРМЖ. Для моделирования динамики изменений затрат на ХТ РМЖ в целом при включении указанной схемы в рамки оказания медицинской помощи в системе ОМС использовались элементы методики утверждённых рекомендаций по проведению анализа влияния на бюджет [49]. В процессе выполнения АВБ смоделирована стоимость тарифа КСГ для схемы атезолизумаб + наб-паклитаксел. Планируемый АВБ должен продемонстрировать суммарный экономический эффект расширения использования комбинации атезолизумаб + наб-паклитаксел в системе ОМС у пациентов с неоперабельным мТНРМЖ.
Оценка размера общей популяции пациентов в РФ с РМЖ, для лечения которой необходима ХТ или иммунохимиотерапия, и последующая сегментация до целевой популяции. В 2018 г. в России впервые выявлено 70 376 больных с РМЖ, из них 7,8 % (5 489) на IV стадии [1]. Доступность иммунохимического анализа составляет 82 % (4 501) [59], из них под показания комбинации атезолизумаб + наб-паклитаксел подходит порядка 3 488 пациента. Если предположить, что доступность PD-L1 диагностики составляет 100 %, то PD-L1 положительный статус будет у 40 % по данным исследования Schmid P et al. [30]. Таким образом, в терапии комбинацией атезолизумаб + наб-паклитаксел могут нуждаться не более 1 400 больных.
Определение текущей практики применения рассматриваемых терапевтических подходов — тарифов на проведение ХТ и иммунохимиотерапии РМЖ. Был проведён анализ схем ХТ и иммунохимиотерапии РМЖ, входящие в группировщик КСГ, чтобы определить уровень затрат на химиотерапевтическое лечение рассматриваемой нозологии. Оценивалось не менее 147 тарифов, которые были разделены на группы по величине оплаты законченного случая и определены их процентное соотношение между собой, что и использовалось для формирования распределения между тарифами КСГ на ХТ и иммунохимиотерапию РМЖ для моделирования текущей практики применения рассматриваемых терапевтических подходов, ввиду отсутствия данных по России о преимущественном использовании тех или иных режимов у больных с РМЖ разных стадий. Текущая практика распределения тарифов на ХТ и иммунохимиотерапию РМЖ представлена в табл. 4. Изменение в частоте применения тарифов для оценки затрат на целевую популяцию пациентов в текущей практике и при внедрении и расширении применения тарифа для комбинированного лечения атезолизумабом и наб-паклитакселом применялось посредством уменьшения количества пациентов на других дорогостоящих тарифах. Основной целью расширения использования атезолизумаба и наб-паклитаксела является предоставление наиболее эффективного лечения всем нуждающимся пациентам с мТНРМЖ и экспрессией PD-L1 и, как следствие, увеличение показателей выживаемости для данной категории больных. Моделируемые показатели применения оцениваемых тарифов также суммированы в табл. 4.
Таблица 4
Текущая и ожидаемая (при внедрении и расширении применения атезолизумаба и наб-паклитаксела в системе ОМС) практика ведения целевой популяции пациентов
Тарифы КСГ | Затраты на 1-й цикл ХТ в соответствии с тарифом | Частота назначения | |||
|---|---|---|---|---|---|
Текущая практика | 1-й год АВБ | 2-й год АВБ | 3-й год АВБ | ||
ХТ по тарифу st19.027 | 18 038 | 0,1224 | 0,1324 | 0,1424 | 0,1424 |
ХТ по тарифу st19.028 | 31 646 | 0,1701 | 0,1801 | 0,1901 | 0,1971 |
ХТ по тарифу st19.029 | 52 849 | 0,0952 | 0,1052 | 0,1052 | 0,1052 |
ХТ по тарифу st19.030 | 68 989 | 0,1293 | 0,1293 | 0,1293 | 0,1293 |
ХТ по тарифу st19.031 | 85 129 | 0,0748 | 0,0748 | 0,0748 | 0,0748 |
ХТ по тарифу st19.032 | 108 863 | 0,0476 | 0,0476 | 0,0476 | 0,0476 |
ХТ по тарифу st19.033 | 139 877 | 0,0884 | 0,0784 | 0,0784 | 0,0784 |
ХТ по тарифу st19.034 | 170 574 | 0,1429 | 0,1329 | 0,1229 | 0,1229 |
ХТ по тарифу st19.035 | 273 741 | 0,0816 | 0,0616 | 0,0516 | 0,0416 |
ХТ по тарифу st19.036 | 463 302 | 0,0477 | 0,0377 | 0,0277 | 0,0207 |
Атезолизумаб + наб-паклитаксел | - | 0,0000 | 0,0200 | 0,0300 | 0,0400 |
Итого: |
| 1,000 | 1,000 | 1,000 | 1,000 |
Примечания: КСГ — клинико-статистическая группа; ХТ — химиотерапия; АВБ — анализ влияния на бюджет; атезолизумаб + наб-паклитаксел: атезолизумаб 840 мг в/в каждые 2 недели (1-й и 15-й день цикла) или 1 200 мг в/в каждые 3 недели, наб-паклитаксел по 100 мг/кг в 1-й, 8-й и 15-й дни цикла; наб-паклитаксел: наб-паклитаксел по 100 мг/кг в 1-й, 8-й и 15-й дни цикла.
Оценка затрат на целевую популяцию пациентов в текущей практике распределения тарифов и при внедрении и расширении применения тарифа на комбинированную терапию атезолизумабом и наб-паклитакселом. Затраты на лечение будут оценены в соответствии с указанными тарифами в табл. 4. Тарифа на комбинированную терапию атезолизумабом и нам-паклитакселом мТНРМЖ в настоящий момент не предусмотрено, что требует определения минимального уровня оплаты для круглосуточных стационаров, которые планируют применять данный режим системного лечения РМЖ. С этой целью были вычислены стоимости ЛП для дорогостоящих схем ХТ и иммунохимиотерапии по разным нозологиям, входящим в КСГ по тарифам ds19.026 (292 420,54 руб.), ds19.027 (556 782,73 руб.), st19.034 (170 573,66 руб.), st19.035 (273 740,67 руб.), st19.036 (463 302,12 руб.), и определена средняя разница между затратами на ЛП и размером тарифа, которая составила 144 189,66 руб. Таким образом, минимальный тариф по КСГ для комбинации атезолизумаб + наб-паклитаксел в настоящем моделировании принят в размере 737 043,00 руб.
Затраты на ведение целевой популяции пациентов в текущей практике и при изменении соотношения в использовании представленных тарифов на ХТ и иммунохимиотерапию РМЖ в 1-й, 2-й и 3-й годы АВБ приведены в табл. 5.
Таблица 5
Затраты на лечение целевой популяции пациентов в текущей и ожидаемой практике

Примечания: ХТ — химиотерапия; атезолизумаб + наб-паклитаксел: атезолизумаб 840 мг в/в каждые 2 недели (1-й и 15-й день цикла) или 1 200 мг в/в каждые 3 недели, наб-паклитаксел по 100 мг/кг в 1-й, 8-й и 15-й дни цикла; наб-паклитаксел: наб-паклитаксел по 100 мг/кг в 1-й, 8-й и 15-й дни цикла.
Таким образом, затраты на текущий вариант распределения тарифов на ХТ и иммунохимиотерапию РМЖ в расчёте на численность целевой популяции в 70 376 пациентов составили 8 041 950 697 руб. Анализ динамики экономических последствий внедрения и применения комбинации атезолизумаб + наб-паклитаксел в системе ОМС у пациентов с мТНРМЖ, с учётом изменения долей распределения между тарифами на оказание медицинской помощи, включающей системную лекарственную противоопухолевую терапию, показал, что на первый год АВБ затраты возрастут на 179 791 603 руб., или на 2,2 % и составят 8 221 742 301 руб., а к третьему году разница составит 2,6 % и затраты на ожидаемый вариант лекарственной терапии будут равны 8 249 894 235 руб. (рис. 9-10).
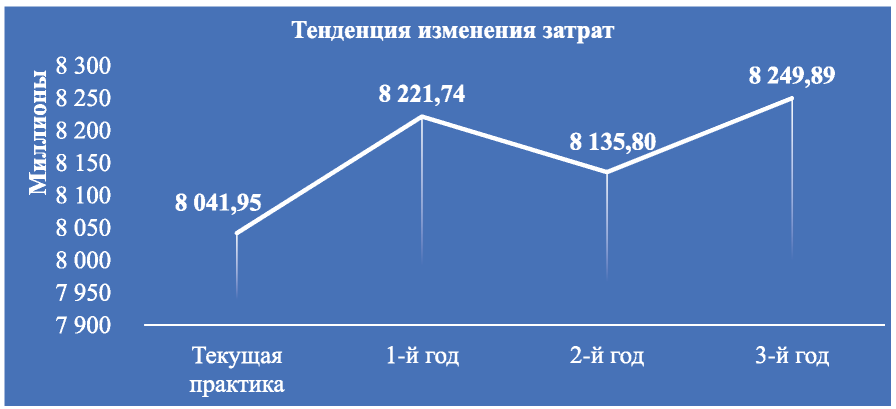
Рис. 9. Тенденция изменения прямых медицинских затрат

Рис. 10. Тенденция изменения прямых медицинских затрат
Примечание: АВБ — анализ влияния на бюджет.
Таким образом, анализ тенденции изменений средневзвешенных затрат демонстрирует следующее: расширение использования комбинации атезо- лизумаб + наб-паклитаксел при лечении пациентов с ТНРМЖ в сравнении со стратегией использования монотерапии наб-паклитакселом в целевой популяции не приводит к значимому росту затрат на терапию у больных с РМЖ: при предоставлении терапии до 1 400 пациентам, что включает всю целевую популяцию впервые выявленных больных с мТНРМЖ и экспрессией PD-L1, изменение затрат на ХТ и иммунохимиотерапию РМЖ останется в пределах 2,6 %.
Анализ чувствительности. Был предусмотрен анализ чувствительности результатов расчётов к изменениям исходных параметров модели АВБ: колебаниям численности целевой популяции пациентов, тарифов на рассматриваемые схемы ХТ. Выбор параметров обусловлен тем, что данные показатели являются ключевыми в модели, а также наиболее подвержены колебаниям в условиях рынка функционирования системы здравоохранения в различных регионах РФ. По результатам проведённого анализа чувствительности, построенная модель для оценки динамики последствий изменения текущей практики ХТ и иммунохимиотерапии в РФ чувствительна к изменению частоты применения и стоимости оцениваемых подходов к системной терапии РМЖ, что подтверждает выводы, полученные в основном сценарии АВБ.
Обсуждения
Развитие качественной и эффективной онкологической помощи — является одним из приоритетных моментов в части реализации национальных проектов (программ) по направлениям «Демография» и «Здравоохранение». Согласно Указу Президента РФ от 07.05.2018 «О национальных целях и стратегических задачах развития Российской Федерации на период до 2024 года» [60], планируется добиться снижения смертности от новообразований, в том числе от злокачественных (до 185 случаев на 100 тыс. населения) в том числе и по итогам выполнения таких задач, как внедрение высокоэффективных методов лечения онкологических заболеваний. Подобные решения закономерно требуют дополнительного финансирования, а значит, и оценки целесообразности и приемлемости таких внедрений.
ТНРМЖ является агрессивным подтипом опухоли с высоким риском прогрессирования заболевания, ранним поражением внутренних органов и центральной нервной системы. Существует ограниченное количество терапевтических опций, обеспечивающих хотя бы минимальный контроль над заболеванием, что обусловливает необходимость внедрения и расширения новых медицинских технологий. Комбинированная терапия мТНРМЖ ате- золизумабом и наб-паклитакселом патогенетически обусловлена молекулярно-генетическим профилем рассматриваемой опухоли и является на текущей момент единственным лечением, позволяющим максимально увеличить продолжительность жизни пациентам с данной патологией при сравнимом профиле безопасности. Для оценки целесообразности и приемлемости внедрения и применения данной технологии было проведено настоящее клиникоэкономическое исследование с позиции российского здравоохранения.
По итогам настоящего моделирования, продемонстрированы фармакоэкономические показатели применения рассматриваемой комбинации в сравнении с другой дорогостоящей терапевтической альтернативой, применяемой при РМЖ и включённой для оказания медицинской помощи в системе ОМС. При рассмотрении такого показателя эффективности, как общая выживаемость, было отмечено, что уровень дополнительных затрат (стоимости) при предотвращении 1 случая смерти для атезолизумаба и наб-паклитаксела ниже на 36 % в сравнении с комбинацией палбоциклиб + фулвестрант — ЛП, применяемых также для тяжёлых форм РМЖ — местнораспространённого и метастатического рака.
Если продолжить сравнение фармакоэкономических показателей дорогостоящих ЛП для лечения онкологических нозологий другой локализации, нежели молочная железа, можно обратиться к публикации [61], где сопоставляются стоимости месяца сохраненной жизни среди различных химиотерапевтических и иммунохимиотерапевтических подходов (табл. 6). Стоимость сохранённого месяца жизни для комбинированной терапии атезолизумабом и наб-паклитакселом при показатели общей выживаемости в месяцах составляет 436 612 руб., что значительно ниже представленных в табл. 6 стоимостей месяца жизни при других онкологических патологиях.
Таблица 6
Стоимости сохраненного месяца жизни для ЛП, применяемых при онкологической патологии (по данным Хачатрян Г.Р., и др. [61]).
Препарат | Показание | Источники данных для расчёта ICER | Разница в затратах, руб. | Разница в эффективности, мес. жизни | ICER, руб./ месяц жизни |
|---|---|---|---|---|---|
Брентуксимаб ведотин vs. отсутствие терапии | Рецидивирующая или рефрактерная CD30-позитивная ЛХ | [62, 63] | 6 133 627,07 | 11,70 | 524 241,63 |
Бевацизумаб + интерферон-альфа 2b vs. интерферон-альфа 2b | Метастатическая почечно-клеточная карцинома | [64] | 2 289 569,62 | 0,90 | 2 543 966,24 |
Эрибулин vs. капецитабин | Метастатический рак молочной железы | [65] | 1 292 337,80 | 1,40 | 923 098,43 |
Панитумумаб vs. цетуксимаб | Метастатическая аденокарцинома толстой или прямой кишки | [66] | 392 982,88 | 0,40 | 982 457,20 |
Кабазитаксел vs. митоксантрон | Метастатический кастрационно-резистентный рак простаты | [67] | 1 535 115,36 | 2,40 | 639 631,40 |
На текущий момент ПГГ в рамках предоставления медицинской помощи больным за счёт средств ОМС не предусмотрено тарифа КСГ со схемой терапии атезолизумаб в комбинации с наб-паклитакселом. При этом изменения в ГТС с 01.08.2019 г., к примеру, предусматрив ают использов ание комбиниров анной ХТ с ипилимумабом в рамках тарифа стоимостью 1 569 024,54 руб., что позволяет предполагать возможность внедрения иных комбинированных дорогостоящих режимов противоопухолевого медикаментозного лечения сложных категорий онкологических пациентов.
По результатам моделирования при проведении АВБ, внедрение указанной схемы комбинации атезолизумаб + наб-паклитаксел для терапии мТНРМЖ требует дополнительных средств бюджета, однако при предоставлении терапии до 1 400 пациентам, что включает всю целевую популяцию впервые выявленных больных с мТНРМЖ и экспрессией PD-L1, общее изменение затрат на ХТ и иммунохимиотерапию РМЖ остаётся в пределах 2,6 %.
Таким образом, во-первых, установлено, что стоимости сохраненного года (месяца) жизни и предотвращения одного случая смерти для комбинации атезолизумаба с наб-паклитакселом ниже, чем для других современных дорогостоящих онкологических препаратов, при этом отмечается высокий уровень прироста эффективности, во-вторых, показано отсутствие значительного увеличения затрат на ХТ и иммунохимиотерапию больных РМЖ в контексте обеспечения целевой популяции пациентов. Полученные в ходе настоящего клинико-экономического исследования результаты демонстрируют экономическую приемлемость и целесообразность внедрения рассматриваемой терапевтической опции — комбинированного лечения атезолизумабом и наб-паклитакселом, для больных с мТНРМЖ в РФ.
Выводы
- Комбинированная терапия атезолизумабом и наб-паклитакселом является высокоэффективной схемой лечения метастатического или неоперабельного местнораспространённого тройного негативного рака молочной железы в первой линии терапии при наличии экспрессии PD-L1≥1 % — единственной опцией, позволяющей достичь максимальные показатели по общей выживаемости.
- Внедрение оцениваемой схемы терапии в пределах целевой популяции и обеспечение её доступности в рамках оказания медицинской помощи в системе ОМС не приведёт к существенному увеличению затрат на ХТ рака молочной железы, и при этом позволит пролечить до 1 400 больных, не имеющих эффективных терапевтических альтернатив.
- Фармакоэкономические показатели применения комбинации атезолизумаба и наб-паклитаксела отличаются большей эффективностью затрат в сравнении с иными дорогостоящими схемами терапии как рака молочной железы, так и опухолей иных локализаций, активно используемых в текущей практике, что позволяет говорить о приемлемости и целесообразности внедрения и расширения применения данной терапевтической опции в целевой популяции.
Список литературы
1. Злокачественные новообразования в России в 2018 году / Под ред. Каприн А.Д., Старинский В.В., Петрова Г.В. — М.: МНИОИ им. П.А. Герцена — филиал ФГБУ «НМИРЦ» Минздрава России; 2019. [Zlokachestvennye novoobrazovaniya v Rossii v 2018 godu / Ed by Kaprin AD, Starinskii VV, Petrova GV. Moscow: MNIOI im. P.A. Gercena — filial FGBU «NMIRC» Minzdrava Rossii; 2019. (In Russ).]
2. Летягин В.П. Опухоли молочной железы. — М.: 2000; 113-25. [Letiagin VP. Opuholi molochnoj zhelezy. Moscow: 2000; 113-25. (In Russ).]
3. Dent R, Hanna WM, Trudeau M, et al. Pattern of metastatic spread in triple-negative breast cancer. Breast Cancer Res. Treat. 2009;115(2):423-428. DOI: 10.1007/s10549-008-0086-2
4. Nishimura R, Arima N. Is triple negative a prognostic factor in breast cancer? Breast Cancer. 2008;15(4):303-308. DOI: 10.1007/s12282-008-0042-3.
5. Cheang MC, Voduc D, Bajdik C, et al. Basal-like breast cancer defined by five biomarkers has superior prognostic value than triple-negative phenotype. Clin. Cancer Res. 2008;14(5):1368-1376.
6. Hines SL, Vallow LA, Tan WW, et al. Clinical outcomes after a diagnosis of brain metastases in patients with estrogen- and/or human epidermal growth factor receptor 2-positive versus triple-negative breast cancer. Ann. Oncol. 2008;19(9):1561-1565. DOI: 10.1093/annonc/mdn283
7. Yuan ZY, et al. Clinical Characteristics and Prognosis of Triple-negative Breast Cancer: A Report of 305 Cases. Ai Zheng. 2008;27(6):561-565.
8. Phipps AI, Malone KE, Porter PL, et al. Reproductive and hormonal risk factors for postmenopausal luminal, HER-2-overexpressing, and triple-negative breast cancer. Cancer. 2008;113(7):1521-1526. DOI: 10.1002/cncr.23786.
9. Nam BH, Kim SY, Han HS, et al. Breast cancer subtypes and survival in patients with brain metastases. Breast Cancer Res. 2008;10(1):R20. DOI: 10.1186/bcr1870.
10. Брагина О.Д. Клинико-морфологические особенности трипл-негативного рака молочной железы // Сибирский онкологический журнал. 2010; Приложение 1: 26. [Bragina OD. Kliniko-morfologicheskie osobennosti tripl-negativnogo raka molochnoj zhelezy. Sibirskij onkologicheskij zhurnal. 2010; suppl. 1:26. (In Russ).]
11. Карселадзе Д.А. Тройной негативный рак молочной железы (клинико-биологические особенности): Автореф. дис....канд. мед. наук. — М.: 2010. [Karseladze DA. Trojnoj negativnyj rak molochnoj zhelezy (klinikobiologicheskie osobennosti): [dissertation] Moscow: 2010. (In Russ).] Доступно по: http://medical-diss.com/docreader/326710/d#?page=1 Ссылка активна на 25.03.2020.
12. Rouzier R, Perou CM, Symmans WF, et al. Breast cancer molecular subtypes respond differently to preoperative chemotherapy. Clin. Cancer. Res. 2005;11(16):5678-85. DOI: 10.1158/1078-0432.CCR-04-2421
13. Reis-Filho JS, Tutt AN. Triple negative tumors: a critical review. Histopathology. 2008;52(1):108-18. DOI: 10.1111/j.1365-2559.2007.02889.x
14. Муфазалов Ф.Ф., Шарипова Н.С. Тройной негативный рак молочной железы: современное состояние проблемы и не совсем обычный случай лечения // Злокачественные опухоли. — 2014. — Т.8. — №1. — C.19-31. [Mufazalov FF, SHaripova NS. Trojnoj negativnyj rak molochnoj zhelezy: sovremennoe sostoyanie problemy i ne sovsem obychnyj sluchaj lecheniya. Journal of Malignant tumours. 2014;8(1):19-31. (In Russ).]
15. Смирнова О.В., Борисов В.И., Генс Г.П. Эволюция представления о тройном негативном раке молочной железы: от биологии опухоли к современному лекарственному лечению // Злокачественные опухоли. — 2017. — №1. — С.5-17. [Smirnova OV, Borisov VI, Guens GP. The evolution of knowledge of triple-negative breast cancer: from biology to novel drug treatment. Malignant Tumours. 2017;(1):5-17. (In Russ).] DOI: 10.18027/2224—5057—2017—1—5—17
16. Смирнова О.В., Борисов В.И., Генс Г.П. Непосредственные и отдаленные результаты лекарственного лечения больных с метастазами тройного негативного рака молочной железы // Злокачественные опухоли. — 2018. — №3. — С.68-77. [Smirmova OV, Borisov VI, Guens GP. Immediate and long-term outcomes of drug treatment in patients with metastatic triple negative breast cancer. Malignant Tumours. 2018;(3):68-77. (In Russ).] DOI: 10.18027/2224—5057—2018—8—3—68—77
17. Кеnnecke H, Yerushalmi R, Woods R, et al. Metastatic behavior of breast cancer subtypes. J Clin Oncol. 2010 Jul 10;28(20):3271-7. DOI: 10.1200/JCO.2009.25.9820.
18. Dent R, et al. Triple-negative breast cancer: clinical features and patterns of recurrens. Clin Cancer Res. 2007 Aug 1;13(15 Pt 1):4429-34. DOI: 10.1158/1078-0432.CCR-06-3045
19. Жукова Л.Г. Клинические и фундаментальные аспекты прогноза и рационального лечения рака молочной железы с тройным негативным фенотипом: Автореф. дис.... докт. мед. наук. — М.: 2015. [ZHukova LG. Klinicheskie i fundamental’nye aspekty prognoza i racional’nogo lecheniya raka molochnoj zhelezy s trojnym negativnym fenotipom. [dissertation] Moscow: 2015. (In Russ).] Доступно по: http://medical-diss.com/docreader/326710/d#?page=1 Ссылка активна на 25.03.2020.
20. Takahashi M, Yonemori K, Yamamoto H, et al. A phase I/II trial of olaparib in combination with eribulin in patients with advanced or metastatic triple negative breast cancer (TNBC) previously treated with anthracyclines and taxanes: The analyses of efficacy and safety from phase II. J Clin Oncol. 2016; 34(15_suppl):1080-1080. DOI: 10.1200/JCO.2016.34.15_suppl.1080
21. Baselga J, Stemmer S, Pego A, et al. Cetuximab + cisplatin in estrogen receptor-negative, progesterone receptor-negative, HER2-negative (triple negative) metastatic breast cancer: results of the randomized phase II BALI-1 trial. Cancer Res. 2010;70:(Abstr PD01—01, presented data — SABCS 2010).
22. Gucalp A, Tolaney S, Isakoff SJ, et al. Phase II trial of bicalutamide in patients with androgen receptor-positive, estrogen receptor-negative metastatic Breast Cancer. Clin Cancer Res. 2013;19(19):5505-5512. DOI: 10.1158/1078-0432.CCR-12-3327
23. Tutt A, Ellis P, Kilburn L, et al. Abstract S3-01: The TNT trial: A randomized phase III trial of carboplatin (C) compared with docetaxel (D) for patients with metastatic or recurrent locally advanced triple negative or BRCA1/2 breast cancer (CRUK/07/012). San Antonio, TX: 2014 San Antonio Breast Cancer Symposium. Cancer Research 2014;75(9 Supplement):S3-01-S3-01. DOI: 10.1158/1538-7445.SABCS14-S3-01
24. Fan Y, Xu BH, Yuan P, et al. Docetaxel-cisplatin might be superior to docetaxel-capecitabine in first-line treatment of metastatic triple-negative breast cancer. Ann Oncol. 2013 May;24(5):1219-25. DOI: 10.1093/annonc/mds603
25. Hu XC, Zhang J, Xu BH, et al. Cisplatin plus gemcitabine versus paclitaxel plus gemcitabine at first-line therapy for metastatic triple-negative breast cancer (CBCG006): a randomized, open-label, multicentre, phase 3 trial. Lancet Oncol. 2015;16(4): 436-446. DOI: 10.1016/S1470-2045(15)70064-1
26. Kaufman PF, et al. Phase III open-label randomized study of eribulin mesylate versus capecitabine in patients with locally advanced or metastatic breast cancer previously treated with an anthracycline and a taxane. J Clin Oncol. 2015;33(6):594-601. DOI: 10.1200/JCO.2013.52.4892
27. Pivot X, Im SA, Guo M, et al. Subgroup analysis of patients with HER2-negative metastatic breast cancer in the second-line setting from a phase 3, open-label, randomized study of eribulin mesilate versus capecitabine. Breast Cancer. 2018;25:370-374. DOI: 10.1007/s12282-017-0826-4
28. Adams S, Diamond JR, Hamilton EP, et al. Phase Ib trial of atezolizumab in combination with nab-paclitaxel in patients with metastatic triple-negative breast cancer (mTNBC). [ASCO 2016 abstract 1009]. J Clin Oncol. 2016;34 (suppl.). DOI: 10.1200/JCO.2016.34.15_suppl.1009
29. Emens LA, Adams S, Loi S, et al. Impassion 130: a Phase III randomized trial of atezolizumab with nab-paclitaxel for first-line treatment of patients with metastatic triple-negative breast cancer (mTNBC). [ASCO 2016 abstract TPS1104]. J Clin Oncol. 2016;34 (suppl.).
30. Schmid P, Adams S, Rugo HS, et al. Atezolizumab and Nab-Paclitaxel in Advanced Triple-Negative Breast Cancer. N Engl J Med. 2018;379(22):2108-2121. DOI: 10.1056/NEJMoa1809615
31. Dirix LY, Takacs I, Nikolinakos P, et al A Phase I Trial to Investigate the Tolerability, Safety, Pharmacokinetics, Biological and Clinical Activity of Avelumab (MSB0010718C) in Japanese Subjects With Metastatic or Locally Advanced Solid Tumors, With Expansion Part in Asian Subjects With Gastric Cancer (Javelin Solid Tumor JPN). 2015. SABCS. Abstract S1-04.
32. Nanda R, Chow LQ, Dees EC, et al. A phase Ib study of pembrolizumab (MK-3475) in patients with advanced triple-negative breast cancer. 2014, San Antonio, TX: 2014 San Antonio Breast Cancer Symposium.
33. Winer EP, Dang T, Karantza V, et al. KEYNOTE-119: A randomized phase III study of single-agent pembrolizumab (MK-3475) vs single-agent chemotherapy per physician’s choice for metastatic triple-negative breast cancer (mTNBC). [ASCO 2016 abstract TPS1102]. J Clin Oncol. 2016; 34 (suppl).
34. The Cancer Genome Atlas Network. Comprehensive molecular portraits of human breast tumors. Nature. 2012 Oct 4;490(7418):61-70. DOI: 10.1038/nature11412
35. Mittendorf EA, Philips AV, Meric-Bernstam F, et al. PD-L1 expression in triple-negative breast cancer. Cancer Immunol Res. 2014;2(4):361-370. DOI: 10.1158/2326-6066.CIR-13-0127
36. Ghebeh H, Mohammed S, Al-Omair A, et al. The B7-H1 (PD-L1) T lymphocyte-inhibitory molecule is expressed in breast cancer patients with infiltrating ductal carcinoma: correlation with important high-risk prognostic factors. Neoplasia. 2006;8(3):190-198. DOI: 10.1593/neo.05733
37. Emens LA, Braiteh FS, Cassier P, et al. Inhibition of PD-L1 by MPDL3280A leads to clinical activity in patients with metastatic triplenegative breast cancer. 2014, San Antonio, TX: 2014 San Antonio Breast Cancer Sympsoium. Cancer Research. 75:PD1-PD6
38. Ali HR, Glont SE, Blows FM, et al. PD-L1 protein expression in breast cancer is rare, enriched in basal-like tumours and associated with infiltrating lymphocytes. Ann Oncol. 2015;26(7):1488-1493. DOI: 10.1093/annonc/mdv192
39. Muenst S, Schaerli AR, Gao F, et al. Expression of programmed death ligand 1 (PD-L1) is associated with poor prognosis in human breast cancer. Breast Cancer Res Treat. 2014;146(1):15-24. DOI: 10.1007/s10549-014-2988-5
40. Сайт Государственного реестра лекарственных средств. [Sajt Gosudarstvennogo reestra lekarstvennyh sredstv. (In Russ).] Доступно по: http://grls.rosminzdrav.ru. Ссылка активна на 25.03.2020.
41. Инструкция по применению лекарственного препарата для медицинского применения Тецентрик®. [Instrukciya po primeneniyu lekarstvennogo preparata dlya medicinskogo primeneniya Tecentriq. (In Russ).] Доступно по: https://www.vidal.ru/drugs/tecentriq Ссылка активна на 25.03.2020.
42. Schmid P, et al. IMpassion130: updated overall survival (OS) from a global, randomized, double-blind, placebo-controlled, Phase III study of atezolizumab (atezo) + nab-paclitaxel (nP) in previously untreated locally advanced or metastatic triple-negative breast cancer (mTNBC). 2019 ASCO Annual Meeting. Journal of Clinical Oncology. 2019;37(15 suppl):1003-1003. DOI: 10.1200/JCO.2019.37.15_suppl.1003
43. Постановление Правительства РФ от 10.12.2018 N 1506 «О Программе государственных гарантий бесплатного оказания гражданам медицинской помощи на 2019 год и на плановый период 2020 и 2021 годов». [Resolution of the Government of the Russian Federation of 10.12.2018 N 1506. «O Programme gosudarstvennyh garantij besplatnogo okazaniya grazhdanam medicinskoj pomoshchi na 2019 god i na planovyj period 2020 i 2021 godov». (In Russ).] Доступно по: https://www.garant.ru/products/ipo/prime/doc/72023058/ Ссылка активна на 25.03.2020.
44. Федеральный фонд обязательного медицинского страхования [Federal’nyj fond obyazatel’nogo medicinskogo strahovaniya. (In Russ).] Доступно по: http://www.ff oms.ru/ Ссылка активна на 25.03.2020.
45. Об утверждении отраслевого стандарта «клинико-экономические исследования. Общие положения»: приказ №163 Министерства Здравоохранения Российской Федерации от 27.05.2011. [Ob utverzhdenii otraslevogo standarta «kliniko-ekonomicheskie issledovaniya. Obshchie polozheniya»: order No. 163 of the Ministry of Health of the Russian Federation of 27.05.2011. (In Russ).]
46. Методические рекомендации по проведению сравнительной клинико-экономической оценки лекарственного препарата. ФГБУ «ЦЭККМП» Минздрава России. Утверждены приказом ФГБУ «ЦЭККМП» Минздрава России от «29» декабря 2018 г. No 242-од. Москва 2018. [Metodicheskie rekomendacii po provedeniyu sravnitel’noj klinikoekonomicheskoj ocenki lekarstvennogo preparata. FGBU «CEKKMP» Minzdrava Rossii. Approved by order No. 242-od of the Ministry of health of the Russian Federation dated December 29, 2018. Moscow 2018. (In Russ).] Доступно по: https://rosmedex.ru/wp-content/uploads/2019/06/MRKE%60I_novaya-redaktsiya_2018-g..pdf Ссылка активна на 25.03.2020.
47. Weinstein MC, O’Brien B, Hornberger J, et al. Principles of good practice for decision analytic modeling in health-care evaluation: report of the ISPOR Task Force on Good Research Practices—Modeling Studies. Value Health. 2003;6(1):9-17. DOI: 10.1046/j.1524-4733.2003.00234.x
48. Основные понятия в оценке медицинских технологий: метод. пособие / Под общ. ред. Колбина А.С., Зырянова С.К., Белоусова Д.Ю. — Москва: Издательство ОКИ, 2013. [Osnovnye ponyatiya v ocenke medicinskih tekhnologij: metod. posobie. Ed by Kolbina AS, Zyrianova SK, Belousova DYu. Moscow: LLC «Publishing OKI»; 2013. (In Russ).]
49. Методические рекомендации по оценке влияния на бюджет в рамках реализации программы государственных гарантий бесплатного оказания гражданам медицинской помощи. ФГБУ «ЦЭККМП» Минздрава России. Утверждены приказом ФГБУ «ЦЭККМП» Минздрава России от «23» декабря 2016 г. No 145-од. Москва 2016. [Metodicheskie rekomendacii po ocenke vliyaniya na byudzhet v ramkah realizacii programmy gosudarstvennyh garantij besplatnogo okazaniya grazhdanam medicinskoj pomoshchi. FGBU «CEKKMP» Minzdrava Rossii. Approved by order No. 145-od of the Ministry of health of the Russian Federation dated December 23, 2016. Moscow 2016. (In Russ).] Доступно по: https://rosmedex.ru/wpcontent/uploads/2016/12/MR-KE%60I-23.12.2016.pdf Ссылка активна на 25.03.2020
50. Методические рекомендации по расчету затрат при проведении клинико-экономических исследований лекарственных препаратов. ФГБУ «ЦЭККМП» Минздрава России. Утверждены приказом ФГБУ «ЦЭККМП» Минздрава России от «29» декабря 2017 г. № 185-од. [Metodicheskie rekomendacii po raschetu zatrat pri provedenii klinikoekonomicheskih issledovanij lekarstvennyh preparatov. FGBU «CEKKMP» Minzdrava Rossii. Approved by order No. 185-od of the Ministry of health of the Russian Federation dated December 29, 2017. (In Russ).] Доступно по: https://rosmedex.ru/wp-content/uploads/2018/02/Metodicheskie-rekomendatsii-poraschetu-zatrat-pri-provedenii-kliniko-e%60konomicheskih-issledovaniylekarstvennyih-preparatov-2017.pdf Ссылка активна на 25.03.2020.
51. Информационный портал ОМС Санкт-Петербурга. [Informacionnyj portal OMS Saint-Petersburg’s (In Russ).] Доступно по: http://www.spboms.ru/ Ссылка активна на 25.03.2020.
52. http://zakupki.gov.ru/epz/main/public/home.html
53. https://www.pharmindex.ru/
54. По данным аналитической компании IMS, дата выгрузки 28.07.2019 г. [Po dannym analiticheskoj kompanii IMS, data vygruzki 28.07.2019 g. (In Russ).]
55. Клинические рекомендации. Диагностика и лечение рака молочной железы, 2018 г. [Клинические рекомендации. Диагностика и лечение рака молочной железы, 2018 г. (In Russ).] Доступно по: https://oncologyassociation.ru/files/clinical-guidelines_adults%C2%A0-%20projects2018/rak_molochnoy_zhelezy_pr2018.pdf Ссылка активна на 25.03.2020.
56. Инструкция по применению лекарственного препарата для медицинского применения Абраксан® [Instrukciya po primeneniyu lekarstvennogo preparata dlya medicinskogo primeneniya Abraxane (In Russ).] Доступно по: https://www.vidal.ru/drugs/abraxane__38394 Ссылка активна на 25.03.2020.
57. Turner NC, et al. Overall Survival with Palbociclib and Fulvestrant in Advanced Breast Cancer. N Engl J Med. 2018;379(20):1926-1936. DOI: 10.1056/NEJMoa1810527
58. Cristofanilli M, et al. Fulvestrant plus palbociclib versus fulvestrant plus placebo for treatment of hormone-receptor-positive, HER2-negative metastatic breast cancer that progressed on previous endocrine therapy (PALOMA-3): final analysis of the multicentre, double-blind, phase 3 randomised controlled trial. Lancet Oncol. 2016; 17(14):425-439. DOI: 10.1016/S1470-2045(15)00613-0
59. Поддубная И.В., Франк Г.А., Ягудина Р.И. и др. Результаты эпидемиологической программы скрининга HER2-статуса у пациенток с раком молочной железы в федеральных округах Российской Федерации за 2015 г. // Современная Онкология. — 2016. — Т.18. — №3. — С.19-26. [Poddubnaya IV, Frank GA, Yagudina RI, Koroleva NI, Zavalishina LE. The results of epidemiological screening program of HER2 status in patients with breast cancer in the federal districts of the Russian Federation in 2015. Sovremennaya onkologiya. 2016;18(3):19-26. (in Russ).]
60. Указ Президента РФ от 07.05.2018 «О национальных целях и стратегических задачах развития Российской Федерации на период до 2024 года». [Decree of the President of the Russian Federation from 07.05.2018 «O nacional’nyh celyah i strategicheskih zadachah razvitiya Rossijskoj Federacii na period do 2024 goda». (in Russ).]
61. Хачатрян Г.Р., Федяев Д.В., Авксентьева М.В., Домбровский В.С. Клинико-экономическое исследование применения брентуксимаба ведотина у взрослых пациентов с рецидивирующей или рефрактерной лимфомой Ходжкина. Фармакоэкономика. Современная Фармакоэкономика и Фармакоэпидемиология. — 2016. — №1. — С.3-14. [Khachatryan GR, Fedyaev DV, Avxentyeva MV, Dombrovskiy VS. Cost-effectiveness analysis of brentuximab vedotin in adults with relapsed or refractory Hodgkin’s lymphoma. Farmakoekonomika. Sovremennaya farmakoekonomika i farmakoepidemiologiya. Pharmacoeconomics. Modern pharmacoeconomics and pharmacoepidemiology. 2016;(1):3-14 (In Russ).] DOI: 10.17749/2070-4909.2016.9.1.003-014
62. Arai S, Fanale M, DeVos S, et al. Defining a Hodgkin lymphoma population for novel therapeutics aft er relapse from autologous hematopoietic cell transplant. Leuk Lymphoma. 2013 Nov;54(11):2531-3. DOI: 10.3109/10428194.2013.798868. Epub 2013 Jun 5.
63. Gopal AK, Chen R, Smith SE, et al. Durable remissions in a pivotal phase 2 study of brentuximab vedotin in relapsed or refractory Hodgkin lymphoma. Blood. 2015 Feb 19;125(8):1236-43. DOI: 10.1182/blood-2014-08-595801. Epub 2014 Dec 22.
64. Rini BI, Halabi S, Rosenberg JE, et al. Phase III trial of bevacizumab plus interferon alfa versus interferon alfa monotherapy in patients with metastatic renal cell carcinoma: final results of CALGB 90206. J Clin Oncol. 2010 May 1;28(13):2137-43. DOI: 10.1200/ JCO.2009.26.5561. Epub 2010 Apr 5.
65. Kaufman PA, Awada A, Twelves C, et al. Phase III open-label randomized study of eribulin mesylate versus capecitabine in patients with locally advanced or metastatic breast cancer previously treated with an anthracycline and a taxane. J Clin Oncol. 2015 Feb 20;33(6):594-601. DOI: 10.1200/JCO.2013.52.4892. Epub 2015 Jan 20.
66. Price TJ, Peeters M, Kim TW, et al. Panitumumab versus cetuximab in patients with chemotherapy-refractory wild-type KRAS exon 2 metastatic colorectal cancer (ASPECCT): a randomised, multicentre, open-label, noninferiority phase 3 study. Lancet Oncol. 2014 May; 15(6):569-79. DOI: 10.1016/S1470-2045(14)70118-4. Epub 2014 Apr 14.
67. De Bono JS, Oudard S, Ozguroglu M, et al. Prednisone plus cabazitaxel or mitoxantrone for metastatic castration-resistant prostate cancer progressing after docetaxel treatment: a randomised open-label trial. Lancet. 2010 Oct 2;376 (9747): 1147-54. DOI: 10.1016/S01406736(10)61389-X.
Об авторах
А. С. КолбинРоссия
д. м. н., профессор, заведующий кафедрой клинической фармакологии и доказательной медицины, ФГБОУ ВО ПСПбГМУ им. акад. И.П. Павлова Минздрава России, Санкт-Петербург; профессор кафедры фармакологии медицинского факультета Санкт-Петербургского государственного университета, Санкт-Петербург
И. А. Вилюм
Россия
Ассистент кафедры клинической фармакологии и доказательной медицины ФГБОУ ВО ПСПбГМУ им. акад. И.П. Павлова Минздрава России, Санкт-Петербург
М. А. Проскурин
Россия
ассистент кафедры математического моделирования энергетических систем, факультет прикладной математики-процессов управления, Санкт-Петербургского государственного университета, Санкт-Петербург
Ю. Е. Балыкина
Россия
к. ф-м. н., кафедра процессов управления, факультет прикладной математики, Санкт-Петербургский государственный университет, Санкт-Петербург
А. В. Павлыш
Россия
д. м. н., профессор, заведующий кафедрой фармакологии и фармации ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России, Санкт-Петербург; ст. н. с. лаборатории онкологической статистики ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, Санкт-Петербург
Рецензия
Для цитирования:
Колбин А.С., Вилюм И.А., Проскурин М.А., Балыкина Ю.Е., Павлыш А.В. Клинико-экономическая оценка применения комбинации атезолизумаб + наб-паклитаксел в терапии неоперабельного местнораспространённого или метастатического тройного негативного рака молочной железы. Качественная клиническая практика. 2020;(1):4-21. https://doi.org/10.37489/2588-0519-2020-1-4-21
For citation:
Kolbin A.S., Vilyum I.A., Proskurin M.A., Balikina Yu.E., Pavlysh A.V. Pharmacoeconomic analysis of atezolizumab plus nab-paclitaxel in the treatment of the advanced or metastatic triple-negative breast cancer. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2020;(1):4-21. (In Russ.) https://doi.org/10.37489/2588-0519-2020-1-4-21
















































