Перейти к:
Анализ возможности импортозамещения противоэпилептических препаратов в Российской Федерации
https://doi.org/10.37489/2588-0519-2024-2-116-123
EDN: OVPJHW
Аннотация
Актуальность. Эпилепсия — распространённое хроническое заболевание нервной системы, при котором достижение ремиссии возможно у большинства пациентов в случае рационального лечения. Доступность противоэпилептических лекарственных препаратов (ПЭП) для пациентов, страдающих эпилепсией, является важным условием их качественной и продолжительной жизни. Наличие собственного производства ПЭП в Российской Федерации (РФ) является гарантией доступности лекарственной помощи.
Цель. Оценка уровня импортозамещения ПЭП в РФ.
Методы. Оценка проведена на основании анализа государственного реестра лекарственных средств (ГРЛС), перечня жизненно необходимых и важнейших лекарственных препаратов (ЖНВЛП) за 2023 год, клинических рекомендаций Министерства здравоохранения РФ «Эпилепсия и эпилептический статус у взрослых и детей».
Результаты. В настоящее время в ГРЛС зарегистрировано 27 международных непатентованных наименований ПЭП, 101 торговое наименование в основном в виде пероральных лекарственных форм выпуска, 1355 номенклатурных позиций. Все ПЭП являются препаратами рецептурного отпуска. В целом, 70,6 % производителей ПЭП являются отечественными. По сравнению с 2020 годом, доля производителей из РФ увеличилась на 20 %. При этом, только 14,2 % производят субстанции непосредственно в РФ. Высокий 100 %-й уровень импортозамещения имеется только для противоэпилептических препаратов I поколения, а для препаратов III поколения составляет только 43 %. Импортозамещение в области субстанций противоэпилептических препаратов находится на существенно более низком уровне — 75 % — 47,5 % — 14 % для противоэпилептических препаратов I — II — III поколений соответственно.
Заключение. Необходимо повышение уровня импортозамещения современных ПЭП II–III поколений, обеспечивающих более высокий уровень эффективности и безопасности терапии эпилепсии.
Для цитирования:
Бочанова Е.Н., Гусев С.Д., Журавлев Д.А., Игнатюк А.В., Лунева Л.А., Чавырь В.С., Шнайдер Н.А. Анализ возможности импортозамещения противоэпилептических препаратов в Российской Федерации. Качественная клиническая практика. 2024;(2):117-124. https://doi.org/10.37489/2588-0519-2024-2-116-123. EDN: OVPJHW
For citation:
Bochanova E.N., Gusev S.D., Zhuravlev D.A., Ignatyuk A.V., Luneva L.A., Chavyr V.S., Shnayder N.A. Possibility analysis of antiepileptic drugs import substitution in the Russian Federation. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2024;(2):117-124. (In Russ.) https://doi.org/10.37489/2588-0519-2024-2-116-123. EDN: OVPJHW
Введение / Introduction
Эпилепсия — это хроническое заболевание нервной системы, одна из наиболее распространённых медико-социальных проблем здравоохранения. По данным Европейской комиссии по эпилепсии, этим заболеванием страдает около 50 млн человек, или 0,5–1 % населения мира; не менее одного припадка в течение жизни переносят 5 % населения; у 20–30 % людей, страдающих эпилепсией, заболевание является пожизненным. В России, по данным Министерства здравоохранения РФ, эпилепсия встречается с частотой от 1,1 до 8,9 случаев на 1 тыс. человек [1]. При этом эпилепсия — одно из немногих хронических заболеваний, при котором достижение ремиссии возможно в 60–75 % случаев рационального лечения [2]. Доступность ЛП для пациентов, страдающих эпилепсией, является важным условием их качественной и продолжительной жизни.
Экономические санкции против Российской Федерации (РФ) могут привести к сбоям поставок лекарственных препаратов (ЛП) в Россию. Несмотря на то, что санкции не распространяются на лекарства, доставку затруднят банковские и судоходные ограничения [3]. Поэтому наличие собственного производства ЛП в РФ является вопросом обеспечения национальной безопасности [4][5]. Курс на локализацию производства и импортозамещение критически важных лекарств был определён в программе «Фарма-2020» и затем продолжен в программе «Фарма-2030» [6]. Одним из ключевых ориентиров для работы по развитию производства ЛП является перечень стратегически значимых лекарственных средств (СЗЛС), утверждённый распоряжением правительства РФ [7]. Импортозамещение заключается не только в выпуске на территории РФ эффективных и безопасных аналогов иностранных препаратов, но и в наличии в России производства собственных субстанций для них.
Учитывая высокую социальную и клиническую значимость лекарственного обеспечения, изучение и анализ возможности импортозамещения противоэпилептических препаратов (ПЭП) в РФ является актуальным. Исходя из вышеизложенного, целью настоящего исследования была оценка уровня импортозамещения ПЭП в Российской Федерации.
Материалы и методы / Materials and methods
Проведён анализ Государственного реестра лекарственных средств (ГРЛС) [8], перечня жизненно необходимых и важнейших лекарственных препаратов (ЖНВЛП) за 2023 год [9], клинических рекомендаций Министерства здравоохранения РФ «Эпилепсия и эпилептический статус у взрослых и детей» [10].
Результаты / Results
В настоящее время в ГРЛС зарегистрировано 27 международных непатентованных наименований (МНН) ПЭП, 101 торговое наименование, 1355 номенклатурных позиций. Все ПЭП являются препаратами рецептурного отпуска.
В РФ зарегистрированы ПЭП в основном в виде пероральных лекарственных форм выпуска (рис. 1).
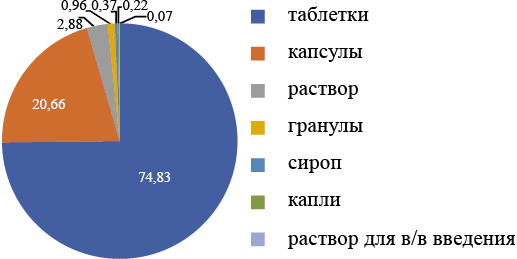
Рис. 1. Лекарственные формы противоэпилептических препаратов, зарегистрированные в РФ (%)
Fig. 1. Dosage forms of AEDs registered in the Russian Federation (%)
Последовательное выведение на рынок ПЭП, основанное на результатах фундаментальных и клинических исследований, условно разделило ПЭП на 3 поколения: первое (1912–1990 гг.), второе (1990–1999 гг.) и третье (с 2000 г. по настоящее время) [2, 11] (табл. 1). ПЭП третьего поколения имеют ряд преимуществ, включающих лучшую переносимость, меньшую выраженность побочных эффектов, меньшее количество лекарственных взаимодействий и улучшенный фармакокинетический профиль по сравнению с ПЭП первого и второго поколений [12].
Таблица 1
Структура ПЭП по поколениям
Table 1
AEDs structure by generation
I поколение | II поколение | III поколение |
Ацетазоламид | Габапентин | Бриварацетам |
Бензобарбитал | Зонисамид | Вигабатрин |
Бромизовал + Кальция глюконат + Кофеин + Папаверин + Фенобарбитал (Паглюферал) | Ламотриджин | Лакосамид |
Вальпроевая кислота | Леветирацетам | Перампанел |
Диазепам | Окскарбазепин | Руфинамид |
Карбамазепин | Прегабалин | Фенозановая кислота |
Клобазам | Примидон | Эсликарбазепин |
Клоназепам | Топирамат | |
Мидазолам | ||
Фенитоин | ||
Фенобарбитал | ||
Этосуксимид |
Обсуждение / Discussion
ПЭП I поколения. Все 12 МНН (100 %) производятся в РФ. Количество отечественных производителей: 2 (паглюферал, фенитоин), 3 (ацетазоламд, диазепам), 4 (бензобарбитал), 6 (вальпроевая кислота (ВК), 7 (фенобарбитал), 13 (карбамазепин), при производстве используются отечественные фармацевтические субстанции. Производство препаратов клобазам, клоназепам, мидазолам осуществляется только одним производителем на основании импортных фармацевтических субстанций. То есть, только 75 % ПЭП I поколения производится в РФ из отечественных фармацевтических субстанций (см. рис. 1).
Зарегистрировано в РФ также 8 ПЭП I поколения зарубежного производства (ацетазоламид, ВК, диазепам, карбамазепин, клобазам, клоназепам, мидазолам, этосуксимид), наибольшее количество производителей — 8 зарегистрировано для препаратов ВК.
ПЭП II поколения. Из 8 ПЭП II поколения в РФ производится 7 (87,5 %), при этом отечественные фармацевтические субстанции используются только для производства 3 препаратов (габапентин, окскарбазепин, прегабалин) — 37,5 % (см. рис. 1).
Зарегистрировано в РФ 7 ПЭП II поколения зарубежного производства, наибольшее количество производителей зарегистрировано для препаратов габапентин — 6, леветирацетам — 7.
ПЭП III поколения. Из 7 ПЭП III поколения производятся в РФ только 3 (43 %) — это препараты вигабатрина, лакосамида, фенозановой кислоты. Из отечественных фармацевтических субстанций производятся только препараты фенозановой кислоты. Таким образом, только 14 % ПЭП 3 поколения производится в РФ из отечественных фармацевтических субстанций (см. рис. 2).
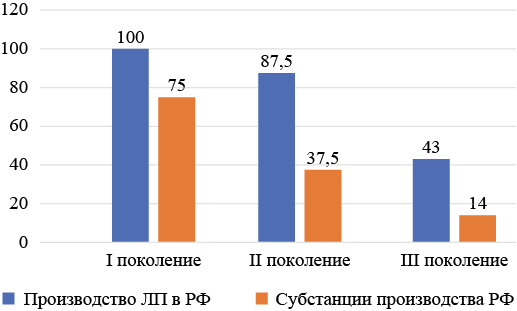
Рис. 2. Доля противоэпилептических препаратов производства РФ и противоэпилептических препаратов, производимых из фармацевтических субстанций российского производства
Fig. 2. Share of AEDs produced in the Russian Federation and AEDs produced from pharmaceutical substances produced in Russia
Такие ПЭП III поколения, как бриварацетам, перампанел, руфинамид, эсликарбазепин зарегистрированы в РФ только как препараты зарубежных производителей.
В целом, 70,6 % производителей ПЭП являются отечественными. При этом только 14,2 % производят субстанции непосредственно в РФ. К основным компаниям, имеющим собственное производство субстанций, относятся АО «Усолье-Сибирский химфармзавод», ООО «ФармМентал групп», ЗАО «Московская фармацевтическая фабрика», АО «Татхимфармпрепараты». Основным зарубежным производителем субстанций отечественных ПЭП является Индия (см. рис. 3).
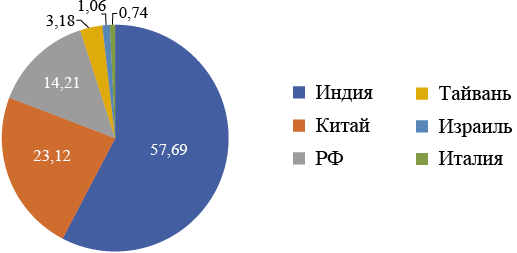
Рис. 3. Доля производителей субстанций отечественных противоэпилептических препаратов (%)
Fig. 3. Share of producers of domestic AED substances (%)
Анализ производителей показал, что по сравнению с 2020 годом [2] доля производителей из Российской Федерации увеличилась на 20 %, тогда как производители из стран Европы, в основном, существенно уменьшили либо прекратили производство на территории РФ (табл. 2).
Таблица 2
Рейтинг стран-производителей противоэпилептических препаратов
Table 2
Rating of countries producing AEDs
Страна-производитель | 2020 г. | 2023 г. |
РФ | 49,8 % | 70,6 % |
Индия | 10,8 % | 9,6 % |
Германия | 2,8 % | 5,8 % |
Польша | 3,6 % | 3,7 % |
Соединённое Королевство | 2,6 % | 1,6 % |
Италия | 1,2 % | 1,5 % |
Франция | 4,4 % | 1,3 % |
Бельгия | 4,2 % | 0,9 % |
Венгрия | 2,6 % | 0,8 % |
Хорватия | 1,8 % | 0,7 % |
Австрия | 0 % | 0,5 % |
Кипр | 1,2 % | 0,4 % |
Пуэрто-Рико | 0 % | 0,4 % |
Турция | 0 % | 0,4 % |
Япония | 0 % | 0,4 % |
США | 3,4 % | 0,4 % |
Португалия | 0 % | 0,3 % |
Северная Македония | 2,4 % | 0,3 % |
Беларусь | 0 % | 0,2 % |
Испания | 0 % | 0,1 % |
Румыния | 0 % | 0,1 % |
Израиль | 5,2 % | 0 % |
Исландия | 1,4 % | 0 % |
Словения | 1 % | 0 % |
Швейцария | 0,8 % | 0 % |
Чехия | 0,8 % | 0 % |
Анализ нормативных документов показал, что в клинические рекомендации по лечению эпилепсии входит 10 из 12 ПЭП I поколения (83,3 %), все 8 ПЭП II поколения (100 %), 5 из 7 ПЭП III поколения (71,4 %). В перечень ЖНВЛП включены 10 из 12 ПЭП I поколения (83,3 %), 4 ПЭП II поколения (50 %), 3 из 7 ПЭП III поколения (43 %) (см. рис. 4).
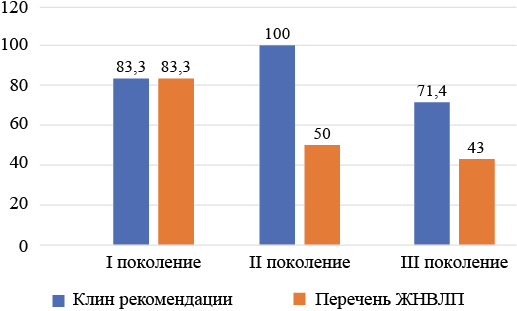
Рис. 4. Доля противоэпилептических препаратов, входящих в клинические рекомендации и перечень жизненно-необходимых и важнейших лекарственных препаратов
Fig. 4. Proportion of AEDs included in clinical recommendations and the list of vital and essential drugs
Перечень ЖНВЛП — это перечень лекарственных препаратов, утверждаемый Правительством Российской Федерации в целях государственного регулирования цен на лекарственные средства. При оказании медицинской помощи в рамках программы государственных гарантий (в т. ч. и по программе обязательного медицинского страхования) обеспечение граждан осуществляется лекарственными препаратами для медицинского применения, включёнными в перечень ЖНВЛП [13]. Закупить иные медикаменты можно, если клиническими рекомендациями или стандартами оказания медицинской помощи определена необходимость применения лекарственных препаратов, которые на текущий момент не включены в актуальный перечень ЖНВЛП. Назначение и применение лекарственных препаратов, не входящих в стандарты и перечень ЖНВЛП, допускается в случае наличия медицинских показаний, но только по решению врачебной комиссии (ВК), которое фиксируется в медицинских документах больного и журнале ВК. При этом необходимо отметить, что на такие ЛП не распространяется государственное регулирование цен. От общего количества ПЭП только 17 МНН (63 %) включены в перечень ЖНВЛП.
Заключение / Conclusion
Таким образом, анализ показал, что в РФ уровень импортозамещения ПЭП составляет, в целом, более 70 %. Но высокий 100 %-й уровень импортозамещения имеется только для ПЭП I поколения, а для современных ПЭП III поколения составляет только 43 %. Импортозамещение в области субстанций ПЭП находится на существенно более низком уровне — 75 % — 47,5 % — 14 % для ПЭП I–II — III поколений соответственно.
Особое внимание необходимо обратить на такие ПЭП III поколения, как бриварацетам, перампанел, руфинамид, эсликарбазепин, субстанции и готовые лекарственные препараты, которые не производятся в РФ. Препараты признаны превосходящими по безопасности и эффективности ранее известные ПЭП первого и второго поколений, а различия препаратов по механизму действия, фармакокинетическим свойствам, эффективности и профилю побочных эффектов обеспечивают возможность персонифицированного подхода к лечению пациента.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ | ADDITIONAL INFORMATION | |
Конфликт интересов Авторы заявляют об отсутствии конфликта интересов. | Conflict of interests The authors declare no conflict of interest. | |
Участие авторов Все авторы подтверждают соответствие своего авторства критериям ICMJE. Бочанова Е. Н. — формирование концепции работы, контроль написания материала, редактирование текста, критический пересмотр содержания, координация работы соавторов, утверждение финального варианта материала, Гусев С. Д. — редактирование текста, критический пересмотр содержания, утверждение финального варианта материала, Журавлев Д. А. — сбор и обработка материала, написание текста рукописи, работа с замечаниями, оформление финального варианта текста; Игнатюк А. В., Лунева Л. А., Чавырь В. С. — сбор и обработка материала, критический анализ содержания; Шнайдер Н. А. — редактирование текста рукописи, оформление финального варианта текста, утверждение финального варианта материала. | Authors’ participation All the authors confirm that they meet the International Committee of Medical Journal Editors criteria for authorship. Bochanova EN — formation of the concept of the work, control of the writing of the material, text editing, critical revision of the content, coordination of the work of co-authors, approval of the final version of the material; Gusev SD — text editing, critical revision of content, approval of the final version of the material, Zhuravlev DA — collection and processing of material, writing the text of the manuscript, working with comments, designing the final version of the text; Ignatyuk AV, Luneva LA, Chavyr VS — collection and processing of material, critical analysis of the content, Shnayder NA — editing the text of the manuscript, designing the final version of the text, approving the final version of the material. |
Список литературы
1. Резолюция круглого стола с участием экспертов в области лечения эпилепсии и руководителей министерств и комитетов здравоохранения (Ленинградской области, Иркутской области, Омской области, Самарской области, Архангельской области, Тюменской области и Хабаровского края) в рамках Всероссийской медико-социальной программы «Внимание – эпилепсия!». Эпилепсия и пароксизмальные состояния. 2017;9(4):103-104.
2. Романов А.С., Шарахова Е.Ф. Маркетинговые исследования национального рынка противоэпилептических препаратов. Journal of Siberian Medical Sciences. 2022;(4):48-60.
3. Сергей Тепляков. Поставщики предупредили о возможных сбоях поставок импортных лекарств.
4. Дзанаева А.В., Омельяновский В.В., Кагермазова С.А. Принципы импортозамещения лекарственных препаратов. Фармакоэкономика. Современная фармакоэкономика и фармакоэпидемиология. 2015;8(2):38-42.
5. Тельнова ЕА. Об уровнях, характеризующих систему доступности лекарственных препаратов. Бюллетень Национального научно-исследовательского института общественного здоровья имени Н.А. Семашко. 2016;(4):83-94.
6. Распоряжение Правительства РФ от 7 июня 2023 г. № 1495-р «О Стратегии развития фармацевтической промышленности РФ на период до 2030 г.»
7. Распоряжение Правительства РФ от 06.07.2010 № 1141-р (ред. от 01.08.2020) «Об утверждении перечня стратегически значимых лекарственных средств»
8. Государственный реестр лекарственных средств.
9. Распоряжение Правительства РФ от 12.10.2019 № 2406-р (ред. от 09.06.2023) «Об утверждении перечня жизненно необходимых и важнейших лекарственных препаратов, а также перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи»
10. Клинические рекомендации «Эпилепсия и эпилептический статус у взрослых и детей» (одобрены Минздравом России)
11. Липатова ЛВ. Клиническое значение фармакокинетического про- филя АЭП третьего поколения. Вестник Российской военно-меди- цинской академии. 2018;20(3S):143-144.
12. Тадтаева З.Г., Галустян А.Н., Громова О.А., Сардарян И.С. Антиэпилептические препараты третьего поколения: механизм действия, фармакокинетика, взаимодействие и применение в детском возрасте. Эпилепсия и пароксизмальные состояния. 2023;15(2):160-170.
13. Письмо Минздрава России от 20 марта 2023 г. № 31-2/И/2-2076 «О направлении разъяснений по оплате случаев оказания медицинской помощи с использованием отдельных лекарственных препаратов, не включенных в перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения, утвержденный распоряжением Правительства РФ от 12.10.2019 N 2406-р».
Об авторах
Е. Н. БочановаРоссия
Бочанова Елена Николаевна — д. м. н., доцент, зав. кафедрой микробиологии имени доцента Б. М. Зельмановича; доцент кафедры фармакологии и клинической фармакологии
Красноярск
С. Д. Гусев
Россия
Гусев Сергей Дмитриевич - к. м. н., доцент кафедры медицинской кибернетики и информатики
Красноярск
Д. А. Журавлев
Россия
Журавлев Дмитрий Александрович — старший преподаватель кафедры фармации с курсом ПО
Красноярск
А. В. Игнатюк
Россия
Игнатюк Анна Владимировна - старший преподаватель кафедры фармации с курсом ПО
Красноярск
Л. А. Лунева
Россия
Лунева Людмила Анатольевна - старший преподаватель кафедры фармации с курсом ПО
Красноярск
В. С. Чавырь
Россия
Чавырь Вера Сергеевна - старший преподаватель кафедры фармации с курсом ПО
Красноярск
Н. А. Шнайдер
Россия
Шнайдер Наталья Алексеевна - д. м. н., ведущий научный сотрудник; ведущий научный сотрудник
Красноярск
Санкт-Петербург
Рецензия
Для цитирования:
Бочанова Е.Н., Гусев С.Д., Журавлев Д.А., Игнатюк А.В., Лунева Л.А., Чавырь В.С., Шнайдер Н.А. Анализ возможности импортозамещения противоэпилептических препаратов в Российской Федерации. Качественная клиническая практика. 2024;(2):117-124. https://doi.org/10.37489/2588-0519-2024-2-116-123. EDN: OVPJHW
For citation:
Bochanova E.N., Gusev S.D., Zhuravlev D.A., Ignatyuk A.V., Luneva L.A., Chavyr V.S., Shnayder N.A. Possibility analysis of antiepileptic drugs import substitution in the Russian Federation. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2024;(2):117-124. (In Russ.) https://doi.org/10.37489/2588-0519-2024-2-116-123. EDN: OVPJHW

















































