Перейти к:
Терапевтический лекарственный мониторинг ванкомицина в реальной клинической практике лечения пациентов с глубоким нагноением после эндопротезирования тазобедренного сустава
https://doi.org/10.37489/2588-0519-2024-1-56-62
EDN: JEKFGW
Аннотация
Актуальность. Ванкомицин, как и другие гликопептидные антибиотики, по своему фармакокинетическому и фармакодинамическому профилю характеризуются как времязависимым, так и концентрационно-зависимым бактерицидным эффектом. Его оптимальное достижение обеспечивается за счёт поддержания концентрации препарата, превышающей в несколько раз минимальную подавляющую концентрацию (МПК). Превышение пиковых концентраций ванкомицина (> 20 мкг/мл) способствуют повышению риска развития нефротоксичности, а экстремально низкие (<9,9 мкг/мл) — селекции резистентных форм грамположительных микроорганизмов.
Целью исследования является оценка достижения целевого уровня концентрации ванкомицина в плазме крови пациентов с глубоким нагноением после эндопротезирования тазобедренного сустава на основании терапевтического лекарственного мониторинга.
Методы. В исследование были включены пациенты, получавшие инфузионную терапию ванкомицином в гнойном отделении травматологии и ортопедии Университетской клиники Приволжского исследовательского медицинского университета по поводу глубокого нагноения после эндопротезирования тазобедренного сустава в период с 01.03.2023 г. по 30.06.2023 г. Исследование проводилось без поправки на торговое название ванкомицина. Терапевтический лекарственный мониторинг (ТЛМ) проводился на третьи сутки после начала терапии (после 4-го введения). Взятие крови осуществлялось через 1 час после инфузии и за 1 час до последующей инфузии. Определение ванкомицина в плазме крови осуществлялось методом высокоэффективной жидкостной хроматографии с использованием хроматографа «LC20 Prominance» (Shimadzu, Japan) в обращённо-фазовом режиме с матричным фотодиодным детектором УФ и видимого спектров (SPD–M20A).
Результаты. В исследование было включено 14 пациентов, из них 6 мужчин и 8 женщин. Средний возраст пациентов составил 60,36±12,38 лет. Бактериальная флора была обнаружена у всех включённых в исследование пациентов. Высевались резистентные грамположительные микроорганизмы: St. aureus (MRSA) — 5, у 9 пациентов — коагулазонегативные стафилококки (St. epidermidis (MRSE) — 7, St. simulans — 2). Терапевтические концентрации как начальные, так и остаточные были достигнуты в 28,57% случаев. В 71,43% случаев остаточные концентрации имели значения <10 мкг/мл, что соответствовало экстремально низким значениям, недостаточным для проявления клинической эффекта, связанного с эрадикацией возбудителя при МПК = 1 мкг/мл. При этом начальные концентрации ванкомицина определялись как экстремально низкие в 14,29% случаев, а в 42,86% — как превышающие терапевтический диапазон. Концентрации ванкомицина в терапевтическом диапазоне от 10 до 20 мкг/мл через 1 час после инфузии (начальные концентрации) были определены у 42,86% пациентов.
Заключение. Полученные результаты ТЛМ ванкомицина у пациентов с глубоким нагноением после эндопротезирования тазобедренного сустава показывают широкий разброс концентраций. При этом отмечена высокая доля остаточных концентраций на уровне экстремально низких (<9,9 мкг/мл), что согласуется с результатами других исследований и подтверждает необходимость проведения ТЛМ у каждого пациента, получающего терапию ванкомицином.
Ключевые слова
Для цитирования:
Жукова О.В., Комаров Р.Н., Митрофанов В.Н., Воробьева О.А. Терапевтический лекарственный мониторинг ванкомицина в реальной клинической практике лечения пациентов с глубоким нагноением после эндопротезирования тазобедренного сустава. Качественная клиническая практика. 2024;(1):56-62. https://doi.org/10.37489/2588-0519-2024-1-56-62. EDN: JEKFGW
For citation:
Zhukova O.V., Komarov R.N., Mitrofanov V.N., Vorobeva O.A. Therapeutic drug monitoring of vancomycin in the real-world clinical practice of treating patients with deep suppuration after hip arthroplasty. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2024;(1):56-62. (In Russ.) https://doi.org/10.37489/2588-0519-2024-1-56-62. EDN: JEKFGW
Введение / Introduction
Ванкомицин был официально зарегистрирован в 1958 году FDA после проведения нескольких пилотных клинических исследований. Данные, полученные в ходе этих исследований, подтвердили эффективность ванкомицина при лечении инфекций, ассоциированных с Staphylococcus spp. Клиническая эффективность ванкомицина была подтверждена последующими исследованиями, однако было отмечено значительное количество нежелательных лекарственных реакций (НЛР), в т. ч. у больных с нарушением функции почек. Высокая «токсичность» ванкомицина привела к тому, что данный препарат был внесён в список резервных препаратов.
Целью терапевтического лекарственного мониторинга (ТЛМ) ванкомицина является получение информации о его концентрации в плазме крови конкретного пациента и принятие на основании этих данных решения о необходимости изменения режима дозирования для этого конкретного пациента. Коррекция может осуществляться путём увеличения/уменьшения интервалов между введениями либо путём увеличения/уменьшения разовой дозы препарата. Поэтому «оптимизация антибиотикотерапии» подразумевает:
- поддержание адекватного уровня системной экспозиции на протяжении всего периода терапии;
- обеспечение эффективной элиминации инфекционного возбудителя;
- минимизация риска НЛР (в случае ванкомицина — нефротоксичности и, в меньшей степени, ототоксичности);
- предупреждение развития приобретённой антибиотикорезистентности.
Ванкомицин, как и другие гликопептидные антибиотики, по своему фармакокинетическому и фармакодинамическому профилю характеризуются как времязависимым, так и концентрационно-зависимым бактерицидным эффектом. Его оптимальное достижение обеспечивается за счёт поддержания концентрации препарата, превышающей в несколько раз минимальную подавляющую концентрацию (МПК), в силу чего наиболее распространённой стратегией ТЛМ для оценки системной экспозиции по-прежнему является определение остаточной (минимальной) концентрации (Сtrough) препарата непосредственно перед введением следующей дозы после 4-х инфузий.
Различные рекомендации по ТЛМ ванкомицина содержат указание о необходимости поддержания в крови ванкомицина на уровне 10–20 мг/л, в зависимости от очага инфекции и чувствительности микроорганизма. При выделении возбудителя со значением МПК ≥1 мг/л этот диапазон рекомендуется сузить до 15–20 мг/л для воздействия на большее число чувствительных микроорганизмов либо пересмотреть тактику антибиотикотерапии и сменить препарат.
Американское общество инфекционных заболеваний (англ. Infectious Diseases Society of America), Общество фармацевтов, работающих в области инфекционных заболеваний (англ. Society of Infectious Diseases Pharmacists) и Американское общество фармацевтов системы здравоохранения (англ. American Society of Health-System Pharmacists) в журнале “Clinical Infectious Disease” опубликовали консенсусные рекомендации по ТЛМ уровня ванкомицина в сыворотке крови при лечении инфекций, вызванных Staphylococcus aureus, у взрослых пациентов [1]. Пересмотр данных рекомендаций от 2020 г. рекомендует соотношение ПФК24/MПК на уровне 400–600 мг* час/л (при условии, что МПК составляет 1 мг/л) для достижения клинической эффективности и обеспечения безопасности для пациентов, проходящих лечение серьёзных метициллин-резистентных инфекций, вызванных Staphylococcus aureus [2]. В 2020 г. было также обновлено Руководство по терапевтическому лекарственному мониторингу ванкомицина на основе фактических данных, подготовленное отделом терапевтического мониторинга лекарственных средств Китайского фармакологического общества [3]. Настоятельной рекомендацией является поддержание концентрации ванкомицина на уровне 10–15 мг/л у взрослых пациентов. Также авторы рекомендуют поддерживать стабильную концентрацию в дозе 10–20 мг/л у взрослых пациентов с тяжёлыми MRSA — инфекциями. К серьёзным MRSA инфекциям относят менингит, остеомиелит, бактериемия, инфекционный эндокардит и пневмония, связанная с оказанием медицинской помощи. Следует отметить, что для MRSA штаммов с МПК ванкомицина >1 мг/л целесообразно рассмотреть альтернативный препарат в соответствии с клиническим заключением.
В 2022 г. было выпущено Руководство по клинической практике терапевтического лекарственного мониторинга ванкомицина Японского общества химиотерапии и Японского общества терапевтического мониторинга лекарственных средств [4].
Всё это подтверждает значительный интерес к процедуре ТЛМ ванкомицина и её практическую значимость для клинической практики.
На сегодняшний день преимущества процедуры ТЛМ подтверждаются многими работами и исследованиями. Так, ТЛМ ванкомицина был посвящён обзор, в который были включены рандомизированные контролируемые исследования и наблюдательные исследования, в которых сравнивались клинические исходы в группах с ТЛМ и без ТЛМ. Показатель клинической эффективности в группе пациентов, у которых проводилась процедура ТЛМ, оказался достоверно выше по сравнению с группой пациентов, у которых дозирование ванкомицина проводилось без процедуры ТЛМ, ОШ = 2,62, 95 % ДИ 1,34–5,11; p = 0,005 [5].
Превышение пиковых концентраций ванкомицина (> 20 мкг/мл) способствует повышению риска развития нефротоксичности, а экстремально низкие (<9,9 мкг/мл) — селекции резистентных форм грамположительных микроорганизмов [6][7].
Целью / Objective данного исследования является оценка достижения целевого уровня концентрации ванкомицина в плазме крови пациентов с глубоким нагноением после эндопротезирования тазобедренного сустава на основании терапевтического лекарственного мониторинга.
Материалы и методы / Materials and methods
В исследование были включены пациенты, получавшие инфузионную терапию ванкомицином в гнойном отделении травматологии и ортопедии Университетской клиники Приволжского исследовательского медицинского университета по поводу глубокого нагноения после эндопротезирования тазобедренного сустава в период с 01.03.2023 г. по 30.06.2023 г. Исследование проводилось без поправки на торговое название ванкомицина.
Поскольку исследование носило наблюдательный характер, то был проведён анализ адекватности режима дозирования и соответствие его рекомендованному в зарегистрированных инструкциях по применению лекарственного препарата для исключения этого фактора как причины нецелевых значений концентраций ванкомицина в плазме крови пациентов.
ТЛМ проводился пациентам, получавшим ванкомицин системно, на третьи сутки после начала терапии (после 4-го введения).
Взятие крови осуществлялось через 1 час после инфузии и за 1 час до последующей инфузии в пробирку с активатором свёртывания. Определение ванкомицина в плазме крови после её предварительной депротеинизации осуществлялось методом высокоэффективной жидкостной хроматографии с использованием хроматографа «LC-20 Prominance» (Shimadzu, Japan) в обращённо-фазовом режиме с матричным фотодиодным детектором УФ и видимого спектра (SPD–M20A). Хроматографическое разделение компонентов пробы выполнялось на колонке XChroma HPLC Column C18-Low pH, 5мкм, 120Å, 4,6·250 мм; подвижная фаза: ацетатный буфер (20 мМ аммония ацетат, рН = 4,15) — метанол в соотношении 78:22 (об/об); скорость потока 1 мл/мин; температура 40°С; длина волны детектирования — 240 нм. Предел детектирования ванкомицина в плазме — 0,4 мкг/мл.
Значения концентраций ванкомицина оценивали следующим образом: <10 мкг/мл — экстремально низкие концентрации; 10–20 мкг/мл — эффективные концентрации; >20 мкг/мл — превышение терапевтических концентраций [2].
Результаты и обсуждение / Results and discussion
В исследование было включено 14 пациентов, из них 6 мужчин и 8 женщин. Средний возраст пациентов составил 60,36±12,38 лет.
Бактериальная флора была обнаружена у всех включённых в исследование пациентов. Высевались резистентные грамположительные микроорганизмы: St. aureus (MRSA) — 5, у 9 пациентов — коагулазонегативные стафилококки (St. epidermidis (MRSE) — 7, St. simulans — 2). МПК ванкомицина составила 1 мкг/мл у 13 пациентов. У 1 пациента МПК составила 2 мкг/мл (St. epidermidis).
При назначении ванкомицина использовался стандартный режим дозирования, описанный в инструкции по применению. У пациентов, включённых в исследование, ванкомицин назначался по 1 г 2 раза в сутки (1-часовые инфузии).
Проведённый анализ историй болезни показал, что все пациенты имели нормальные показатели креатинина (мужчины — 103,28±20,50 мкмоль/л
(n = 6); женщины — 88,18±9,59 мкмоль/л (n = 8)), что в свою очередь является основанием для использования стандартного режима дозирования без корректировки дозировки ванкомицина. У всех пациентов использовался стандартный режим дозирования ванкомицина по 1 грамму 2 раза в сутки в виде 1-часовой инфузии.
Значения начальных концентраций ванкомицина (через 1 час после инфузии) варьировались в диапазоне от 5,12 до 32,20 мкг/мл (18,58±6,71). Значения остаточных концентраций ванкомицина варьировались в диапазоне от 1,52 до 19,30 мкг/мл (6,67±5,11) (табл. 1).
Таблица 1
Концентрация ванкомицина в плазме крови пациентов, мкг/мл (результаты терапевтического лекарственного мониторинга)
Table 1
Patient`s plasma vancomycin concentrations, µg/ml (results of therapeutic drug monitoring)
Пациент | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
через 1 час | 22,70 | 32,20 | 19,88 | 13,72 | 15,76 | 23,20 | 20,72 | 9,00 | 20,30 | 18,80 | 5,12 | 19,86 | 17,42 | 21,44 |
через 11 часов (за 1 час до инфузии) | 10,50 | 19,30 | 2,03 | 3,08 | 6,08 | 5,24 | 10,64 | 2,48 | 5,04 | 13,84 | 1,52 | 4,10 | 5,59 | 3,96 |
Таким образом, проведённый анализ соответствия начальных и остаточных концентраций ванкомицина по результатам ТЛМ показал, что терапевтические концентрации как начальные, так и остаточные были достигнуты в 28,57 % случаев. В 71,43 % случаев остаточные концентрации имели значения <10 мкг/мл, что соответствовало экстремально низким значениям, не достаточным для проявления клинической эффекта, связанного с эрадикацией возбудителя при МПК = 1 мкг/мл. При этом начальные концентрации ванкомицина определялись как экстремально низкие в 14,29 % случаев, а в 42,86 % — как превышающие терапевтический диапазон. Концентрации ванкомицина в терапевтическом диапазоне от 10 до 20 мкг/мл через 1 час после инфузии (начальные концентрации) были определены у 42,86 % пациентов (см. рисунок).
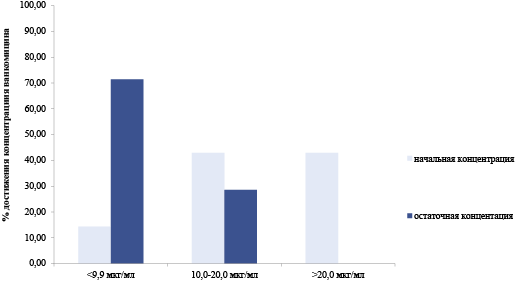
Рис. Начальные и остаточные концентрации ванкомицина (результаты терапевтического лекарственного мониторинга)
Fig. Initial and residual concentrations of vancomycin
(results of therapeutic drug monitoring)
Заключение / Conclusion
Полученные результаты ТЛМ ванкомицина у пациентов с глубоким нагноением после эндопротезирования тазобедренного сустава показывают широкий разброс концентраций. При этом отмечена высокая доля остаточных концентраций на уровне экстремально низких (<9,9 мкг/мл), что согласуется с результатами других исследований и подтверждает необходимость проведения ТЛМ у каждого пациента, получающего терапию ванкомицином. Так, в ходе исследование остаточных концентраций ванкомицина у 471 пациента, получавших инфузии ванкомицина в отделении гнойной хирургии РНИИТО им. Р. Р. Вредена после ортопедических операций в период с 01.01.2014 г. по 31.05.2016 г., было установлено, что целевые значения на третьи сутки введения ванкомицина были достигнуты лишь у 12,1 % пациентов [8].
Так, с января 2014 г. по октябрь 2016 г. в Катаре было проведено ретроспективное исследование результатов ТЛМ ванкомицина у взрослых пациентов, (n = 99). Наиболее частыми инфекциями были сепсис/септический шок (17,3 %, n = 35), инфекции кожи и мягких тканей (15,8 %, n = 32) и инфекции нижних дыхательных путей (15,3 %, n = 31). Согласно интерпретации клиницистов, большинство концентраций (51 %) были субтерапевтическими, тогда как остальные находились в пределах терапевтического окна (13,5 %), либо сверхтерапевтическими (13 %) [9].
Полученные результаты подтверждают необходимость рутинного проведения ТЛМ ванкомицина с одной стороны для достижения клинического эффекта, связанного с эрадикацией возбудителя, а с другой — для предотвращения высоких концентраций, сопряжённых с проявлением нефротоксичности. В исследовании [10] оценивали результаты внедрения ТЛМ ванкомицина. Исследование проводилось на базе двух многопрофильных больниц Латвии, в одной из которых был реализован и применялся локальный протокол ТЛМ, а в другой — ванкомицин назначался в стандартных режимах дозирования. Данные были собраны за 4 года (2016–2020 гг.) в стационаре без локального протокола ТЛМ и за 2 года (2018–2020 гг.) в стационаре с локальным протоколом ТЛМ, начиная с периода его внедрения. Данные о больных, включённых в исследование, были проанализированы с учётом пола, возраста, массы тела и функции почек. В стационаре с протоколом ТЛМ по сравнению с стационаром без протокола ТЛМ выявлены более успешные результаты адекватной корректировки терапии (55,56 против 35,29 %).
В исследовании [11] описывается опыт ТЛМ для контроля безопасности назначения ванкомицина у пациентов с сепсисом в условиях реанимационных отделений. В исследовании проведён ретроспективный анализ 4 клинических случаев пациентов с сепсисом, находившихся в реанимационных отделениях ГБУЗ «ГКБ им. И. В. Давыдовского» в 2021 г., которым был назначен ванкомицин. На примере 4 клинических случаев пациентов с сепсисом показано, что при назначении ванкомицина в дозе, адекватной для конкретного случая, концентрация препарата в плазме крови может выходить за пределы терапевтического диапазона. В одном случае при развитии острого повреждения почек у пациента на фоне сепсиса проведение ТЛМ концентрации ванкомицина позволило предотвратить прогрессирование нарушений функции почек у пациента, в 3 случаях — проконтролировать достижение терапевтической концентрации препарата либо провести своевременную коррекцию дозы препарата для её достижения. Своевременная коррекция дозы ванкомицина путём проведения ТЛМ концентрации препарата в плазме крови позволяет достигать высокого антимикробного эффекта у пациентов с сепсисом, минимизировать нефротоксическое действие препарата.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ | ADDITIONAL INFORMATION | |
Конфликт интересов Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье. | Conflict of interests The authors declare no conflict of interest requiring disclosure in this article. | |
Участие авторов Все авторы подтверждают соответствие своего авторства критериям ICMJE. Жукова О. В. — концепция и дизайн исследования, написание текста; Комаров Р. Н., Воробьева О. А. — сбор, анализ и интерпретация результатов работы; Митрофанов В. Н. — сбор, анализ и интерпретация результатов работы, редактирование текста, утверждение окончательного варианта статьи для публикации. | Authors’ participation All the authors confirm that they meet the International Committee of Medical Journal Editors criteria for authorship. Zhukova OV — research concept and design, text writing; Komarov RN, Vorobyeva OA — collection, analysis and interpretation of work results; Mitrofanov VN — collection, analysis and interpretation of work results, text editing, approval of the final version of the article for publication. | |
Финансирование Работа выполнялась без спонсорской поддержки. | Financing The work was carried out without sponsorship. |
Список литературы
1. Rybak MJ, Lomaestro BM, Rotschafer JC, et al. Vancomycin therapeutic guidelines: a summary of consensus recommendations from the infectious diseases Society of America, the American Society of Health-System Pharmacists, and the Society of Infectious Diseases Pharmacists. Clin Infect Dis. 2009 Aug 1;49(3):325-7. doi: 10.1086/600877.
2. Rybak MJ, Le J, Lodise TP, et al. Therapeutic Monitoring of Vancomycin for Serious Methicillin-Resistant Staphylococcus Aureus Infections: A Revised Consensus Guideline and Review by the American Society of Health-System Pharmacists, the Infectious Diseases Society of America, the Pediatric Infectious Diseases Society, and the Society of Infectious Diseases Pharmacists. Clin Infect Dis. 2020;71(6):1361-4. doi: 10.1093/cid/ciaa303.
3. He N, Su S, Ye Z, et al. Evidence-based Guideline for Therapeutic Drug Monitoring of Vancomycin: 2020 Update by the Division of Therapeutic Drug Monitoring, Chinese Pharmacological Society. Clin Infect Dis. 2020 Dec 23;71(Suppl 4):S363-S71. doi: 10.1093/cid/ciaa1536.
4. Matsumoto K, Oda K, Shoji K, et al. Clinical Practice Guidelines for Therapeutic Drug Monitoring of Vancomycin in the Framework of Model-Informed Precision Dosing: A Consensus Review by the Japanese Society of Chemotherapy and the Japanese Society of Therapeutic Drug Monitoring. Pharmaceutics. 2022 Feb 23;14(3):489. doi: 10.3390/pharmaceutics14030489.
5. Ye ZK, Tang HL, Zhai SD. Benefits of therapeutic drug monitoring of vancomycin: a systematic review and meta-analysis. PLoS One. 2013 Oct 18;8(10):e77169. doi: 10.1371/journal.pone.0077169.
6. Elbarbry F. Vancomycin Dosing and Monitoring: Critical Evaluation of the Current Practice. Eur J Drug Metab Pharmacokinet. 2018 Jun;43(3):259268. doi: 10.1007/s13318-017-0456-4.
7. Туфанова О.С., Касимова А.Р., Божкова С.А. Оценка эффективности и безопасности фармакотерапии ванкомицином у пациентов с ортопедической инфекцией с помощью методики терапевтического лекарственного мониторинга. Безопасность и риск фармакотерапии. 2022;10(2):128-38. doi: 10.30895/2312-7821-2022-10-2-128-138.
8. Борисов А.М., Галанкин Т.Л., Божкова С.А., и др. Терапевтический лекарственный мониторинг ванкомицина у пациентов с инфекционными осложнениями в клинике травматологии и ортопедии: анализ клинической практики. Клиническая микробиология и антимикробная химиотерапия. 2020;22(1):60-66. doi:10.36488/cmac.2020.1.6066.
9. Al Sulaiti FK, Nader A, El Mekaty E, et al. Vancomycin Therapeutic Drug Monitoring Service Quality Indices and Clinical Effectiveness Outcomes: A Retrospective Cohort and Clinical Audit. J Am Coll Clin Pharm. 2020;3(4):778-85. doi:10.1002/jac5.1223.
10. Mauliņa I, Darbiniece K, Miķelsone-Jansone L, et al. Experience of Vancomycin Therapeutic Drug Monitoring in Two Multidisciplinary Hospitals in Latvia. Medicina (Kaunas). 2022 Mar 2;58(3):370. doi: 10.3390/medicina58030370.
11. Прокофьев А.Б., Белков С.А., Казаков Р.Е., и др. Опыт использования терапевтического лекарственного мониторинга для контроля безопасности назначения ванкомицина у пациентов с сепсисом в условиях реанимационных отделений. Безопасность и риск фармакотерапии. 2022;10(2):139-50. doi: 10.30895/2312-7821-2022-10-2-139-150.
Об авторах
О. В. ЖуковаРоссия
Жукова Ольга Вячеславовна — д. фарм. н., доцент, зав. кафедрой фармацевтической химии и фармакогнозии фармацевтического факультета.
Нижний Новгород
Р. Н. Комаров
Россия
Комаров Роман Николаевич — к. м. н., врач-травматолог-ортопед.
Нижний Новгород
В. Н. Митрофанов
Россия
Митрофанов Вячеслав Николаевич — к. м. н., зав. отделением гнойной хирургии (остеологии).
Нижний Новгород
О. А. Воробьева
Россия
Воробьева Ольга Александровна — к. фарм. н., доцент кафедры фармацевтической химии и фармакогнозии.
Нижний Новгород
Рецензия
Для цитирования:
Жукова О.В., Комаров Р.Н., Митрофанов В.Н., Воробьева О.А. Терапевтический лекарственный мониторинг ванкомицина в реальной клинической практике лечения пациентов с глубоким нагноением после эндопротезирования тазобедренного сустава. Качественная клиническая практика. 2024;(1):56-62. https://doi.org/10.37489/2588-0519-2024-1-56-62. EDN: JEKFGW
For citation:
Zhukova O.V., Komarov R.N., Mitrofanov V.N., Vorobeva O.A. Therapeutic drug monitoring of vancomycin in the real-world clinical practice of treating patients with deep suppuration after hip arthroplasty. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2024;(1):56-62. (In Russ.) https://doi.org/10.37489/2588-0519-2024-1-56-62. EDN: JEKFGW

















































