Перейти к:
Лекарственно-индуцированное внутримозговое кровоизлияние
https://doi.org/10.37489/2588-0519-2022-2-55-68
Аннотация
Внутримозговое кровоизлияние (ВМК), являющееся одной из форм геморрагического инсульта, представляет собой чрезвычайно серьёзное заболевание. Данная патология характеризуется крайне высокими уровнями инвалидизации и смертности. Несмотря на совершенствование терапии тех заболеваний, которые могут приводить к ВМК, его частота в настоящее время увеличивается, что в значительной степени обусловлено применением лекарственных средств (ЛС), в таком случае применяется термин «лекарственно-индуцированное внутримозговое кровоизлияние» (ЛИ ВМК). Одной из главных причин ЛИ ВМК является увеличение частоты назначения антикоагулянтной терапии для профилактики ишемического инсульта при фибрилляции предсердий, а также двойной антитромботической терапии. Кроме антикоагулянтов, к развитию данной патологии могут приводить тромболитические препараты. Согласно литературным данным, увеличение риска развития ВМК также ассоциировано с терапией антидепрессантами из группы селективных ингибиторов обратного захвата серотонина, а также статинов в высоких дозировках. Факторами риска данной нежелательной реакции являются возраст, курение, артериальная гипертензия и тромбоцитопения. Лечение ЛИ ВМК является чрезвычайно сложной задачей и включает отмену препарата-индуктора, антигипертензивную терапию, коррекции внутричерепной гипертензии, а также, в ряде случаев, введение антидотов. Основным методом профилактики является применение антитромбоцитарных препаратов и других ЛС, применение которых ассоциировано с повышенным риском развития ЛИ ВМК, в строгом соответствии с современными протоколами и рекомендациями.
Ключевые слова
Для цитирования:
Листратов А.И., Остроумова Т.М., Кочетков А.И., Остроумова О.Д. Лекарственно-индуцированное внутримозговое кровоизлияние. Качественная клиническая практика. 2022;(2):55-68. https://doi.org/10.37489/2588-0519-2022-2-55-68
For citation:
Listratov A.I., Ostroumova T.M., Kochetkov A.I., Ostroumova O.D. Drug-induced intracerebral hemorrhage. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2022;(2):55-68. (In Russ.) https://doi.org/10.37489/2588-0519-2022-2-55-68
Введение / Introduction
Геморрагический инсульт (ГИ) — полиэтиологическое заболевание, включающее все формы нетравматического внутричерепного кровоизлияния [1]. Внутричерепные кровоизлияния являются второй по распространённости причиной инсульта и представляют собой чрезвычайно серьёзное заболевание. Смертность от ГИ является очень высокой, достигая 40 % в течение месяца и 54 % в течение года. По сравнению с ишемическим инсультом, ГИ характеризуется большей смертностью и является более инвалидизирующим [2], поскольку лишь небольшая часть выживших, от 13 до 39 %, могут достичь долговременной реабилитации [3]. Учитывая огромную клиническую значимость ГИ, необходимо изучать те факторы, которые могут привести к данному тяжёлому заболеванию. В настоящее время растёт частота ГИ, ассоциированных с назначением определённых лекарственных средств (ЛС) [3]. В наибольшей степени рост частоты ГИ обусловлен увеличением числа пациентов, принимающих антикоагулянтную терапию для профилактики ишемического инсульта при фибрилляции предсердий (ФП) [3].
ГИ подразделяют на внутримозговое кровоизлияние (ВМК) и субарахноидальное кровоизлияние (САК). ВМК представляет собой кровотечение в паренхиму головного мозга, САК — кровотечение в субарахноидальное пространство [4]. По данным исследования глобального бремени болезней [5], частота ВМК и САК в структуре всех инсультов на 2019 г. составляла 27,9 % и 9,7 % соответственно. Необходимо отметить, что в научной литературе наибольшее число публикаций посвящены риску развития ВМК на фоне применения различных ЛС, в таком случае применяется термин «лекарственно-индуцированное (ЛИ) ВМК» [6].
Группы препаратов и отдельные ЛС, применение которых ассоциировано с развитием ЛИ ВМК, суммированы в таблице 1 [6–19].
Таблица 1
ЛС, применение которых ассоциировано с развитием ЛИ ВМК [6–19]
Table 1
Medications whose use is associated with the development of drug-induced intracerebral hemorrhage [6–19]
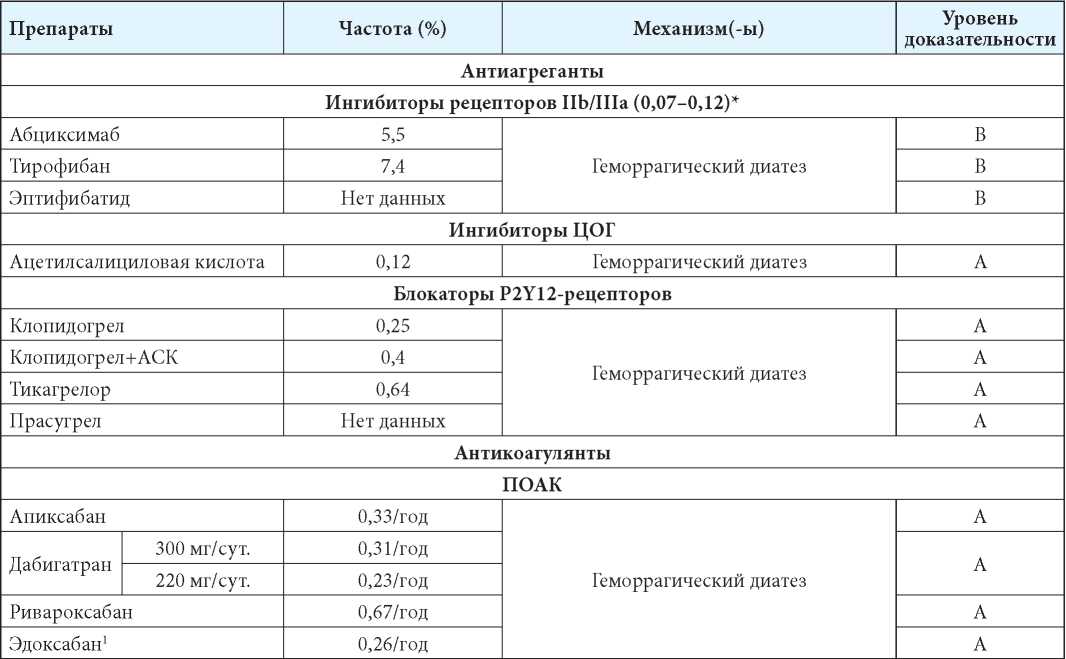
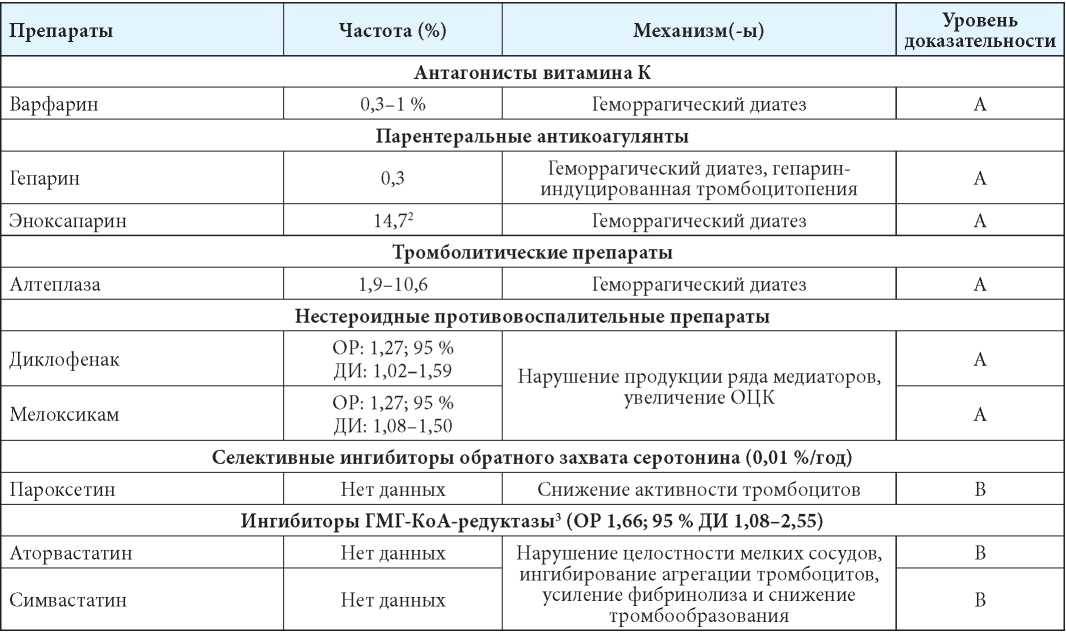
Примечания: АСК — ацетилсалициловая кислота; ГМГ-КоА-редуктаза — гидроксиметилглютарил-кофермент А редуктаза; ОЦК — объём циркулирующей крови; ПОАК — прямые оральные антикоагулянты; ЦОГ — циклооксигеназа; 1 — по состоянию на начало 2022 г. в РФ не зарегистрирован, ожидается регистрация; 2 — данные о пациентах с опухолями головного мозга; 3 — при терапии в высоких дозировках. Уровень доказательности [6]: А — данные одного или нескольких рандомизированных контролируемых клинических исследований; уровень В — данные проспективных наблюдательных исследований, когортных исследований, исследований по типу «случай-контроль», метаанализов и (или) постмаркетинговых исследований; уровень С — данные одного или нескольких опубликованных отчётов о случаях или серии случаев.
Notes: ASA — acetylsalicylic acid; HMG-CoA-reductase — hydroxymethylglutaryl-coenzyme A reductase; CBV — circulating blood volume; DOAC — direct oral anticoagulants; COX — cyclooxygenase; 1 — as of the beginning of 2022 in the Russian Federation is not registered, registration is expected; 2 — data on patients with brain tumors; 3 — with therapy in high dosages. Level of evidence [6]: A — data from one or more randomized controlled clinical trials; B — data from prospective observational studies, cohort studies, case-control studies, meta-analyses and (or) post-marketing studies; lC — data from one or more published case reports or a series of cases.
Эпидемиология / Epidemiology
Геморрагический инсульт составляет 10–15 % от всех видов нарушения мозгового кровообращения. Только в Российской Федерации каждый год диагностируют ВМК у 43 000 человек. Также в литературе существуют данные относительно распространённости ЛИ ВМК. ЛС являются причиной от 14 до 27 % случаев внутричерепных кровоизлияний [20]. Кроме того, частота ЛИ ВМК может увеличиваться с течением времени.
Вероятно, самыми значимыми препаратами — индукторами ЛИ ВМК являются антикоагулянты. В последнее десятилетие 20-го века произошло 5-кратное увеличение частоты внутримозговых кровоизлияний, связанных с применением антикоагулянтной терапии, что вызвано увеличением количества назначений данных препаратов при ФП [21]. Антикоагулянтная терапия является причиной около 15 % всех случаев ВМК. В отличие от ассоциированного с артериальной гипертензией (АГ) внутримозгового кровоизлияния, при ВМК на фоне применения антикоагулянтов чаще и быстрее происходит увеличение объёма гематомы [22], также для ВМК, ассоциированного с применением антикоагулянтов, характерна более высокая смертность [23].
На фоне длительной терапии варфарином даже при хорошем контроле международного нормализованного отношения (МНО) частота больших кровотечений достигает 1,5–5,2 % в год, а уровень смертности от кровотечений — 13 % [24]. ВМК является одной из самых тяжёлых нежелательных реакций (НР) варфарина и составляет 8,7 % от больших кровотечений, при этом смертность достигает 46–55 % [25]. Показатели смертности являются такими высокими даже несмотря на применение антидотов [26]. Однако с появлением прямых оральных антикоагулянтов (ПОАК) антикоагулянтная терапия стала более безопасной. Существует много исследований, в которых сравнивали риск кровотечения на фоне применения варфарина и ПОАК у пациентов с ФП и венозными тромбоэмболиями (ВТЭ). Так, согласно метаанализу, использование ПОАК ассоциировано со значимым снижением риска больших кровотечений, смертельных и внутричерепных кровоизлияний [27]. Данные клинических исследований также свидетельствуют о снижении частоты больших кровотечений на фоне применения ПОАК (до 2–4 %), частота ВМК составляет 0,1–0,5 % в год [28–30].
Однако необходимо отметить, что, по данным регистровых исследований, риски внутричерепных кровоизлияний на фоне антитромботической терапии (как антиагрегантной, так и антикоагулянтной) выше таковых, приведённых в рандомизированных клинических исследованиях (РКИ) [31]. По данным регистра, более чем у 700 тыс. пациентов, принимавших данную терапию, частота ВМК составила 0,3 на 100 пациенто-лет, в то время как среди лиц без данной терапии этот показатель составил 0,076. Все изучавшиеся режимы антитромботической терапии были связаны с увеличением риска внутричерепных кровоизлияний, исключая монотерапию дабигатраном и комбинацией дабигатран-аспирин. Наиболее часто данная НР возникала на фоне комбинированной терапии ацетилсалициловой кислотой (АСК) — клопидогрелом-дипиридамолом, варфарином-АСК-клопидогрелом, ривароксабаном-АСК и варфарином-АСК [31].
ВМК является той НР, которая вызывает больше всего опасений при применении тканевых активаторов плазминогена (англ.: tissue plasminogen activator, t-PA). ВМК встречается примерно у 6 % пациентов, получавших тромболитическую терапию [32]. Согласно литературным данным, при лечении данными ЛС 100 пациентов у одного больного данная терапия приведёт к тяжёлой инвалидности или смерти, ассоциированными с ВМК [33]. Сообщалось об ассоциации ВМК с применением антагонистов рецепторов гликопротеина IIb/IIIa, особенно в комбинации с гепарином [34]. Согласно РКИ, применение абциксимаба было ассоциировано с повышенной частотой симптоматического или фатального ВМК по сравнению с плацебо [7].
Согласно эпидемиологическим данным, снижение концентрации холестерина на фоне терапии статинами в высоких дозах было ассоциировано с повышением риска развития внутримозгового кровоизлияния [35]. Согласно исследованию Heart Protection Study [36], у пациентов, у которых в анамнезе были инсульт или транзиторная ишемическая атака (ТИА), наблюдалась тенденция к более высокому риску ВМК на фоне лечения симвастатином в дозе 40 мг по сравнению с плацебо. Согласно ещё одному РКИ, пациенты из группы аторвастатина (в дозе 80 мг) имели большую частоту внутримозговых кровоизлияний по сравнению с группой плацебо [19]. Однако данные об увеличении риска ВМК на фоне терапии статинами являются противоречивыми. Так, согласно метаанализу 31 РКИ, в который было включено более 90 тыс. человек, не было найдено статистически значимой связи между использованием статинов и риском развития ВМК [37]. Более того, Tapia-Pérez JH и соавт. [38] приводят данные о том, что продолжение статинотерапии у пациентов с развившимся ВМК ассоциировано с улучшением восстановления и снижением 6-месячной смертности.
Эпидемиологические данные также свидетельствуют о том, что приём антидепрессантов из группы селективных ингибиторов обратного захвата серотонина (СИОЗС) был ассоциирован с увеличением риска ВМК у пожилых пациентов [39]. Имеются данные, что СИОЗС могут вызвать одно ВМК на 10 000 человек (0,01 %), пролеченных в течение 1 года [39]. Недавно было проведено перекрёстное эпидемиологическое исследование 4 945 пациентов, получавших антидепрессанты: обнаружено, что у 5,5 % развились церебральные микрокровоизлияния, но не было выявлено статистически значимой причинно-следственной связи между применением СИОЗС и развитием ВМК [40]. Однако в некоторых исследованиях был отмечен повышенный риск повторных ВМК и худшего восстановления у пациентов, которым СИОЗC назначались после ранее перенесённого ВМК [41, 42].
Кроме того, необходимо отметить, что на фоне применения некоторых препаратов из тех, которые, казалось бы, должны были бы увеличивать риск ВМК, данная взаимосвязь не была обнаружена [43]. Так, при применении прямых ингибиторов тромбина гирудина и бивалирудина не было отмечено увеличения риска ВМК, риск кровотечения на фоне применения данных препаратов был ниже по сравнению с таковым на фоне применения нефракционированного гепарина [43]. Однако клиницисты должны знать о потенциальной возможности возникновения ВМК на фоне применения этих ЛС, особенно при их одновременном использовании в сочетании с другими антиагрегантными препаратами, такими как антагонисты рецепторов гликопротеина IIb/IIIa.
Риск развития ВМК также может повышаться у пациентов, получающих нестероидные противовоспалительные средства (НПВС). Так, метаанализ 3 когортных исследований и 3 исследований по типу «случай-контроль» [18] не показал значимого увеличения риcка ВМК при использовании НПВС, однако анализ отдельных препаратов из этой группы выявил повышение риска ВМК на фоне использования диклофенака (отношение рисков (ОР): 1,27; 95 % доверительный интервал (ДИ): 1,02–1,59) и мелоксикама (ОР: 1,27; 95 % ДИ: 1,08–1,50). Более поздний метаанализ 13 наблюдательных исследований [44] также показал увеличенный риск ВМК у пациентов, получавших мелоксикам и диклофенак. Кроме того, риск ВМК увеличивался на фоне применения индометацина и НПВС в целом. Риск внутричерепных кровоизлияний увеличивается при одновременном применении неселективных НПВС с СИОЗС [45], трициклическими антидепрессантами [46].
Однако увеличение риска развития ВМК, ассоциированного с применением НПВС, обнаружено не во всех исследованиях. Так, согласно результатам многоцентрового исследования по типу «случай-контроль», увеличения риска ВМК, ассоциированного с применением НПВС, не наблюдалось [47].
Патофизиологические механизмы / Pathophysiological mechanisms
Предполагается несколько возможных механизмов, обуславливающих ЛИ ВМК, ведущими среди них является геморрагический диатез и острая артериальная гипертензия [6].
Геморрагический диатез. Под геморрагическим диатезом здесь следует понимать патологические состояния, проявляющиеся повышенной кровоточивостью или спонтанными кровотечениями вследствие нарушения тех или иных звеньев гемостаза (тромбоцитарного, сосудистого, плазменного) [6]. Внутричерепное кровоизлияние обычно вызвано разрывом сосудов, в которых происходили процессы дегенерации в связи с длительно существовавшей артериальной гипертензией (АГ). В таких артериях наблюдается значительная дегенерация медии и гладкомышечного слоя [48]. В некоторых случаях субэндотелиально может наблюдаться фибриноидный некроз с микроаневризмами и локальными расширениями сосуда [3].
Механизм первичного повреждения вещества головного мозга при нарушении целостности сосуда обусловлен сдавлением паренхимы ГМ гематомой, что приводит к физическому разрушению её архитектуры [49]. Повышение внутричерепного давления из-за расширения гематомы может влиять на кровоток, приводить к механической деформации, высвобождению нейромедиаторов, митохондриальной дисфункции и деполяризации мембран [50].
Вторичный механизм повреждения головного мозга после повреждения эндотелия и распада гемоглобина связан с каскадом свёртывания крови, в частности с тромбином. В частности, согласно экспериментальным данным, полученным на лабораторных животных, введение больших объёмов тромбина в вещество головного мозга вызывает инфильтрацию последнего воспалительными клетками, пролиферацию мезенхимальных клеток, развитие отёка и формирование рубцовой ткани [51]. Являясь по своей структуре сериновой протеазой, тромбин связывается с активируемыми протеазой рецепторами (англ.: protease-activated receptors, PAR), PAR-1, PAR-3, PAR-4, стимулирует запуск множества сигнальных путей, ведущих к активации микроглии, глутаматной эксайтотоксичности, «открытию» гематоэнцефалического барьера и апоптозу клеточных элементов головного мозга [51]. Следствием повышения проницаемости гематоэнцефалического барьера служит поступление в ЦНС компонентов комплемента с образованием в последующем мембраноатакующего комплекса, приводящего к разрушению эритроцитов и дополнительному повреждению головного мозга [51]. Поступление в вещество головного мозга гемоглобина ввиду лизиса эритроцитов и последующее высвобождение железа ещё больше усугубляют повреждение нейронов и ведут к их гибели [48].
Обычно гематома увеличивается в сроки от 3 до 12 часов. В трети случаев увеличение гематомы происходит через 3 часа. Перигематомный отёк нарастает в течение 24 часов, достигает пика примерно через 5–6 дней и сохраняется до 14 дней. Вокруг гематомы имеется зона гипоперфузии. Факторами, утяжеляющими последствия ВМК, являются расширение гематомы, внутрижелудочковое кровоизлияние, перигематомный отёк и воспаление [52].
На данный момент остаётся не до конца понятным механизм, который приводит к увеличению частоты внутричерепных кровоизлияний на фоне применения ЛС [6]. Антикоагулянты могут приводить к спонтанным субклиническим кровотечениям, которые могут затем стать клинически значимыми. Например, пациенты с варфарин-индуцированной внутричерепной гематомой имеют статистически значимое увеличение риска прогрессирования гематомы [53]. В дополнение к этому гепарин может увеличивать риск ВМК путём гепарин-индуцированной тромбоцитопении. Кроме того, антикоагулянты могут увеличивать тяжесть ВМК, возникшего от других причин — травмы либо разрыва аневризмы [54].
Согласно Skop BP и соавт. [55], СИОЗС могут увеличивать риск внутричерепных кровоизлияний в связи с наличием у них антитромбоцитарных эффектов. Серотонин в тромбоцитах необходим для поддержания гемостаза, а препараты данной группы могут уменьшать количество серотонина в них, за счёт угнетения его обратного захвата. Результатом служит подавление тромбоцитарного звена гемостаза и повышение риска геморрагий, в том числе в веществе головного мозга.
Предполагается, что ВМК на фоне терапии статинами обусловлено тем, что адекватные концентрации холестерина необходимы для поддержания целостности мелких сосудов и предотвращения их разрыва [56]. Ингибируя образование холестерина, ЛС данной группы потенциально могут предрасполагать к нарушению структуры сосудов и негативным образом сказываться на сосудистом компоненте системы гемостаза. Кроме того, в развитии ВМК на фоне данной терапии возможны такие механизмы, как ингибирование агрегации тромбоцитов, усиление фибринолиза и снижение тромбообразования [19].
Другим классом препаратов, способным повышать риск ВМК, являются нестероидные противовоспалительные лекарственные средства (НПВС) [44][57][58]. В литературе обсуждается ряд потенциальных патофизиологических механизмов подобных эффектов данных ЛС. НПВС нарушают продукцию ряда простагландинов, тромбоксана, простациклина, обладающих вазоактивными свойствами и влияющих на систему гемостаза, в результате чего может изменяться тонус сосудистой стенки, снижаться агрегация тромбоцитов и модулироваться пролиферативный потенциал гладких миоциотов [44]. Механизм действия НПВС состоит в подавлении активности циклооксигеназы (ЦОГ) либо 1-го и 2-го типов (неселективные представители класса), либо преимущественно 2-го типа данного фермента [57]. Один из важнейших биологических эффектов ЦОГ-1 заключается в её участии в синтезе тромбоксана А2, который является мощным вазоконстриктором и фактором активации тромбоцитов. Ингибирование синтеза тромбоксана А2 на фоне применения НПВС повышает риск геморрагических осложнений, в том числе риск геморрагического инсульта [44]. Обе изоформы ЦОГ также опосредуют продукцию простагландина Е2 и простагландина I2 (или по-другому простациклина), которые ингибируют реабсорбцию натрия в петле Генле и реабсорбцию воды в собирательных трубочках. Ингибирование фермента ЦОГ при применении НПВС тем самым ведёт к увеличению внутрисосудистого объёма и может создавать плацдарм для ВМК, особенно при наличии врождённых нарушений анатомии внутримозговых сосудов [44]. Применение НПВС также ассоциируется с риском повышения артериального давления и развития лекарственно-индуцированной артериальной гипертензии (в результате увеличения объёма циркулирующей крови и вазоконстрикции ввиду подавления синтеза вазодилатирующих простагландинов), что служит дополнительным фактором, повреждающим сосудистую стенку, и представляет собой фактор риска геморрагического инсульта [44][59].
Острая гипертензия. Одним из механизмов развития ВМК является острое повышение артериального давления (АД), которое может возникать либо усугубляться вследствие применения различных психоактивных веществ. Ведущей причиной быстрого роста АД является их влияние на баланс нейротрансмиттеров [6] — многие субстанции увеличивают высвобождение катехоламинов из окончаний центральных норадренергических нейронов (например, амфетамины, производные эфедры, симпатомиметики, опускаемые без рецепта), подавляют их обратный захват (например, так действует кокаин), а также увеличивают концентрацию катехоламинов в крови (например, этанол и тот же кокаин). Острое повышение АД, ассоциированное с введением подобных веществ, может нарушать церебральную сосудистую ауторегуляцию и оказывать негативное влияние на структуру мозговых артериол, предрасполагая к их разрыву и развитию ВМК. Однако, как указано выше, по данному механизму ВМК развивается при злоупотреблении психоактивными веществами [6], что не является предметом настоящего обзора.
Факторы риска / Risk factors
Факторами риска развития ВМК в целом являются азиатская и негроидная раса [60], возраст и мужской пол — средний возраст больных с ВМК — 60–65 лет, соотношение мужчин и женщин равно 1,6:1. Риск развития ВМК значительно повышается после 55 лет и удваивается с каждым последующим десятилетием жизни [1]. Кроме того, факторами риска являются АГ, злоупотребление алкоголем, курение [61], наличие ОНМК в анамнезе, а также нарушения функции печени, сопровождающиеся тромбоцитопенией, гиперфибринолизом и гипокоагуляцией [62], церебральная амилоидная ангиопатия, наличие церебральных микрокровоизлияний [3].
Схожие факторы играют роль и в развитии ЛИ ВМК. Общими факторами риска развития ЛИ ВМК являются возраст <65 лет, амилоидная ангиопатия, курение, сидячий образ жизни, АГ, нарушения свёртывания крови, тромбоцитопения [6]. Далее будут подробнее разобраны факторы риска для каждой группы препаратов — индукторов ВМК.
Антиагрегантная терапия. Использование АСК как для первичной, так и для вторичной профилактики сосудистых осложнений, включая ишемический инсульт, ассоциировано с повышенным риском ВМК [9]. Поскольку АСК эффективно профилактирует сердечно-сосудистые осложнения, оценка возможных факторов риска ВМК необходима при оценке того, превышает ли риск пользу. Факторами риска АСК-индуцированного внутримозгового кровоизлияния являются возраст старше 75 лет, АГ, церебральная амилоидная ангиопатия, носовое кровотечение в анамнезе, исходно существующие нарушения свёртываемости крови, а также новообразования [9].
Пациенты в возрасте 75 лет имеют более высокий уровень внутричерепных кровоизлияний на фоне лечения антагонистами рецепторов гликопротеина IIb/IIIa [63]. Пациенты с острым повреждением почек (ОПП) или хронической болезнью почек (ХБП) подвержены большему риску кровотечения на фоне терапии антагонистами рецепторов гликопротеина IIb/IIIa, чем пациенты с нормальной функцией почек [64].
Тромболитическая терапия. Факторы риска внутримозгового кровоизлияния, ассоциированного с тромболитической терапией у больных с острым инфарктом миокарда, включают пожилой возраст >80 лет, женский пол, повышение уровня АД >160/100 мм рт. ст., инсульт в анамнезе, дозу rt-PA >1,5 мг/кг и низкую массу тела (<50 кг) [65].
Факторами, связанными с ВМК на фоне ишемического инсульта, помимо тромболитической терапии, были тяжесть инсульта и наличие ранних ишемических изменений на КТ головного мозга перед лечением [66]. Оценка тяжести инсульта по шкале NIHSS является важным предиктором развития ВМК на фоне тромболизиса. При исходной оценке по шкале NIHSS от 0 до 4 риск ВМК в группе tPA по сравнению с контрольной группой составил 1,5 % по сравнению с 3,7 % при исходной оценке по шкале NIHSS ≥22 [67].
В метаанализе 55 исследований Whiteley WN и соавт. [67] была обнаружена связь между пожилым возрастом и значительно повышенным риском ВМК после внутривенного введения тромболитика. Кроме того, имеется более высокая частота ВМК после внутривенного введения tPA у пациентов азиатской расы [68].
В рамках специального анализа European Cooperative Acute Stroke Study II (ECASS-II) [69] изучались факторы риска тяжёлой геморрагической трансформации (ГТ) у пациентов с ишемическим инсультом, которым проводился тромболизис рекомбинантным тканевым активатором плазминогена. ECASS-IIпредставляло собой неангиографическое, рандомизированное, плацебо-контролируемое, двойное слепое исследование применения рекомбинантного тканевого активатора плазминогена для внутривенного введения (0,9 мг / кг массы тела, максимальная доза 90 мг) при остром ишемическом инсульте [69]. В исследование включались мужчины или женщины в возрасте от 18 до 80 лет с клинически верифицированным диагнозом ишемического полушарного инсульта средней и тяжёлой степени тяжести, у которых имелась возможность проведения подобной тромболитической терапии в течение первых 6 часов после появления симптомов инсульта. Тип ГТ классифицировался согласно клиническим и рентгенологическим критериям следующим образом: геморрагический инсульт, паренхиматозное кровоизлияние и ВМК с наличием клинической симптоматики. Потенциальные факторы риска ГТ оценивались с помощью пошагового логистического регрессионного анализа, включая анализ связи между применением тканевого активатора плазминогена с переменными-кандидатами, которые представляли собой 21 заранее предопределённый показатель, включая возраст, пол, массу тела, наличие в анамнезе транзиторной ишемической атаки, инсульта, артериальной гипертензии и ряд других. Кроме того, распределение неблагоприятных исходов (то есть соответствующих 5–6 баллам по модифицированной шкале Рэнкина от 0 до 6) на 90-й день также стратифицировалось в зависимости от типа ГТ. В результате было установлено, что паренхиматозное кровоизлияние и ВМК с наличием клинической симптоматики были взаимосвязаны с применением тканевого активатора плазминогена, и на фоне введения последнего данные варианты геморрагической трансформации характеризовались более тяжёлым течением. Факторами риска развития паренхиматозного кровоизлияния являлись использование тканевого активатора плазминогена, объём зоны гиподенсивности вещества головного мозга на исходной компьютерной томограмме, хроническая сердечная недостаточность, пожилой возраст и исходный уровень систолического артериального давления. Риск возникновения паренхиматозного кровоизлияния на фоне терапии тканевым активатором плазминогена повышал пожилой возраст и терапия ацетилсалициловой кислотой до процедуры тромболизиса. Факторами риска ВМК с наличием клинической симптоматики служили применение тканевого активатора плазминогена, хроническая сердечная недостаточность, объём зоны гиподенсивности вещества головного мозга на исходной компьютерной томограмме и пожилой возраст. Риск ВМК с наличием клинической симптоматики на фоне введения тканевого активатора плазминогена повышал факт применения ацетилсалициловой кислоты в анамнезе перед тромболизисом [69].
Целью другой работы [70] являлась разработка клинически ориентированной шкалы, позволяющей оценивать риск развития ВМК с наличием клинической симптоматики. Для этого были проанализированы данные 31 627 пациентов с клиническими симптомами инсульта, которым проводилась процедура тромболизиса алтеплазой, зарегистрированных в Международном регистре тромболизиса при инсульте «Безопасное внедрение методов лечения при инсульте» (Safe Implementation of Treatments in Stroke International Stroke Th rombolysis Register). Конечной точкой являлось симптомное ВМК, соответствующее определению, использовавшемуся в Safe Implementation of Th rombolysis in Stroke-Monitoring Study: паренхиматозное кровотечение 2-го типа с суммарным баллом по шкале инсульта Национального института здоровья (National Institutes of Health Stroke Scale score) ≥4 баллов или с фатальным исходом. В результате было обнаружено 9 независимых факторов риска внутричерепного кровоизлияния с клинической симптоматикой: исходный балл по шкале National Institutes of Health Stroke Scale score >7, уровень глюкозы в сыворотке крови ≥10 ммоль/л, систолическое артериальное давление ≥146 мм рт. ст., возраст ≥72 лет, масса тела ≥95 кг, время от дебюта симптомов ишемического инсульта до момента инициации тромболитической терапии ≥180 минут, приём в анамнезе ацетилсалициловой кислоты или комбинации ацетилсалициловой кислоты и клопидогрела, артериальная гипертензия в анамнезе. Суммарная распространённость ВМК в исследовании составила 1,8 %. Разработанная авторами шкала риска ВМК ранжировалась от 0 до 12 баллов, и при наличии ≥10 баллов отмечалось 70-кратное увеличение частоты ВМК по сравнению с пациентами, у кого суммарный балл составлял 0.
Факторы риска ВМК с наличием клинической симптоматики на фоне выполнения тромболизиса алтеплазой у пациентов с ишемическим инсультом также изучались в исследовании Nisar T и соавт. [71]. В дополнение к этому, в рамках исследования проводилась валидация ряда шкал, созданных для оценки риска симптомных ВМК. Ретроспективно были проанализированы истории болезни 224 пациентов, из них 89 пациентов вошли в исследование (средний возраст 63,4±14,4 года, 53,9 % — мужчины). Всем пациентам выполнялась КТ головного мозга с подтверждением факта вновь возникшего ишемического инсульта, после чего инициировалась процедура тромболизиса алтеплазой. Из работы исключались пациенты, перенёсшие интервенционную тромб эктомию. Как потенциальные кандидаты-предикторы ВМК анализировались следующие факторы: исходное среднее артериальное давление, уровень глюкозы крови, балльная оценка по шкале инсульта Нацио нального института здоровья (National Institutes of Health Stroke Scale score, NIHSS), подтверждённый приём ацетилсалициловой кислоты и/или клопидогрела,
возраст, пол, уровень тромбоцитов, международное нормализованное отношение, протромбиновое время, частичное тромбопластиновое время, гликированный гемоглобин, холестерин липопротеинов низкой плотности, время начала лечения от дебюта клинической картины инсульта, вес, ранние признаки инсульта, по данным компьютерной томографии головного мозга. В качестве валидизируемых шкал выступали: SPAN-100 (stroke prognostication using
age and NIH stroke scale-100), DRAGON ([hyper]Dense cerebral artery sign/early infarct signs on admission CT scan, prestroke modifi ed Rankin Scale (mRS) score, Age, Glucose level at baseline, Onset-to-treatment time, and baseline National Institutes of Health Stroke Scale score), CUCCHIARA (название представляет собой фамилию автора, разработавшего данную шкалу), HAT (Hemorrhage Aft er Th rombolysis), SEDAN (blood sugar, early infarct signs, [hyper]dense cerebral artery sign, age), THRIVE (totaled health risks in vascular events) и Safe Implementation of Th rombolysis in Stroke-Symptomatic Intracerebral Hemorrhage (безопасное выполнение тромболизиса при ВМК с симптомами инсульта). В результате было установлено, что частота ВМК среди включённых пациентов составила 5,62 % в соответствии с критериями Второго Европейско-Австралоазиатского объединённого исследования острого инсульта (European Australasian Cooperative Acute Stroke Study-II; ECASS-II) и 7,86 % при использовании критериев Национального института неврологических расстройств и инсульта (National Institute of Neurological Disorders and Stroke; NINDS). При применении критериев ECASS-II с риском развития ВМК, по данным многофакторного регрессионного анализа, статистически значимо ассоциировалось среднее артериальное давление (95 % доверительный интервал (ДИ) различий в частоте ВМК, стратифицированный по среднему артериальному давлению, 0,001–0,01; р=0,002), уровень глюкозы в крови ≥185 мг/дл (≥10,28 ммоль/л) (95 % ДИ 0,12–0,45; р=0,001) и наличие ранних признаков инсульта при нейровизуализации (95 % ДИ 0,06–0,25; р=0,002). При использовании критериев NINDS для ВМК на фоне тромболитической терапии развитие последнего статистически значимо ассоциировалось только с уровнем среднего артериального давления (95 % ДИ 1,01–1,18; р=0,025) и приёмом ацетилсалициловой кислоты в дозе менее 500 мг/сут. (95 % ДИ 0,01–0,80; р=0,032). Кроме того, было обнаружено, что балльные оценки риска ВМК по шкалам HAT (95 % ДИ 0,58–0,96; р=0,044) и DRAGON (95 % ДИ 0,61–0,96; р=0,012) имели наибольшую площадь под кривой (area under the curve, AUC) в отношении ВМК, определявшихся соответственно по критериям ECASS-II и NINDS, то есть именно эти две шкалы обладали наивысшей валидностью как предикторы развития ВМК.
Также имеются данные, что c повышенным риском ВМК на фоне тромболитической терапии у больных с ишемическим инсультом ассоциируются повышение абсолютного количества нейтрофилов и соотношения количества нейтрофилов и лимфоцитов [73] и наличие тромбоцитопении перед введением тромболитика [74].
Антикоагулянтная терапия
Оральные антикоагулянты. Факторами, повышающими риск развития ВМК на фоне приёма антикоагулянтов, являются пожилой возраст (>85 лет), инсульт или кровотечения в анамнезе, амилоидная ангиопатия, АГ, ХБП, сопутствующая антитромбоцитарная терапия, длительность терапии антикоагулянтами [75]. Пациенты с уровнем МНО >3 имеют повышенный риск ВМК, ассоциированного с приёмом варфарина. Риск кровотечений, ассоциированных с приёмом антикоагулянтов, наиболее высок в течение первого месяца после начала терапии [76]. Также высокий риск кровотечений имеют пациенты с количеством баллов по шкале HAS-BLED ≥3 [77].
Нефракционированный гепарин. Факторы риска развития ВМК на фоне применения данного ЛС включают АГ, тромбоцитопению, большой размер очага инсульта и болюсное введение препарата. Пациенты со значением активированного частичного тромбопластинового времени (АЧТВ) >80–90 с имеют повышенный риск ВМК, ассоциированного с применением гепарина: на каждые 10 секунд увеличения АЧТВ риск больших кровотечений увеличивается на 7 % [16]. Для низкомолекулярных гепаринов (НМГ) факторами риска ВМК являются возраст >75 лет, тромбоцитопения и ХБП.
Использование антитромбоцитарных препаратов, антикоагулянтов или тромболитиков в составе комбинированной терапии может обеспечить дополнительный положительный эффект у пациентов с сердечно-сосудистыми заболеваниями, ишемическим инсультом или ТИА, но комбинации этих ЛС также увеличивают риск ВМК [16].
Применение антидепрессантов из группы СИОЗС. Факторами риска развития ВМК при применении препаратов данной группы являются злоупотребление алкоголем, курение [78], а также сопутствующий приём антикоагулянтов и или антиагрегантов [79]. Кроме того, нельзя исключить, что антитромбоцитарный эффект СИОЗС, выявленный в исследованиях in vitro и в экспериментальных, посредством которого они могут увеличивать риск ВМК, является дозозависимым [80].
Гиполипидемическая терапия. Факторами риска данной НР при применении статинов считают возраст >65 лет, АГ 2-й и 3-й степени, мужской пол, а также инсульт/ТИА в анамнезе [19]. Кроме того, необходимо подчеркнуть, что ВМК наблюдались лишь при применении данных ЛС в высоких дозировках [6].
Терапия НПВС. Фактором риска при применении данных препаратов является их совместное использование с другими препаратами — индукторами ВМК, например СИОЗС [45].
Клиническая картина, диагностика, дифференциальная диагностика / Clinical presentation, diagnosis, diff erential diagnosis
Клиническая картина. Ишемический инсульт невозможно отличить от геморрагического только на основании клинического обследования, хотя некоторые симптомы более характерны для ВМК: головная боль, нарушение уровня сознания, тошнота и рвота, развитие менингеального синдрома, возможно развитие эпилептического приступа [1]. ВМК развиваются остро, часто на фоне резкого подъёма АД, употребления алкоголя, физической нагрузки. Рвота встречается примерно у 50 % пациентов с полушарным внутримозговым кровоизлиянием и чаще у пациентов с кровоизлияниями в мозжечок [3]. Небольшие гематомы в белом веществе головного мозга редко сопровождаются головной болью и чаще ограничены только очаговой неврологической симптоматикой [1][3].
Клинические проявления зависят от размера и локализации очага поражения [1]. Так, например, субкортикальные (расположенные вблизи коры), путаменальные (расположенные вблизи подкорковых ядер) и смешанные гематомы могут проявляться контралатеральными сенсомоторными нарушениями, гомонимной гемианопсией, афазией (при поражении доминантного полушария), анозогнозией (при поражении субдоминантного полушария). ВМК в мозжечок будут проявляться мозжечковой атаксией с развитием нистагма и мышечной гипотонии. Обширные гематомы мозжечка могут привести к компрессии ствола головного мозга с развитием признаков поражения черепно-мозговых нервов и проводящих путей. ВМК в области ствола головного мозга может приводить к развитию альтернирующих синдромов, развитию комы и нарушению жизненно важных функций. При прорыве крови в желудочковую систему развиваются признаки повышения внутричерепного давления, симптоматика зависит от объёма излившейся крови. При обширных гематомах возможно развитие дислокационного синдрома, который часто проявляется анизокорией (мидриаз на стороне поражения), угнетением уровня сознания вплоть до комы, нарушениями дыхания и сердечной деятельности [1].
Внутричерепное кровоизлияние на фоне приёма ЛС имеет ряд особенностей. Примерно у половины пациентов симптомы ВМК, ассоциированного с антикоагулянтной терапией, прогрессируют в течение 24 часов [52]. ПОАК ассоциированные ВМК, по сравнению с варфарин-индуцированными ВМК, обычно имеют меньшие объёмы гематомы и лучшие клинические исходы [81][82].
Диагностика. Нейровизуализация. КТ без контраста — это быстрая методика с очень высокой чувствительностью для выявления острого ВМК, и, учитывая её широкую доступность, она считается золотым стандартом диагностики [83]. КТ позволяет определить локализацию и объём ВМК, смещение срединных структур головного мозга, наличие внутрижелудочкового кровоизлияния, дислокационного синдрома, исключить вторичные ВМК (например, кровоизлияние в опухоль) [1].
По данным нейровизуализации возможно предположить лекарственную этиологию инсульта. Так, ВМК, возникшие на фоне приёма антикоагулянтов, чаще неправильной формы с зонами разной плотности на КТ [22].
КТ- и магнитно-резонансная (МР) ангиография, а также цифровая субтракционная ангиография являются дополнительными диагностическими методами для выявления разрыва аневризмы или артериовенозной мальформации как причины ВМК [1].
Чувствительность магнитно-резонансной томографии (МРТ) для диагностики ВМК эквивалентна КТ [84]. МРТ может быть полезным методом для выявления основных вторичных причин ВМК, таких как кровоизлияние в опухоль головного мозга или геморрагическая трансформация ишемического инсульта [83]. Последнее может быть особенно актуально в случае применения тромболитиков или антикоагулянтов. Наконец, у пациентов со сниженной функцией почек, аллергией на контраст или другими противопоказаниями к КТ-ангиографии визуализацию сосудов головного мозга можно выполнить без контраста с помощью МР-ангиографии. Учитывая стоимость, продолжительность обследования и плохую переносимость для некоторых пациентов, МРТ редко используется в неотложной диагностике [85].
У пациентов с ВМК, в том числе лекарственной этиологии, следует выполнить общий анализ крови, оценить уровни электролитов, креатинина, глюкозы и коагулограмму. При ЛИ ВМК могут наблюдаться признаки гипокоагуляции, которые могут быть обусловлены как приёмом медикаментов, так и сопутствующим заболеванием (патология печени, заболевания крови) [1].
Для выявления именно ЛИ характера ВМК необходимо установить причинно-следственную связь между приёмом конкретного препарата и развитием данной патологии, с этой целью можно воспользоваться шкалой Наранжо [86]. Для выявления препарата-индуктора необходим очень тщательный сбор фармакологического анамнеза по определённой схеме [87]. Лекарственную этиологию заболевания можно определить, если симптомы связаны во времени, а также возможно определить концентрацию препарата (однако это в большей степени актуально для веществ, вызывающих зависимость). Кроме того, связь между приёмом препарата и развитием инсульта возможно косвенно установить для тех ЛС, для которых имеются параметры мониторинга безопасности, например МНО и АЧТВ для варфарина и гепарина соответственно [6].
Дифференциальная диагностика. ЛИ ВМК следует дифференцировать с ВМК другой этиологии, однако необходимо отметить, что это часто бывает затруднительно. Кроме того, ЛИ ВМК необходимо дифференцировать с такими заболеваниями, как ишемический инсульт, геморрагическая трансформация ишемического инсульта, диссекция сонной или позвоночной артерии; инфекция ЦНС / абсцесс головного мозга; энцефалит; острая гипертоническая энцефалопатия; внутричерепные опухоли; метаболическая энцефалопатия, черепно-мозговая травма [6].
Лечение / Treatment
Ведение любого пациента с ВМК включает в себя несколько этапов: профилактику повторного кровоизлияния, поддерживающее и медикаментозное лечение в острой фазе, меры по смягчению продолжающегося патологического процесса и реабилитацию. Общее медикаментозное лечение и поддерживающая терапия показаны всем пациентам для предотвращения осложнений (например, внутричерепной гипертензии (ВЧГ), гипертермии, гипергликемии) [1, 85].
Антигипертензивная терапия. У пациентов с внутричерепной гипертензией часто наблюдается тяжёлая острая АГ. Однако в настоящее время отсутствует единое мнение относительно идеального целевого диапазона для уровня АД в острейшем периоде ВМК. Решение относительно уровня снижения АД является своеобразным балансом между минимизацией объёма гематомы и предотвращением ишемических изменений. В клинических рекомендациях Российского кардиологического общества по АГ (2020 г.) [88] отмечено, что пациентам с внутримозговой гематомой и систолическим АД (САД) <200 мм рт. ст. не рекомендуется незамедлительное снижение АД для профилактики осложнений (в том числе гипоперфузии головного мозга или увеличения размеров очага поражения). Пациентам с внутримозговой гематомой при САД ≥220 мм рт. ст. рекомендовано осторожное снижение АД до уровня <180 мм рт. ст. с помощью в/в терапии для профилактики осложнений [88].
В российских рекомендациях по геморрагическому инсульту (2021 г.) предлагается несколько иной подход [1][85]. Согласно данному документу, в острейшем периоде подтверждённого ВМК в первые 24 часа рекомендуется осторожное снижение цифр АД и его непрерывное мониторирование. У больных с исходным уровнем САД 150–220 мм рт. ст. безопасной является коррекция цифр САД до уровня 140 мм рт. ст., при этом следует стремиться к минимальной вариабельности цифр АД в течение первых 24 часов. Не рекомендуется в течение первого часа снижение цифр САД более чем на 60 мм рт. ст. В данных рекомендациях также подчеркивается, что у больных с САД <220 мм рт. ст. может быть обоснованным более активное снижение цифр АД [1].
Лечение повышенного внутричерепного давления. Начальное лечение повышенного ВЧД заключается в возвышенном положении головного конца кровати (до 30–40 градусов) и применении осмотических препаратов (маннитол, гипертонический физиологический раствор [52]).
Противоэпилептическая терапия. Эпилептические приступы встречаются у 3–17 % пациентов в первые 14 дней после ВМК, а у 30 % пациентов судороги будут проявляться при ЭЭГ-мониторинге. Противоэпилептическая терапия не назначается в профилактических целях и показана пациентам с развившимся эпилептическим приступом или эпилептиформной активностью на ЭЭГ [1].
Хирургическое лечение. У некоторых пациентов может потребоваться хирургическое вмешательство. Различные типы хирургического лечения ВМК включают трепанацию черепа, стереотаксическую, эндоскопическую и катетерную аспирацию [52].
Все пациенты с острым ВМК лекарственной этиологии должны быть госпитализированы, и большинству из них требуется лечение в отделении интенсивной терапии. Если ВМК возникает на фоне тромболитической, антикоагулянтной или антитромбоцитарной терапии, показано немедленное прекращение терапии препаратом-индуктором. Если это возможно, то необходимо быстрое восстановление нарушенного профиля свёртывания с помощью специальных антидотов [6].
Если пациенту c ФП необходимы инициация/возобновление терапии ОАК, то оно может быть рекомендовано через 4–8 недель при условии устранения причины кровотечения и коррекции имеющихся факторов риска ВМК [89].
Согласно отечественным Рекомендациям, больных, перенёсших ГИ, получавших антиагрегантную терапию по поводу других заболеваний или для профилактики сердечно-сосудистой, цереброваскулярной патологии и имеющих показания для назначения соответствующей терапии, следует рассматривать в качестве кандидатов для возобновления соответствующей терапии. У больных, перенёсших геморрагический инсульт и имеющих показания для проведения антиагрегантной терапии, возможно её возобновление, однако существующих данных недостаточно, чтобы однозначно определить оптимальные сроки её возобновления [1]. Кроме того, при принятии решения о возобновлении терапии возможно руководствоваться инструкцией к соответствующему ЛС. Для ацетилсалициловой кислоты (Аспирин® Кардио) противопоказанием являются другие виды кровотечений, такие как цереброваскулярное [90]. Внутричерепное кровоизлияние в анамнезе является противопоказанием к применению тикагрелора (Брилинта®), инсульт в анамнезе является противопоказанием к применению прасугрела (Эффиент®) [91][92]. Острое кровотечение, в том числе внутричерепное кровоизлияние, является противопоказанием к назначению клопидогрела (Плавикс®) [93].
Профилактика / Prevention
Наиболее простым и эффективным средством профилактики ЛИ ВМК является отказ от ЛС, применение которого ассоциировано с повышенным развития ВМК, особенно у пациентов высокого риска. Однако это зачастую невозможно, и основой профилактики является информирование пациентов и практикующих врачей о данной НР, выявление и, по возможности, коррекция факторов риска, особенно у тех пациентов, которые относятся к группе высокого риска [85]. Кроме того, имеются стратегии профилактики ЛИ ВМК при лечении определёнными препаратами-индукторами. Для профилактики ВМК в целом полезен контроль АГ (достижение целевых уровней АД) и других факторов риска.
Для профилактики ВМК на фоне антикоагулянтной терапии пациенты, получающие данные ЛС, должны находиться под тщательным наблюдением на предмет интенсивности антикоагулянтной терапии, состояния функции почек и возможности лекарственного взаимодействия. Необходимо помнить, что комбинация антикоагулянтов с АСК и/или клопидогрелом может увеличить риск ВМК, поэтому следует минимизировать длительность комбинированной терапии [94–96]. Важно также контролировать АГ [6]. Для профилактики варфарин-индуцированного ВМК, кроме того, необходимо поддерживать МНО в целевом диапазоне и применять препарат с осторожностью у пожилых пациентов [6].
Для профилактики ВМК на фоне тромболитической терапии важен правильный отбор пациентов с ишемическим инсультом в качестве кандидатов на в/в введение rt-PA и чёткое соблюдение протоколов реперфузионной терапии [97]. Также необходим тщательный мониторинг состояния пациента.
Заключение / Conclusion
Таким образом, ВМК является чрезвычайно серьёзным заболеванием с очень высоким уровнем инвалидности и смертности. В последнее время происходит увеличение частоты данных инсультов в популяции, что в том числе связано с увеличением количества назначений антикоагулянтов и расширением показаний к комбинированной антитромбоцитарной терапии. Кроме того, согласно некоторым эпидемиологическим данным, применение антидепрессантов из группы СИОЗС и статинов в высоких дозировках также может быть сопряжено с повышением риска развития ВМК. Информирование специалистов здравоохранения о проблеме ЛИ ВМК необходимо для более эффективной профилактики и лечения данного тяжёлого осложнения фармакотерапии.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
ADDITIONAL INFORMATION
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interest. The authors state that there is no conflict of interest.
Список литературы
1. Клинические рекомендации. Геморрагический инсульт. Минздрав России, Ассоциация нейрохирургов России, Всероссийское общество неврологов, Ассоциация анестезиологов и реаниматологов России, Ассоциация реабилитологов России. Пересмотр 2020 г. Доступно по: https://ruans.org/Text/Guidelines/hemorrhagic_stroke-2020.pdf. Ссылка активна на 18.06.2022.
2. Keep RF, Hua Y, Xi G. Intracerebral haemorrhage: mechanisms of injury and therapeutic targets. Lancet Neurol. 2012;11(8):720–31. doi: 10.1016/S1474-4422(12)70104-7
3. An SJ, Kim TJ, Yoon BW. Epidemiology, Risk Factors, and Clinical Features of Intracerebral Hemorrhage: An Update. J Stroke. 2017;19(1):3–10. doi: 10.5853/jos.2016.00864
4. Unnithan AKA, Mehta P. Hemorrhagic Stroke. [Updated 2022 Feb 5]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Jan. Available at: https://www.ncbi.nlm.nih.gov/books/NBK559173/. Accessed June 18, 2022.
5. GBD 2019 Stroke Collaborators. Global, regional, and national burden of stroke and its risk factors, 1990–2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet Neurol. 2021;20(10):795–820. doi: 10.1016/S1474-4422(21)00252-0
6. Tisdale JE, Miller DA. Drug Induced Diseases: Prevention, Detection, and Management. 3rd Ed. Bethesda, Md.: American Society of Health-System Pharmacists; 2018; 1399 рр.: 237–51.
7. Adams HP Jr, Effron MB, Torner J, et al. Emergency administration of abciximab for treatment of patients with acute ischemic stroke: results of an international phase III trial: Abciximab in Emergency Treatment of Stroke Trial (AbESTT-II). Stroke. 2008;39(1):87–99. doi: 10.1161/STROKEAHA.106.476648
8. Cheng Z, Geng X, Gao J, et al. Intravenous Administration of Standard Dose Tirofiban after Mechanical Arterial Recanalization is Safe and Relatively Effective in Acute Ischemic Stroke. Aging Dis. 2019;10(5):1049–57. doi: 10.14336/AD.2018.0922
9. Gorelick PB, Weisman SM. Risk of hemorrhagic stroke with aspirin use: an update. Stroke. 2005;36(8):1801–7. doi: 10.1161/01.STR.0000174189.81153.85
10. Hart RG, Tonarelli SB, Pearce LA. Avoiding central nervous system bleeding during antithrombotic therapy: recent data and ideas. Stroke. 2005;36(7):1588–93. doi: 10.1161/01.STR.0000170642.39876.f2
11. Namazi MH, Saemifard F, Pishgahi M. One-Month Outcomes of Cases Receiving Ticagrelor after Percutaneous Coronary Intervention; a Case Series. Arch Acad Emerg Med. 2020;8(1):e42. doi: 10.22037/aaem.v8i1.649
12. Granger CB, Alexander JH, McMurray JJ, et al. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med. 2011;365(11):981–92. doi: 10.1056/NEJMoa1107039
13. Hart RG, Diener HC, Yang S, et al. Intracranial hemorrhage in atrial fibrillation patients during anticoagulation with warfarin or dabigatran: the RE-LYtrial. Stroke. 2012;43(6):1511–7. doi: 10.1161/STROKEAHA.112.650614
14. Hankey GJ, Stevens SR, Piccini JP, et al. Intracranial hemorrhage among patients with atrial fibrillation anticoagulated with warfarin or rivaroxaban: the rivaroxaban once daily, oral, direct factor Xa inhibition compared with vitamin K antagonism for prevention of stroke and embolism trial in atrial fibrillation. Stroke. 2014;45(5):1304–12. doi: 10.1161/STROKEAHA.113.004506
15. Giugliano RP, Ruff CT, Braunwald E, et al. Edoxaban versus warfarin in patients with atrial fibrillation. N Engl J Med. 2013;369(22):2093–104. doi: 10.1056/NEJMoa1310907
16. Levine MN, Raskob G, Beyth RJ et al. Hemorrhagic complications of anticoagulant treatment: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest. 2004;126(3 Suppl):287S-3I0S. doi: 10.1378/chest.126.3_suppl.287S
17. Mantia C, Uhlmann EJ, Puligandla M, Weber GM, Neuberg D, Zwicker JI. Predicting the higher rate of intracranial hemorrhage in glioma patients receiving therapeutic enoxaparin. Blood. 2017;129(25):3379–85. doi: 10.1182/blood-2017-02-767285
18. Ungprasert P, Matteson EL, Thongprayoon C. Nonaspirin Nonsteroidal Anti-Inflammatory Drugs and Risk of Hemorrhagic Stroke: A Systematic Review and Meta-Analysis of Observational Studies. Stroke. 2016;47(2):356–64. doi: 10.1161/STROKEAHA.115.011678
19. Amarenco P, Bogousslavsky J, Callahan A III et al. High-dose atorvastatin after stroke or transient ischemic attack. N Engl J Med. 2006;355(6):549–59. doi: 10.1056/NEJMoa061894
20. Kuramatsu JB, Huttner HB. Management of oral anticoagulation after intracerebral hemorrhage. Int J Stroke. 2019;14(3):238–46. doi: 10.1177/1747493019828555
21. Tawfik A, Bielecki JM, Krahn M, Dorian P, Hoch JS, Boon H, Husereau D, Pechlivanoglou P. Systematic review and network meta-analysis of stroke prevention treatments in patients with atrial fibrillation. Clin Pharmacol. 2016 Aug 11;8:93–107. doi: 10.2147/CPAA.S105165
22. Morotti A, Goldstein JN. Anticoagulant-associated intracerebral hemorrhage. Brain Hemorrhages. 2020;1(1):89–94. doi: 10.1016/j.hest.2020.01.001
23. Franke CL, de Jonge J, van Swieten JC, Op de Coul AA, van Gijn J. Intracerebral hematomas during anticoagulant treatment. Stroke. 1990; 21(5):726–30. doi: 10.1161/01.str.21.5.726
24. Gage BF, Yan Y, Milligan PE, et al. Clinical classification schemes for predicting hemorrhage: results from the National Registry of Atrial Fibrillation (NRAF). Am Heart J. 2006;151(3):713–9. doi: 10.1016/j.ahj.2005.04.017
25. Fang MC, Go AS, Chang Y, et al. Death and disability from warfarin-associated intracranial and extracranial hemorrhages. Am J Med. 2007;120(8):700– 5. doi: 10.1016/j.amjmed.2006.07.034
26. Dowlatshahi D, Butcher KS, Asdaghi N, et al. Poor prognosis in warfarin-associated intracranial hemorrhage despite anticoagulation reversal. Stroke. 2012;43(7):1812–7. doi: 10.1161/STROKEAHA.112.652065
27. Chai-Adisaksopha C, Crowther M, Isayama T, Lim W. The impact of bleeding complications in patients receiving target-specific oral anticoagulants: a systematic review and meta-analysis. Blood. 2014;124(15):2450–8. doi: 10.1182/blood-2014-07-590323
28. Ruff CT, Giugliano RP, Braunwald E, et al. Comparison of the efficacy and safety of new oral anticoagulants with warfarin in patients with atrial fibrillation: a meta-analysis of randomised trials. Lancet. 2014;383(9921):955–62. doi: 10.1016/S0140-6736(13)62343-0
29. Hylek EM, Held C, Alexander JH, et al. Major bleeding in patients with atrial fibrillation receiving apixaban or warfarin: The ARISTOTLE Trial (Apixaban for Reduction in Stroke and Other Thromboembolic Events in Atrial Fibrillation): Predictors, Characteristics, and Clinical Outcomes. J Am Coll Cardiol. 2014;63(20):2141–7. doi: 10.1016/j.jacc.2014.02.549
30. Piccini JP, Garg J, Patel MR, et al. Management of major bleeding events in patients treated with rivaroxaban vs. warfarin: results from the ROCKET AF trial. Eur Heart J. 2014;35(28):1873–80. doi: 10.1093/eurheartj/ehu083
31. Gulati S, Solheim O, Carlsen SM, et al. Risk of intracranial hemorrhage (RICH) in users oforal antithrombotic drugs: Nationwide pharmacoepidemiological study. PLoS One. 2018;13(8):e0202575. doi: 10.1371/journal.pone.0202575
32. Maïer B, Desilles JP, Mazighi M. Intracranial Hemorrhage After Reperfusion Therapies in Acute Ischemic Stroke Patients. Front Neurol. 2020;11:599908. doi: 10.3389/fneur.2020.599908
33. Saver JL. Hemorrhage after thrombolytic therapy for stroke: the clinically relevant number needed to harm. Stroke. 2007;38(8):2279–83. doi: 10.1161/STROKEAHA.107.487009
34. Qureshi AI, Hussain MS, Nasar A, et al. Intracranial hemorrhages associated with intravenous platelet glycoprotein IIB/IIIA receptor inhibitors in the United States. Cardiovasc Drugs Ther. 2005;19(5):371–3. doi: 10.1007/s10557-005-4390-3
35. Ariesen MJ, Claus SP, Rinkel GJ, Algra A. Risk factors for intracerebral hemorrhage in the general population: a systematic review. Stroke. 2003;34(8):2060– 5. doi: 10.1161/01.STR.0000080678.09344.8D
36. National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) final report. Circulation. 2002;106(25):3143–421.
37. McKinney JS, Kostis WJ. Statin therapy and the risk of intracerebral hemorrhage: a meta-analysis of 31 randomized controlled trials. Stroke. 2012;43(8):2149–56. doi: 10.1161/STROKEAHA.112.655894
38. Tapia-Pérez JH, Rupa R, Zilke R, Gehring S, Voellger B, Schneider T. Continued statin therapy could improve the outcome after spontaneous intracerebral hemorrhage. Neurosurg Rev. 2013;36(2):279–87. doi: 10.1007/s10143-012-0431-0
39. Hackam DG, Mrkobrada M. Selective serotonin reuptake inhibitors and brain hemorrhage: a meta-analysis. Neurology. 2012;79(18):1862–5. doi: 10.1212/WNL.0b013e318271f848
40. Aarts N, Akoudad S, Noordam R, et al. Inhibition of serotonin reuptake by antidepressants and cerebral microbleeds in the general population. Stroke. 2014;45(7):1951–7. doi: 10.1161/STROKEAHA.114.004990
41. Liu L, Fuller M, Behymer TP, et al. Selective Serotonin Reuptake Inhibitors and Intracerebral Hemorrhage Risk and Outcome. Stroke. 2020;51(4):1135–41. doi: 10.1161/STROKEAHA.119.028406
42. Kubiszewski P, Sugita L, Kourkoulis C, et al. Association of Selective Serotonin Reuptake Inhibitor Use After Intracerebral Hemorrhage With Hemorrhage Recurrence and Depression Severity [published online ahead of print, 2020 Aug 31]. JAMA Neurol. 2020;78(1):1–8. doi: 10.1001/jamaneurol.2020.3142
43. Weitz JI, Buller HR. Direct thrombin inhibitors in acute coronary syndromes: present and future. Circulation. 2002;105(8):1004–11. doi: 10.1161/hc0802.104331
44. Islam MM, Poly TN, Walther BA, et al. Risk of Hemorrhagic Stroke in Patients Exposed to Nonsteroidal Anti-Inflammatory Drugs: A Meta-Analysis of Observational Studies. Neuroepidemiology. 2018;51(3-4):166–76. doi: 10.1159/000490741
45. Hou PC, Lin FJ, Lin SY, et al. Risk of Intracranial Hemorrhage With Concomitant Use of Antidepressants and Nonsteroidal Anti-inflammatory Drugs: A Nested Case-Control Study. Ann Pharmacother. 2021;55(8):941–8. doi: 10.1177/1060028020980417
46. Jeong HE, Oh IS, Kim WJ, Shin JY. Risk of Major Adverse Cardiovascular Events Associated with Concomitant Use of Antidepressants and Non-steroidal Anti-inflammatory Drugs: A Retrospective Cohort Study. CNS Drugs. 2020;34(10):1063–74. doi: 10.1007/s40263-020-00750-4
47. Choi NK, Park BJ, Jeong SW, Yu KH, Yoon BW. Nonaspirin nonsteroidal anti-inflammatory drugs and hemorrhagic stroke risk: the Acute Brain Bleeding Analysis study. Stroke. 2008;39(3):845–9. doi: 10.1161/STROKEAHA.107.497040
48. Qureshi AI, Tuhrim S, Broderick JP, Batjer HH, Hondo H, Hanley DF. Spontaneous intracerebral hemorrhage. N Engl J Med. 2001;344(19):1450–60. doi: 10.1056/NEJM200105103441907
49. Qureshi AI, Suri MF, Ostrow PT, et al. Apoptosis as a form of cell death in intracerebral hemorrhage. Neurosurgery. 2003;52(5):1041–7; discussion 1047-8.
50. Slemmer JE, Shacka JJ, Sweeney MI, Weber JT. Antioxidants and free radical scavengers for the treatment of stroke, traumatic brain injury and aging. Curr Med Chem. 2008;15(4):404–14. doi: 10.2174/092986708783497337
51. Xi G, Keep RF, Hoff JT. Mechanisms of brain injury after intracerebral haemorrhage. Lancet Neurol. 2006;5(1):53–63. doi: 10.1016/S1474-4422(05)70283-0
52. Chen S, Zeng L, Hu Z. Progressing haemorrhagic stroke: categories, causes, mechanisms and managements. J Neurol. 2014;261(11):2061–78. doi: 10.1007/s00415-014-7291-1
53. Flibotte JJ, Hagan N, O’Donnell J, Greenberg SM, Rosand J. Warfarin, hematoma expansion, and outcome of intracerebral hemorrhage. Neurology. 2004;63(6):1059–64. doi: 10.1212/01.wnl.0000138428.40673.83
54. James RF, Palys V, Lomboy JR, Lamm JR Jr, Simon SD. The role of anticoagulants, antiplatelet agents, and their reversal strategies in the management of intracerebral hemorrhage. Neurosurg Focus. 2013;34(5):E6. doi: 10.3171/2013.2.FOCUS1328
55. Skop BP, Brown TM. Potential vascular and bleeding complications of treatment with selective serotonin reuptake inhibitors. Psychosomatics. 1996;37(1):12–6. doi: 10.1016/S0033-3182(96)71592-X
56. Ooneda G, Yoshida Y, Suzuki K, et al. Smooth muscle cells in the development of plasmatic arterionecrosis, arteriosclerosis, and arterial contraction. Blood Vessels. 1978;15(1-3):148–56. doi: 10.1159/000158160
57. Bindu S, Mazumder S, Bandyopadhyay U. Non-steroidal anti-inflammatory drugs (NSAIDs) and organ damage: A current perspective. Biochem Pharmacol. 2020;180:114147. doi: 10.1016/j.bcp.2020.114147
58. Park K, Bavry AA. Risk of stroke associated with nonsteroidal anti-inflammatory drugs. Vasc Health Risk Manag. 2014;10:25–32. doi: 10.2147/VHRM.S54159
59. Лекарственнo-индуцированные заболевания. Том II: Монография / под общ. ред. Д. А. Сычёва, О. Д. Остроумовой. — М.: Прометей, 2022. — 536 с.
60. Leasure AC, King ZA, Torres-Lopez V, et al. Racial/ethnic disparities in the risk of intracerebral hemorrhage recurrence. Neurology. 2020;94(3):e314–e322. doi: 10.1212/WNL.0000000000008737
61. O’Donnell MJ, Chin SL, Rangarajan S, et al. Global and regional effects of potentially modifiable risk factors associated with acute stroke in 32 countries (INTERSTROKE): a case-control study. Lancet. 2016;388(10046):761–75. doi: 10.1016/S0140-6736(16)30506-2
62. Skidmore CT, Andrefsky J. Spontaneous intracerebral hemorrhage: epidemiology, pathophysiology, and medical management. Neurosurg Clin N Am. 2002;13(3):281-v. doi: 10.1016/s1042-3680(02)00019-0
63. Iakovou I, Dangas G, Mintz GS, et al. Comparison of frequency of hemorrhagic stroke in patients >75 years versus< or =75 years of age among patients receiving glycoprotein IIb/IIIa inhibitors during percutaneous coronary interventions. Am J Cardiol. 2004;93(3):346–9. doi: 10.1016/j.amjcard.2003.10.018
64. Farooq V, Hegarty J, Chandrasekar T, et al. Serious adverse incidents with the usage of low molecular weight heparins in patients with chronic kidney disease. Am J Kidney Dis. 2004;43(3):531–7. doi: 10.1053/j.ajkd.2003.11.012
65. Huynh T, Cox JL, Massel D, et al. Predictors of intracranial hemorrhage with fibrinolytic therapy in unselected community patients: a report from the FASTRAK II project. Am Heart J. 2004;148(1):86–91. doi: 10.1016/j.ahj.2004.02.006
66. National Institute of Neurological Disorders and Stroke rt-PA Stroke Study Group. Tissue plasminogen activator for acute ischemic stroke. N Engl J Med. 1995;333(24):1581–7. doi: 10.1056/NEJM199512143332401
67. Whiteley WN, Emberson J, Lees KR, et al. Risk of intracerebral haemorrhage with alteplase after acute ischaemic stroke: a secondary analysis of an individual patient data meta-analysis. Lancet Neurol. 2016;15(9):925–33. doi: 10.1016/S1474-4422(16)30076-X
68. Mehta RH, Cox M, Smith EE, et al. Race/Ethnic differences in the risk of hemorrhagic complications among patients with ischemic stroke receiving thrombolytic therapy. Stroke. 2014;45(8):2263–9. doi: 10.1161/STROKEAHA.114.005019
69. Larrue V, von Kummer RR, Müller A, Bluhmki E. Risk factors for severe hemorrhagic transformation in ischemic stroke patients treated with recombinant tissue plasminogen activator: a secondary analysis of the European-Australasian Acute Stroke Study (ECASS II). Stroke. 2001;32(2):438–41. doi: 10.1161/01.str.32.2.438
70. Mazya M, Egido JA, Ford GA, et al. Predicting the risk of symptomatic intracerebral hemorrhage in ischemic stroke treated with intravenous alteplase: safe Implementation of Treatments in Stroke (SITS) symptomatic intracerebral hemorrhage risk score [published correction appears in Stroke. 2012 Sep;43(9):e102]. Stroke. 2012;43(6):1524–31. doi: 10.1161/STROKEAHA.111.644815
71. Nisar T, Hanumanthu R, Khandelwal P. Symptomatic Intracerebral Hemorrhage after Intravenous Thrombolysis: Predictive Factors and Validation of Prediction Models. J Stroke Cerebrovasc Dis. 2019;28(11):104360. doi: 10.1016/j.jstrokecerebrovasdis.2019.104360
72. Maestrini I, Strbian D, Gautier S, et al. Higher neutrophil counts before thrombolysis for cerebral ischemia predict worse outcomes. Neurology. 2015;85(16):1408–16. doi: 10.1212/WNL.0000000000002029
73. Maestrini I, Strbian D, Gautier S, et al. Higher neutrophil counts before thrombolysis for cerebral ischemia predict worse outcomes. Neurology. 2015;85(16):1408–16. doi: 10.1212/WNL.0000000000002029
74. Gensicke H, Al Sultan AS, Strbian D, et al. Intravenous thrombolysis and platelet count [published correction appears in Neurology. 2018 Oct 30;91(18):852]. Neurology. 2018;90(8):e690–e697. doi: 10.1212/WNL.0000000000004982
75. Hughes M, Lip GY; Guideline Development Group for the NICE national clinical guideline for management of atrial fibrillation in primary and secondary care. Risk factors for anticoagulation-related bleeding complications in patients with atrial fibrillation: a systematic review. QJM. 2007;100(10):599–607. doi: 10.1093/qjmed/hcm076
76. Torn M, Algra A, Rosendaal FR. Oral anticoagulation for cerebral ischemia of arterial origin: high initial bleeding risk. Neurology. 2001;57(11):1993–9. doi: 10.1212/wnl.57.11.1993
77. Pisters R, Lane DA, Nieuwlaat R, de Vos CB, Crijns HJ, Lip GY. A novel user-friendly score (HAS-BLED) to assess 1-year risk of major bleeding in patients with atrial fibrillation: the Euro Heart Survey. Chest. 2010;138(5):1093–100. doi: 10.1378/chest.10-0134
78. Ramasubbu R. SSRI treatment-associated stroke: causality assessment in two cases. Ann Pharmacother. 2004;38(7-8):1197–201. doi: 10.1345/aph.1D624
79. Nochaiwong S, Ruengorn C, Awiphan R, et al. Use of serotonin reuptake inhibitor antidepressants and the risk of bleeding complications in patients on anticoagulant or antiplatelet agents: a systematic review and meta-analysis. Ann Med. 2022;54(1):80–97. doi: 10.1080/07853890.2021.2017474
80. Bak S, Tsiropoulos I, Kjaersgaard JO, et al. Selective serotonin reuptake inhibitors and the risk of stroke: a population-based case-control study. Stroke. 2002;33(6):1465–73. doi: 10.1161/01.str.0000018589.56991.ba
81. Wilson D, Charidimou A, Shakeshaft C, et al. Volume and functional outcome of intracerebral hemorrhage according to oral anticoagulant type. Neurology. 2016;86(4):360–6. doi: 10.1212/WNL.0000000000002310
82. Adachi T, Hoshino H, Takagi M, Fujioka S; Saiseikai Stroke Research Group. Volume and Characteristics of Intracerebral Hemorrhage with Direct Oral Anticoagulants in Comparison with Warfarin. Cerebrovasc Dis Extra. 2017;7(1):62–71. doi: 10.1159/000462985
83. Macellari F, Paciaroni M, Agnelli G, Caso V. Neuroimaging in intracerebral hemorrhage. Stroke. 2014;45(3):903–8. doi: 10.1161/STROKEAHA.113.003701
84. Romero J, Rosand J. Hemorrhagic cerebrovascular disease. Handb Clin Neurol. 2016:351–64. doi: 10.1016/b978-0-444-53485-9.00018-0
85. Hemphill JC 3rd, Greenberg SM, Anderson CS, et al. Guidelines for the Management of Spontaneous Intracerebral Hemorrhage: A Guideline for Healthcare Professionals From the American Heart Association / American Stroke Association. Stroke. 2015;46(7):2032–60. doi: 10.1161/STR.0000000000000069
86. Naranjo CA, Busto U, Sellers EM, et al. A method for estimating the probability of adverse drug reactions. Clin Pharmacol Ther. 1981;30(2):239– 45. doi: 10.1038/clpt.1981.154
87. Сычёв Д. А., Остроумова О. Д., Переверзев А. П. и др. Лекарственно-индуцированные заболевания: подходы к диагностике, коррекции и профилактике. Фармаконадзор. Фарматека. 2020;6:113–26. doi: 10.18565/pharmateca.2020.6.113-126
88. Кобалава Ж. Д., Конради А. О., Недогода С. В. и др. Артериальная гипертензия у взрослых. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(3):3786. doi: 10.15829/1560-4071-2020-3-3786
89. Аракелян М. Г., Бокерия Л. А., Васильева Е. Ю. и др. Фибрилляция и трепетание предсердий. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(7):4594. doi: 10.15829/1560-4071-2021-4594
90. rlsnet.ru/drugs [интернет]. РЛС. Реестр лекарственных средств России. Аспирин® Кардио [доступ от 18.06.2022]. Доступ по ссылке: https://www.rlsnet.ru/drugs/aspirin-kardio-7424.
91. rlsnet.ru/drugs [интернет]. РЛС. Реестр лекарственных средств России. Брилинта® [доступ от 18.06.2022]. Доступ по ссылке: https://www.rlsnet.ru/drugs/brilinta-42456.
92. rlsnet.ru/drugs [интернет]. РЛС. Реестр лекарственных средств России. Эффиент® [доступ от 18.06.2022]. Доступ по ссылке: www.rlsnet.ru/drugs/effient-41998.
93. rlsnet.ru/drugs [интернет]. РЛС. Реестр лекарственных средств России. Плавикс® [доступ от 18.06.2022]. Доступ по ссылке: https://www.rlsnet.ru/drugs/plaviks-8690.
94. Российское кардиологическое общество (РКО). Стабильная ишемическая болезнь сердца. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(11):4076. doi:10.15829/29/1560-4071-2020-4076
95. Барбараш О. Л., Дупляков Д. В., Затейщиков Д. А. и др. Острый коронарный синдром без подъёма сегмента ST электрокардиограммы. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(4):4449. doi: 10.15829/1560-4071-2021-4449
96. Российское кардиологическое общество (РКО). Острый инфаркт миокарда с подъёмом сегмента ST электрокардиограммы. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(11):4103. doi: 10.15829/29/1560-4071-2020-4103
97. Шамалов Н. А., Хасанова Д. Р., Стаховская Л. В. и др. Реперфузионная терапия ишемического инсульта. Клинический протокол. — М., 2019. — 80 с.
Об авторах
А. И. ЛистратовРоссия
Листратов Александр Иванович - ординатор 2-го года кафедры терапии и полиморбидной патологии имени академика М.С. Вовси РМАНПО Минздрава России.
Москва.
SPIN-код: 1357-7122
Т. М. Остроумова
Россия
Остроумова Татьяна Максимовна – кандидат медицинских наук, ассистент кафедры нервных болезней и нейрохирургии ПМГМУ им. И.М. Сеченова Минздрава России (Сеченовский университет).
Москва.
SPIN-код: 5043-4713
А. И. Кочетков
Россия
Кочетков Алексей Иванович - кандидат медицинских наук, доцент кафедры терапии и полиморбидной патологии имени академика М.С. Вовси РМАНПО Минздрава России.
Москва.
SPIN-код: 9212-6010
О. Д. Остроумова
Россия
Остроумова Ольга Дмитриевна – доктор медицинских наук, профессор, зав. кафедрой терапии и полиморбидной патологии имени академика М.С. Вовси РМАНПО Минздрава России; профессор кафедры клинической фармакологии и пропедевтики внутренних болезней ПМГМУ им. И.М. Сеченова Минздрава России (Сеченовский университет).
Москва.
SPIN-код: 3910-6585
Рецензия
Для цитирования:
Листратов А.И., Остроумова Т.М., Кочетков А.И., Остроумова О.Д. Лекарственно-индуцированное внутримозговое кровоизлияние. Качественная клиническая практика. 2022;(2):55-68. https://doi.org/10.37489/2588-0519-2022-2-55-68
For citation:
Listratov A.I., Ostroumova T.M., Kochetkov A.I., Ostroumova O.D. Drug-induced intracerebral hemorrhage. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2022;(2):55-68. (In Russ.) https://doi.org/10.37489/2588-0519-2022-2-55-68

















































