Перейти к:
Клинико-экономическое обоснование скрининга на мукополисахаридоз I типа у детей групп риска
https://doi.org/10.37489/2588-0519-2021-3-4-15
Аннотация
Введение. Мукополисахаридоз I типа (МПС I типа) характеризуется значительной клинической гетерогенностью в отсутствии специфических симптомов, что обусловливает трудности его своевременной диагностики. Углубленный скрининг на МПС I типа у детей направлен на раннее выявление и своевременное назначение жизнеспасающей ферментзаместительной терапии.
Целью настоящего исследования была клинико-экономическая оценка целесообразности скрининга на МПС I типа у детей групп риска.
Материалы и методы. Разработана модель для оценки социально-экономического бремени МПС I типа с расчётом затрат на лечение как диагностированных, так и недиагностированных пациентов из групп риска (гепатомегалия и спленомегалия, юношеский [ювенильный] артрит, грыжа паховая и пупочная, кифоз (кифосколиоз), остеохондродисплазия с дефектами роста трубчатых костей и позвоночника) с учётом популяции по каждой группе. Определены с позиции «Общество»: прямые медицинские (затраты на фармакотерапию, амбулаторное наблюдение, плановое стационарное лечение, лечение осложнений в круглосуточном/дневном стационаре, трансплантацию гемопоэтических стволовых клеток; прямые немедицинские (выплаты пособий по инвалидности); непрямые (расходы, связанные со снижением или утратой трудоспособности одного из родителей по уходу за ребенком-инвалидом).
Результаты. Средневзвешенные затраты на 1 диагностированного пациента с мягкими формами МПС I с учётом стоимости селективного скрининга составили 405 974,22 руб., что на 184 421,85 руб. меньше, чем на 1 недиагностированного пациента. Ведение и лечение пациентов с мягкими формами МПС I типа позволит в течение одного года сэкономить до 17,7 млн руб., что в свою очередь даст возможность дополнительно провести скрининг у 705 детей групп риска. С учётом размера популяции пациентов с недиагностированными мягкими формами МПС I типа, в настоящее время расходы на данную группу составляют 56,7 млн руб., при этом «перерасход» бюджетных средств при несвоевременной диагностике МПС I типа для этой когорты детей составляет около 22,6 млн руб. в год.
Выводы. Селективный скрининг у детей из группы риска по МПС I типа экономически оправдан и будет способствовать своевременному началу лекарственной терапии для предупреждения инвалидизации и развития осложнений.
Для цитирования:
Крысанов И.С., Крысанова В.С., Ермакова В.Ю. Клинико-экономическое обоснование скрининга на мукополисахаридоз I типа у детей групп риска. Качественная клиническая практика. 2021;(3):4-15. https://doi.org/10.37489/2588-0519-2021-3-4-15
For citation:
Krysanov I.S., Krysanova V.S., Ermakova V.Yu. Clinical and economic justification of screening for mucopolysaccharidosis type I in children at groups of risks. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2021;(3):4-15. (In Russ.) https://doi.org/10.37489/2588-0519-2021-3-4-15
Введение / Introduction
Мукополисахаридоз I типа (МПС I типа) — наследственная лизосомная болезнь накопления, обусловленная дефицитом фермента альфа-L-идуронидазы и протекающая с различными клиническими проявлениями: задержкой роста, поражением нервной системы, сердечно-лёгочными нарушениями, гепатоспленомегалией, множественными дизостозами и др. По данным Федерального регистра больных редкими (орфанными) заболеваниями [1], распространённость МПС I типа составила 0,07 на 100 тыс. населения. Количество пациентов с установленным диагнозом и входящих в региональные сегменты Федерального регистра составило 101 человек, среди которых высока доля детей (88,9 %). Высокий процент инвалидности при МПС I типа (80,2 %) свидетельствует о поздней диагностике заболевания и несвоевременном начале лечения. Неяркая выраженность симптомов мягких форм МПС I типа приводит к тому, что у значительной доли таких пациентов заболевание не диагностируется долгое время, и такие больные получают лечение не по показаниям, что ведет к нерациональному расходованию средств.
Причиной МПС I типа является мутация в гене IDUA, кодирующем лизосомный фермент альфа-Lидуронидазу, которая носит аутосомно-рецессивный тип наследования. В настоящее время описано более 200 мутаций в гене IDUA, наиболее частые — Q402X и Q70X [2]. Частота мутации Q402X у пациентов с МПС I типа в России составляет 4 % [3], в европейской популяции — 11–38,8 % [4], в США — 39 % [5]. Частота мутации Q70X в европейской популяции составляет 35 % [6].
Вследствие клинической гетерогенности ранняя диагностика МПС I типа наиболее вероятна при тяжёлом течении заболевания, при мягких формах МПС I типа диагноз устанавливается с большим опозданием в связи со стёртой клинической картиной и отсутствием специфических симптомов [7]. В табл. 1 приведено сравнение возраста появления симптомов и постановки диагноза для различных форм МПС I типа по данным международного регистра пациентов [8]. Медиана возраста установления диагноза синдрома Шейе, по данным за 2012 г., составляет 9,4 года [9], синдрома Гурлер-Шейе (данные за 2014 г.) в странах Азии — 1,2–13,1; Европы — 0,9–9,4; Латинской Америки — 1,7–8,5; Северной Америки — 1,0–8,3 года.
Таблица 1
Возраст появления симптомов и постановки диагноза при разных формах МПС I типа [7, 8]
Table 1
Time to onset and diagnostic in different forms of MPS Type I [7, 8]
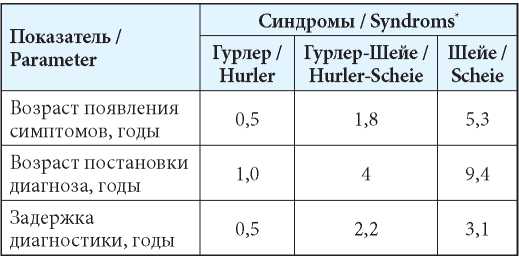
Примечание: *— представлены медианные значения.
Note: *— Medians.
Для мягких форм характерны тугоподвижность и контрактуры суставов, рецидивирующие инфекции верхних дыхательных путей и уха, пупочные грыжи, гепатомегалия и др. [10][11]. В целом, при мягких формах МПС I типа меньше системных проявлений, чем при тяжёлых формах, и поэтому диагностика мягких форм МПС I типа в педиатрии представляет определённую сложность. В настоящее время в РФ скрининг на МПС I типа массово не применяется, что затрудняет своевременную постановку диагноза и жизнеспасающее лечение. Внедрение программы селективного скрининга в группе риска по МПС I типа должно обеспечить раннее выявление таких больных, правильное наблюдение и своевременное назначение ферментзаместительной терапии.
Целью / Aim настоящего исследования была клинико-экономическая оценка целесообразности внедрения селективного скрининга на МПС I типа у детей из группы риска по данному заболеванию.
Задачи / Tasks:
- Провести анализ публикаций по заболеваемости и распространённости МПС I типа и заболеваний из группы риска;
- Провести анализ затрат на проведение скрининга на МПС I типа у детей из группы риска по данному заболеванию согласно перечню «заболеваний-масок»: R16. Гепатомегалия и спленомегалия, не классифицированные в других рубриках, М08. Юношеский [ювенильный] артрит, K40. Грыжа паховая, K42. Грыжа пупочная, M40. Кифоз, M41. Сколиоз (кифосколиоз), Q77. Остеохондродисплазия с дефектами роста трубчатых костей и позвоночника;
- Провести анализ затрат на оказание медицинской помощи пациентам с диагностированным и недиагностированным МПС I типа из группы риска.
Гипотеза исследования / Research hypothesis: проведение углубленного скрининга на МПС I типа у детей группы риска является экономически целесообразным подходом к организации медицинской помощи таким пациентам.
Дизайн исследования / Research design: метод клинико-экономического анализа «стоимость болезни» (англ. cost-of-illness, COI) и анализ влияния на бюджет (англ. budget impact analysis, BIA).
Материалы и методы / Material and methods
В доступных источниках (электронные базы данных Кокрановской библиотеки, MEDLINE и Embase, российская информационно-аналитическая система eLIBRARY.ru.) был проведён поиск работ, посвящённых оценке заболеваемости и распространённости, подходам к оказанию медицинской помощи при МПС I типа и заболеваниях из группы риска в мире и в России. Разработана модель для оценки социально-экономического бремени МПС I типа с расчётом затрат на ведение и лечение пациентов. Оценивалась численность целевой популяции, в частности недиагностированной когорты пациентов с мягкими формами МПС I типа, также была оценена популяция пациентов с заболеваниями группы риска.
Было принято во внимание, что частота заболевания составляет 1 на 100 тыс. новорождённых [1]. Размер недиагностированной популяции пациентов с МПС I типа основан на статистических данных [12] по рождаемости за последние 19 лет с учётом средней продолжительности жизни пациентов с мягкими формами МПС I. Доля пациентов со скрытыми («мягкими») формами МПС I типа составляет около 39 % [13].
Для оценки экономических потерь, связанных с недиагностированным МПС I типа, был выполнен расчёт затрат на лечение «заболеваний-масок».
С учётом позиции исследования «общество» в анализ были включены следующие виды затрат:
- прямые медицинские (затраты на базовую лекарственную терапию, амбулаторное наблюдение, плановое стационарное лечение, лечение осложнений в условиях круглосуточного/дневного стационара или с применением высокотехнологичной медицинской помощи (ВМП), трансплантацию гемопоэтических стволовых клеток (ТГСК));
- прямые немедицинские (выплаты пособий в результате стойкой утраты трудоспособности (инвалидизации), социальная поддержка инвалидов);
- непрямые (расходы, связанные со снижением или утратой трудоспособности одного из родителей, выполняющего обязанности по уходу за ребёнком-инвалидом, инвалидом 1-м группы).
Формула для определения общих затрат:
Cost = DCm + DCnm + IC
где: Cost — общая стоимость; DCm (medical Direct Costs) — прямые медицинские затраты; DCnm (non-medical Direct Costs) — прямые немедицинские затраты; IC (Indirect Costs) — непрямые затраты.
Используя элементы методики утверждённых рекомендаций по проведению анализа влияния на бюджет [14], дополнительно проведен анализ динамики стоимости МПС I типа при расширении скрининга. Определены лекарственные препараты, перечень специалистов для амбулаторного наблюдения и частота посещения [15][16]. Ряд осложнений МПС I типа требует хирургического вмешательства (ВМП). Проведение ТГСК рекомендовано пациентам с МПС IH типа до достижения возраста 2,5 года при нормальных или субнормальных показателях интеллектуального развития [1]. Определено среднее значение норматива — 2 853 193,00 руб., принято допущение, что средняя частота ТГСК в течение 1 года составит 8,9 % [17].
При оценке средневзвешенных затрат на заболевания из группы риска учтены прямые медицинские затраты на амбулаторное ведение, фармакотерапию, стационарную помощь и лечение осложнений с применением ВМП. Затраты на амбулаторную помощь и лекарственные препараты рассчитаны по стандартам [18][19]. Затраты на ряд специфических тестов определены по стоимости платных услуг [20][21]. Данные представлены в табл. 2.
Таблица 2
Затраты на селективный скрининг при гепато- и спленомегалии
Table 2
Costs of screening in hepatomegaly and splenomegaly
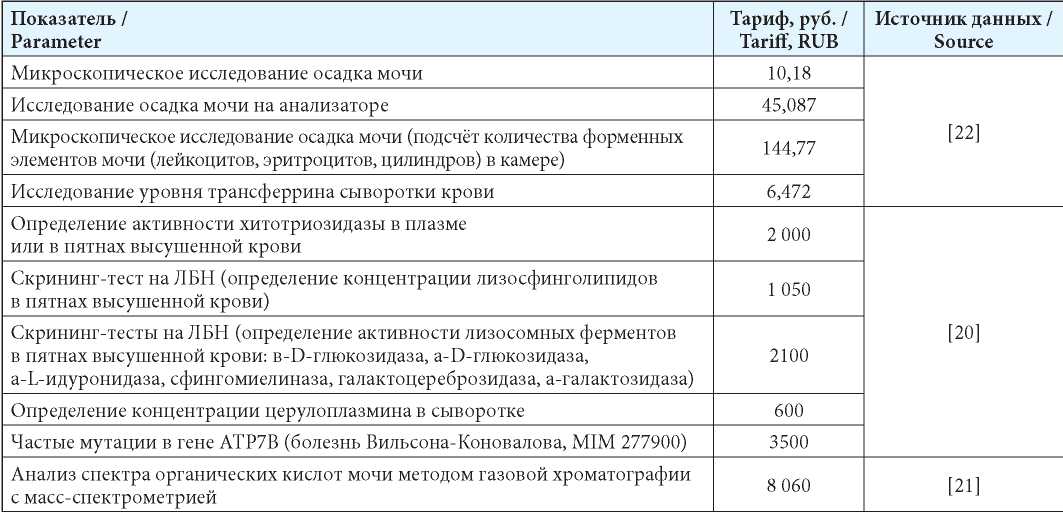
Примечания: ЛБН — лизосомальные болезни накопления; ОМС — обязательное медицинское страхование.
Notes: ЛБН — Lysosomal storage diseases ОМС — Obligatory medical insurance.
Для пациентов с юношеским артритом рассматривались затраты на генно-инженерные биологические препараты (ГИБП) (табл. 3) с учётом режима дозирования в соответствии с официальной инструкцией по медицинскому применению [23]. Частота назначения препаратов была установлена в соответствии со стандартом [19].
Таблица 3
Затраты на терапию ГИБП при юношеском артрите
Table 3
Costs of biological therapy in juvenal arthritis
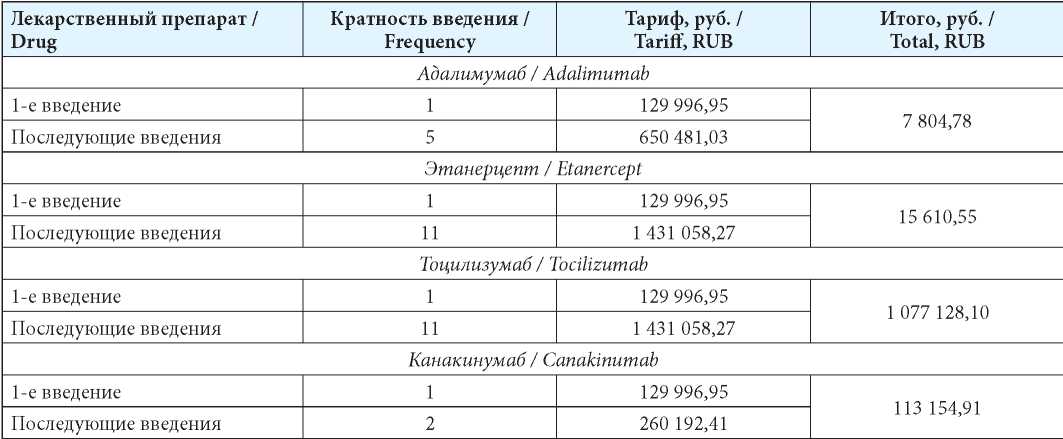
Затраты на базовую лекарственную терапию определены по Государственному реестру предельных отпускных цен [24], с учётом средневзвешенного размера предельной оптовой надбавки (11,39 %) и НДС (10 %) [25][26]. Для препаратов, не включённых в перечень ЖНВЛП, расчёт затрат проведен на основании данных «ФАРМ-индекс» [27]. Затраты на амбулаторную помощь рассчитывались по тарифам [28] на 1 обращение в амбулаторных условиях — 1 505,10 руб. из расчёта 4 обращения в год.
Затраты на стационарное лечение рассчитывали на основании норматива финансовых затрат на один случай лечения в условиях круглосуточного/дневного стационара [29][30] (табл. 4) по формуле:
С = H × КЗ × ПК
где: С — средняя стоимость законченного случая госпитализации; H — средний норматив финансовых затрат на 1 случай госпитализации;
КЗ — коэффициент затратоёмкости КСГ;
ПК — поправочный коэффициент (для дневного стационара — 0,6, для круглосуточного стационара — 0,65).
Таблица 4
Затраты на стационарное лечение
Table 4
Hospitalization costs
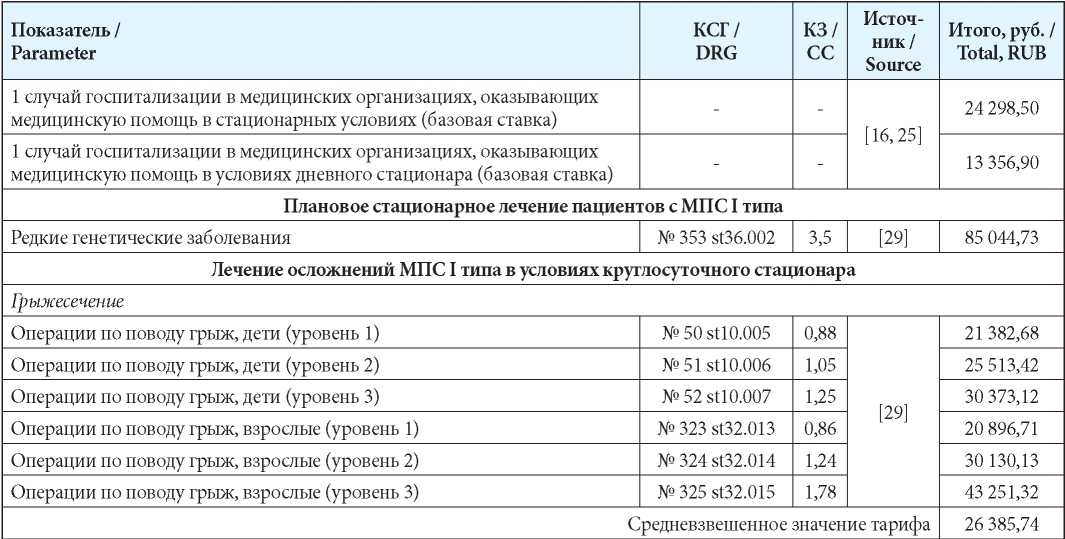
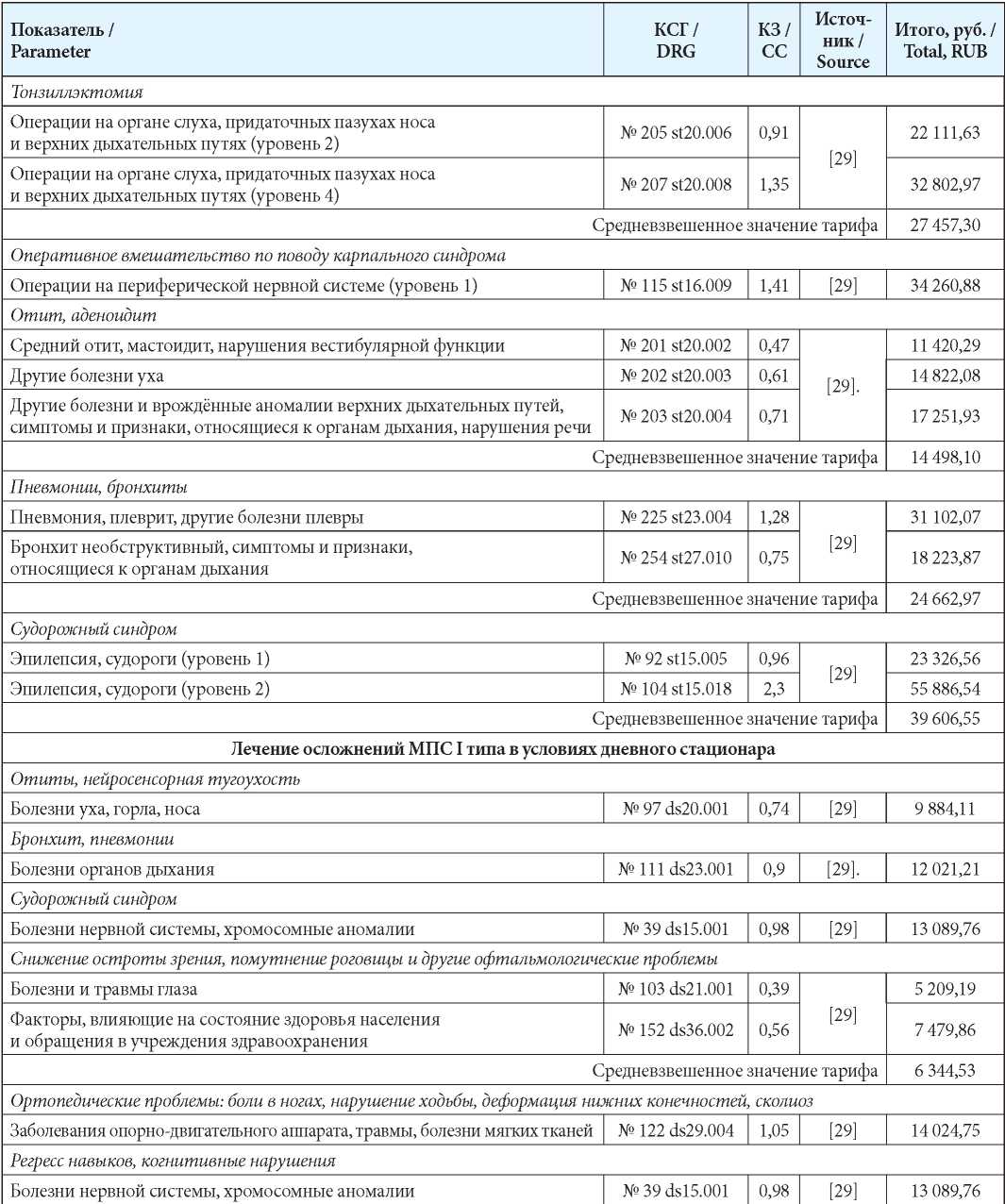
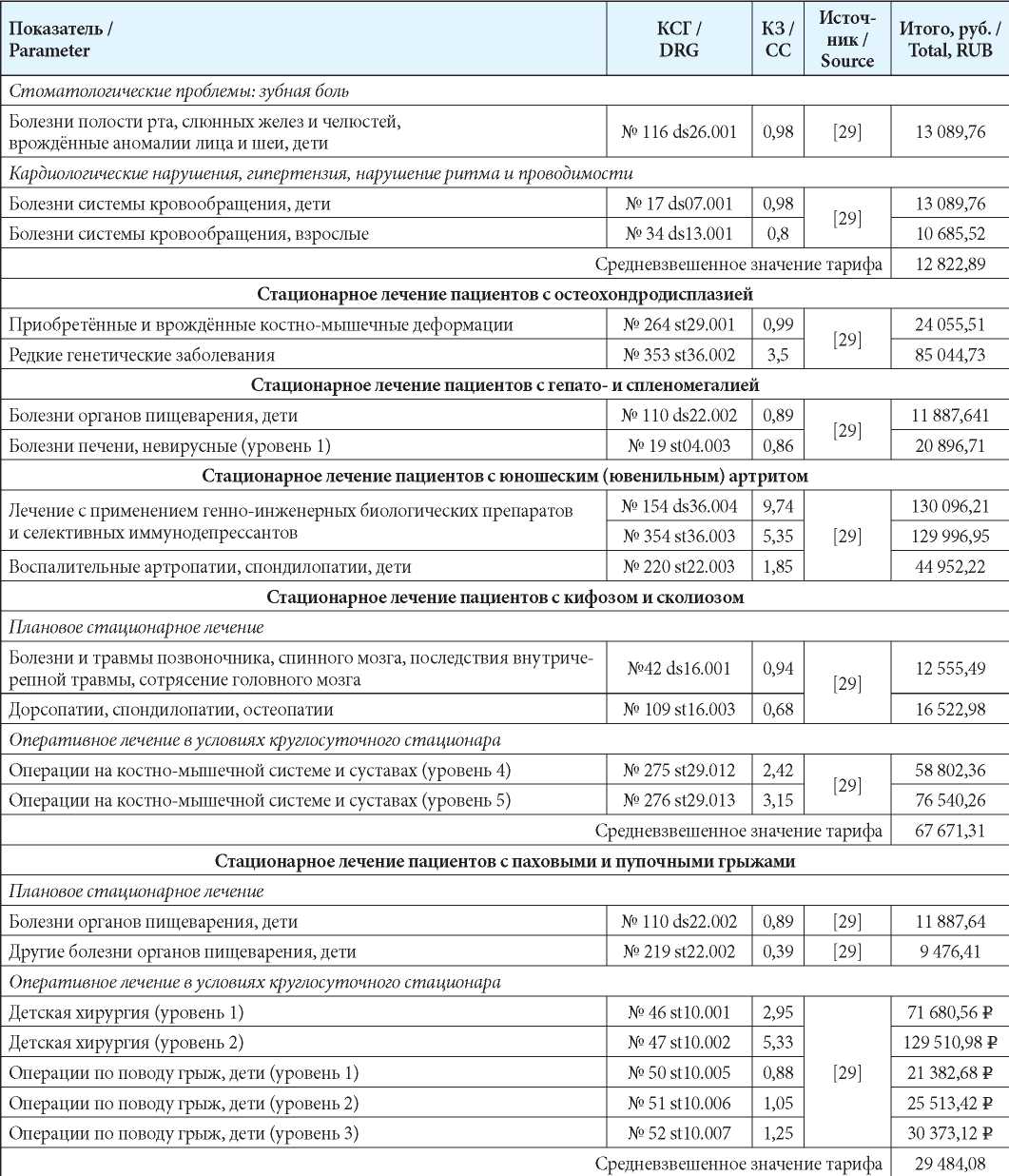
Примечания: КЗ – коэффициент затратоемкости; КСГ — клинико-статистическая группа.
Notes: КЗ – CC-ratio of expenditures; КСГ — DRG — Diagnosed relation group.
Средние затраты на ВМП определены на основе [16] с учётом частоты для мягких форм МПС I типа в 10 %.
Учёт прямых немедицинских затрат предусматривал размеры пенсий по инвалидности и социальную поддержку инвалидов [31] по о частоте инвалидизации (80,2 %, среди которых пациенты детского возраста 72,5 %, инвалиды 1-й группы — 42,9 %, инвалиды 2-й группы — 42,9 %, инвалиды 3-й группы — 14,3 %) [1].
Непрямые (косвенные) затраты рассчитывались как потери валового внутреннего продукта (ВВП) вследствие нетрудоспособности одного из родителей, исходя из подушевого ВВП 749 813,04 руб. [12].
Было рассчитано общее экономическое бремя для диагностированной и недиагностированной популяции пациентов с МПС I типа по формуле:
Bur = N × Cost
где: Bur — экономическое бремя рассматриваемой патологии, руб.;
N — количество пациентов, чел.;
Cost — средневзвешенные затраты на ведение и лечение 1 пациента с диагностированным и недиагностированным МПС I типа, руб.
Результаты / Results
Размер популяции пациентов с диагностированным МПС I типа — 101 человек [1]. Ориентировочная численность популяции недиагностированных пациентов с мягкими формами МПС I типа, рождённых за последние 19 лет, оценивается в 96 человек.
Для оценки экономической целесообразности углубленного скрининга был проведён анализ размера популяции пациентов из группы риска по МПС I типа с учётом отечественных данных об их уровне заболеваемости и распространённости.
В работе Залетиной А.В. и др., 2018 г. [32] показано, что среднее значение распространённости остеохондродисплазии с дефектами роста позвоночного столба в 55 регионах РФ составило 0,6 ± 0,6 случая на 100 тыс. детского населения. Оценка распространённости гепатоспленомегалии была представлена в работе Котович М.М. и др., 2016 г. [33] в ходе одномоментного исследования 5 178 детей в возрасте от 1 месяца до 17 лет и составила 1,7 на 1000 осмотренных лиц. Также в ходе данной работы проводился анализ причин развития и нозологической структуры гепатолиенального синдрома. При этом среди всех причин гепатоспленомегалии доля заболеваний, в рамках которых может быть проведена дифференциальная диагностика с МПС I типа, составила 38,5 %. Ювенильный артрит является одним из наиболее частых и самых инвалидизирующих ревматических заболеваний, встречающихся у детей [34]. По официальным статистическим данным в 2019 году заболеваемость юношеским артритом среди детей в возрасте от 0 до 14 лет составила 14,9 случаев на 100 тыс. детского населения (или 3 853 ребёнка) [35], а в возрасте от 15 до 17 лет — 35,9 на 100 тыс. детского населения (или 1 532 подростка) [36].
В 2019 году заболеваемость деформирующими дорсопатиями среди детей в возрасте от 0 до 14 лет составила 738,1 случаев на 100 тыс. детского населения (или 19 1471 ребенка), а в возрасте от 15 до 17 лет — 1978,6 на 100 тыс. детского населения (или 84 544 подростка). В работе Ульрих Э.В. и др., 2009 г. [37] было показано, что среди врождённых деформаций позвоночника доля сколиозов составляет 2,5 %.
Согласно статистическим данным, в 2019 году заболеваемость болезнями органов пищеварения среди детей в возрасте от 0 до 14 лет составила 5 966,7 случаев на 100 тыс. детского населения (или 1 547 919 ребёнка) [35], а в возрасте от 15 до 17 лет — 6 353,1 на 100 тыс. детского населения (или 271 463 подростка) [36]. По материалам популяционного исследования, выполненного в Иране, частота пупочных грыж у детей составила около 0,3 % [38]. Паховые грыжи у детей являются одним из частых врождённых хирургических заболеваний, распространённость которого составляет около 5 % среди детского населения, при этом среди числа всех видов грыж у детей паховые составляют 92—95 % [39].
Результаты оценки численности популяции детей из группы риска представлены в таблице 5. Общий размер группы риска по МПС I составил 128 670 детей.
Таблица 5
Результаты оценки популяции пациентов из группы риска по МПС I типа
Table 5
Population of group of risks for MPS Type I
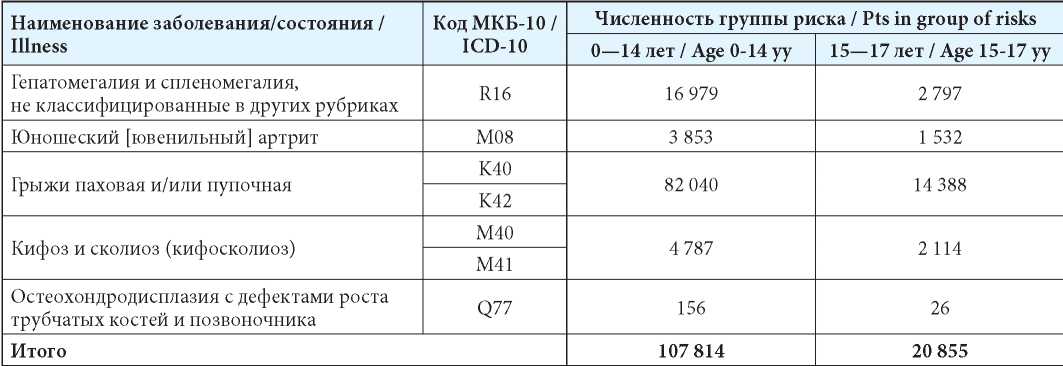
Примечание: МКБ — международная классификация болезней.
Note: ICD — International Classifi cation of Diseases.
Результаты анализа затрат, связанных с ведением пациентов с диагностированным МПС I типа представлены в таблице 6. Общие затраты на ведение и лечение 1 пациента с синдромом Гурлер составили 1 930 340,85 руб., с синдромом Гурлер-Шейе — 1 121 486,96 руб., с синдромом Шейе — 686 827,77 руб.
Суммарные затраты на всю диагностированную популяцию пациентов с МПС I типа на территории РФ (101 чел.) составили около 157,4 млн руб. в год, без учёта затрат на проведение патогенетической терапии, так как в настоящее время обеспечение больных лекарственным препаратом МНН ларонидаза осуществляется за счёт бюджетных ассигнований, предусмотренных в федеральном бюджете. С учётом ориентировочного количества пациентов с мягкими формами МПС I типа в РФ (39 человек) общие затраты на данную группу пациентов составляют 38,1 млн руб., из которых более 89 % приходится на пациентов детского возраста. Доля затрат на мягкие формы МПС I типа в общей структуре составила 24 % (табл. 6).
Таблица 6
Результаты анализа затрат на 1 пациента с диагностированным МПС I типа (руб./пациент/год)
Table 6
Results of costs analysis in diagnosed MPS Type I (RUB/patient/year)
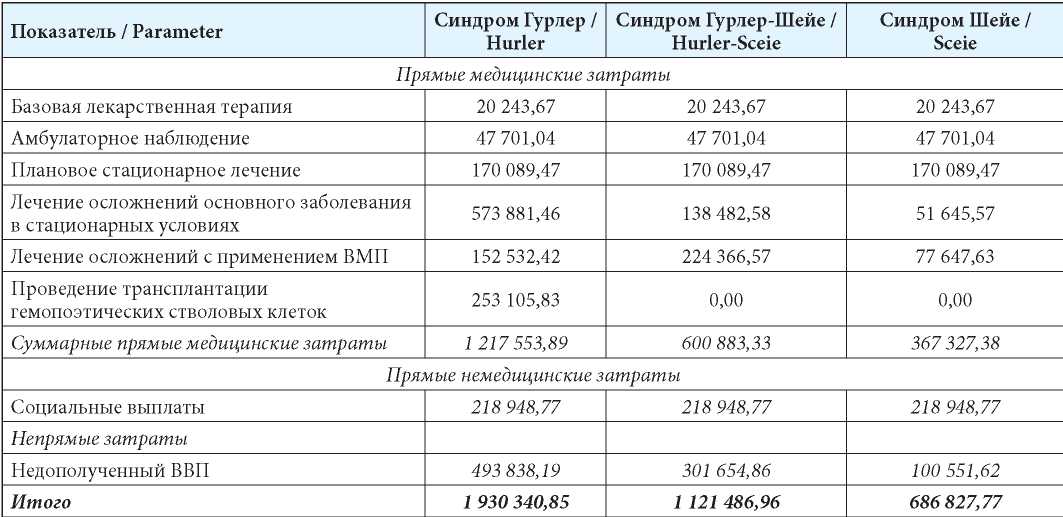
Примечания: ВМП — высокотехнологичная медицинская помощь; ВВП — валовый внутренний продукт.
Notes: ВМП — High Technology Aid; ВВП — GDP.
Cредневзвешенные затраты на 1 диагностированного пациента с мягкими формами МПС I типа составили 380 874,22 руб.
Результаты анализа затрат, связанных с ведением пациентов с недиагностированным МПС I типа представлены в таблице 7. Среди заболеваний группы риска наибольшие затраты на 1 пациента связаны с юношеским артритом — 1 338 013,56 руб., наименьшие — с паховой и/или пупочной грыжами (78 232,59 руб.). Среднее значение затрат на лечение и ведение 1 пациента с заболеваниями из группы риска составило 387 745,20 руб. При оценке затрат на заболевания из группы риска оценивались только прямые медицинские затраты, доля затрат на «маскирующие» заболевания в общей структуре составила 66 %. Остальная доля пришлась на затраты, связанные с естественным течением МПС I типа (111 148,89 руб.) и непрямые затраты (91 501,97 руб.).
Таблица 7
Затраты на 1 пациента с недиагностированным МПС I типа
Table 7
Costs of 1 nondiagnosed patient in MPS I (RUB/year)
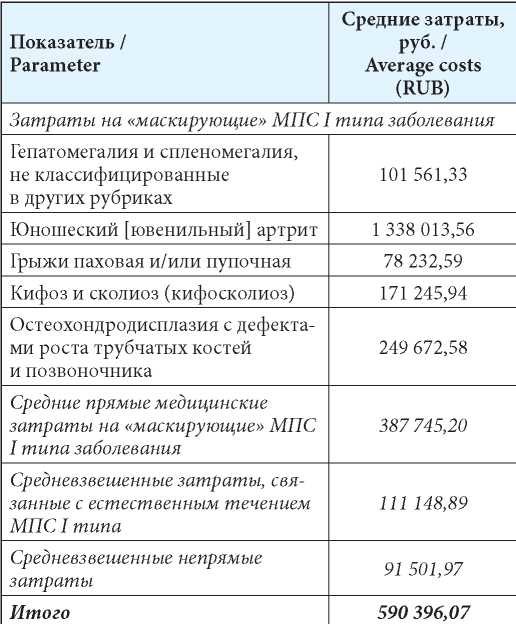
Таким образом, средневзвешенные затраты на 1 недиагностированного пациента с мягкими формами МПС I типа составили 590 396,07 руб. Разница в средневзвешенных затратах на 1 пациента в зависимости от статуса составила 209 521,85 руб.
С учётом размера популяции пациентов с недиагностированными мягкими формами МПС I типа (96 человек), в настоящее время расходы на данную группу составляют 56,7 млн руб. в год. При этом если сопоставить данную сумму с затратами на диагностированную популяцию детского возраста с мягкими формами МПС I типа, которые составили около 34 млн руб. в течение года, то разница составит 22,6 млн руб.
При своевременной диагностике появляется основание для ферментзаместительной терапии препаратом ларонидаза (МНН), организации наблюдения за пациентами в соответствии с клиническими рекомендациями. Затраты на селективный скрининг были определены в 25 100 руб. для 1 пациента. Таким образом, при условии проведения селективного скрининга средневзвешенные затраты на 1 диагностированного пациента с мягкими формами МПС I типа составят 405 974,22 руб., что на 184 421,85 руб. меньше, чем средние затраты на 1 недиагностированного пациента. Ведение и лечение пациентов с мягкими формами МПС I типа позволит в течение года сэкономить до 17,7 млн руб., что в свою очередь даст возможность дополнительно провести селективный скрининг порядка 705 пациентам.
Обсуждение / Discussion
Зарубежный опыт показал, что проведённые мероприятия по скринингу МПС I типа в ряде стран позволили не только уточнить истинную частоту встречаемости, но и обеспечили пациентов своевременной терапией. Например, в исследовании Gragnaniello V et al [40] были представлены первые результаты 5-летней программы скрининга новорождённых на МПС I типа. В работе Савостьянова К.В. [41] был проведён селективный скрининг 31 447 пациентов с подозрением на редкие наследственные болезни и анализ данных 26 протипированных вне скрининга пациентов, среди обследованных с подозрением на МПС I типа 3 940 человек диагноз был поставлен 30 пациентам, частота обнаружения МПС I типа составила 0,76 %.
В нашей стране было проведено пилотное исследование по формированию критериев выявления МПС I типа в рутинной клинической практике педиатров с анкетированием 75 пациентов с подтверждённым диагнозом МПС I типа и с подозрением на него, а также были проанализированы данные ещё 738 пациентов из разных регионов РФ, обследованных в 2017 году. Частота выявления пациентов с МПС I типа среди детей групп риска при генетическом анализе была равной 1 на 105 обследованных. На основании этого исследования были выделены наиболее важные признаки, позволяющие заподозрить МПС I типа, с формированием балльной шкалы для направления на селективный скрининг.
В проведённом нами исследовании показано, что выявление пациентов с МПС I типа путём селективного скрининга в группах риска позволит сэкономить бюджетные средства в связи со снижением затрат на ведение и лечение пациентов с недиагностированным МПС I типа, на которых в настоящее время ежегодно нерационально расходуется «лишних» 22,6 млн руб.
Выводы / Conclusion
- Селективный скрининг у детей из группы риска по МПС I типа экономически оправдан и будет способствовать своевременному началу ферментзаместительной терапии для предупреждения осложнений и ранней инвалидизации;
- Средневзвешенные годовые затраты на 1 диагностированного пациента с мягкими формами МПС I типа с учётом стоимости селективного скрининга составили 405 974,22 руб., что на 184 421,85 руб. меньше, чем средние затраты на 1 недиагностированного пациента. Ведение и лечение пациентов с мягкими формами МПС I типа после проведения селективного скрининга позволит в течение года сэкономить до 17,7 млн руб., что в свою очередь даст возможность дополнительно провести селективный скрининг у 705 пациентов;
- С учётом размера популяции пациентов с недиагностированными мягкими формами МПС I типа расходы на данную группу составляют 56,7 млн руб. При этом, если сопоставить данную сумму с затратами на диагностированную популяцию детского возраста с мягкими формами МПС I типа, которые составили около 34 млн руб. в течение года, «перерасход» бюджетных средств при несвоевременной диагностике МПС I типа для этой когорты детей составляет около 22,6 млн руб. в год.
Конфликт интересов. Работа выполнена при поддержке АО «Санофи Россия», при этом получены независимые результаты.
Conflict of interest. Th is work has been supported by JSC Sanofi Russia, results are independent.
Участие авторов. Крысанов И.С. — разработка концепции исследования, научное консультирование, редактирование текста рукописи; Крысанова В.С. — обзор литературы по теме, расчёты, анализ и интерпретация результатов, написание статьи; Ермакова В.Ю. — сбор и обработка материала.
Participation of authors. Krysanov IS — concept, scientific consultation, editing of the manuscript; Krysanova VS — literature review, calculation, interpretation of results, writing of the manuscript; Ermakova VYu — sources and working with materials.
Список литературы
1. Ежегодный бюллетень Экспертного совета по редким (орфанным) заболеваниям. Комитет Государственной Думы по охране здоровья. Государственная Дума Федерального Собрания Российской Федерации. Москва: 2020. [Ezhegodnyj byulleten’ Ekspertnogo soveta po redkim (orfannym) zabolevaniyam. Komitet Gosudarstvennoj Dumy po ohrane zdorov’ya. Gosudarstvennaya Duma Federal’nogo Sobraniya Rossijskoj Federacii. Moskva: 2020. (In Russ).]. Доступно по: https://vspru.ru/media/1094639/byulleten_po_ redkim_zabolevaniyam_2020_.pdf (обращение к ресурсу 02.02.2021).
2. Khan SA, Peracha H, Ballhausen D et al. Epidemiology of mucopolysaccharidoses. Mol Genet Metab. 2017;121(3):227-240. doi: 10.1016/j.ymgme.2017.05.016.
3. Voskoboeva EY, Krasnopolskaya XD, Mirenburg TV et al. Molecular genetics of mucopolysaccharidosis type I: Mutation analysis among the patients of the former Soviet Union. Mol Genet Metab. 1998;65(2):174-80. doi: 10.1006/mgme.1998.2745.
4. Bertola F, Filocamo M, Casati G et al. IDUA mutational profiling of a cohort of 102 European patients with mucopolysaccharidosis type I: Identification and characterization of 35 novel α-L-iduronidase (IDUA) alleles. Hum Mutat. 2011;32(6):E2189-210. doi: 10.1002/humu.21479.
5. Li P, Wood T, Thompson JN. Diversity of mutations and distribution of single nucleotide polymorphic alleles in the human α-L-iduronidase (IDUA) gene. Genet Med. 2002;4(6):420-6. doi: 10.1097/00125817-200211000-00004.
6. Bunge S, Kleijer WJ, Steglich C et al. Mucopolysaccharidosis type I: Identification of 8 novel mutations and determination of the frequency of the two common α-L-iduronidase mutations (W402X and Q70X) among european patients. Hum Mol Genet. 1994;3(6):861-6. doi: 10.1093/hmg/3.6.861.
7. Buchinskaya NV, Kostik MM, Kolobova OL, Melnikova LN. How not to miss the mild forms of mucopolysaccharidosis type i in patients with articular manifestations of the disease? Curr Pediatr. 2018;17(6):473-439. doi: 10.15690/vsp.v17i6.1978
8. Beck M, Arn P, Giugliani R et al. The natural history of MPS I: global perspectives from the MPS I Registry. Genet Med. 2014;16(10):759-65. doi: 10.1038/gim.2014.25.
9. D’Aco K, Underhill L, Rangachari L et al. Diagnosis and treatment trends in mucopolysaccharidosis I: Findings from the MPS I registry. Eur J Pediatr 2012;171(6):911-9. doi: 10.1007/s00431-011-1644-x.
10. Bruni S, Lavery C, Broomfield A. The diagnostic journey of patients with mucopolysaccharidosis I: A real-world survey of patient and physician experiences. Mol Genet Metab Rep. 2016;8:67-73. doi: 10.1016/j.ymgmr.2016.07.006
11. Tylki-Szymańska A, De Meirleir L, Di Rocco M et al. Easy-to-use algorithm would provide faster diagnoses for mucopolysaccharidosis type I and enable patients to receive earlier treatment. Acta Paediatr. 2018;107(8):1402-1408. doi: 10.1111/apa.14417.
12. Федеральная служба государственной статистики. [Federal Statistic Service (In Russ).]. https://rosstat.gov.ru/ (обращение к ресурсу 04.02.2021).
13. Вашакмадзе НД. Мультидисциплинарные принципы ведения детей с мукополисахаридозами в повышении эффективности их диагностики и лечения: Автореферат диссертации … доктора медицинских наук: 14.01.08 — Педиатрия. Москва; 2019. [Vashkamadze ND. Multipisciplinarnie ptincipi vedeniya detey c mukopolisackaridozomami v povishenii effectivnosti ih diagnostiki i licheniya. [dissertation] Pediatriya. Moscow; 2019. (In Russ).]. Доступно по: https://viewer.rusneb.ru/ru/000199_000009_008703814?page=1&rotate=0&theme=white (обращение к ресурсу 17.01.2021).
14. Омельяновский В.В., Авксентьева М.В., Сура М.В. и др. Методические рекомендации по оценке влияния на бюджет в рамках реализации программы государственных гарантий бесплатного оказания гражданам медицинской помощи. ФГБУ «ЦЭККМП» Минздрава России; Москва: 2018: 40с. [Omelyanovskiy VV, Avksentyeva MV, Sura MV et al. Guidelines for budget impact analysis in frames State Guaranties of the free medical aid programm realisation. FGBU; Moscow: 2018. (In Russ).]. Доступно по: https://rosmedex.ru/wp-content/uploads/2019/06/MR-AVB_novaya-redaktsiya_2018-g..pdf (обращение к ресурсу 17.01.2021).
15. Приказ Министерства здравоохранения РФ от 11 октября 2018 года №694н “Об утверждении стандарта первичной медико-санитарной помощи детям при мукополисахаридозе I типа (ферментная заместительная терапия)” 2018. [Order of Minzdrav Russia October 11,2018 #694N “Standard of primari medical aid in mucopolysaccharidosis type I in children (enzyme replacement therapy)”. 2018 (In Russ).].
16. Постановление Правительства Российской Федерации № 2299 от 28 декабря 2020 г. “О Программе государственных гарантий бесплатного оказания гражданам медицинской помощи на 2021 год и на плановый период 2022 и 2023 годов.” Москва: 2021 [Govt Order #2299 28.12.2020 “About the Program of state guarantees of free provision of medical care to citizens for 2021 and for the planning period of 2022 and 2023. Moscow, 2021 (In Russ).].
17. Боровкова АС, Киргизов КИ, Скоробогатова ЕВ и др. Аллогенная трансплантация гемопоэтических стволовых клеток у детей с синдромом Гурлер. Доктор.Ру. Гематология. 2016;5(122):40-44. [Borovkova AS, Kirgizov KI, Skorobogatova EV et al. Allogeneic hematopoietic stem-cell transplantation in children with Hurler`s syndrome. Doctor.Ru. 2016;5(122):40-44. (In Russ.) Доступно по: https://journaldoctor.ru/catalog/terapiya/allogennayatransplantatsiya-gemopoeticheskikh-stvolovykh-kletok-u-detey-s-sindromomgurler-/#tab1 (обращение к ресурсу 17.01.2021).
18. Приказ Министерства здравоохранения РФ от 9 ноября 2012 г. №857н “Об утверждении стандарта первичной медико-санитарной помощи детям при задержке роста.”[Order of Minzdrav Russia November 9,2012 #857N “Standard of primari medical aid in growth retardation in children” (In Russ).].
19. Приказ Министерства здравоохранения РФ от 29 декабря 2018 г. N953н “Об утверждении стандарта первичной медико-санитарной помощи детям при юношеском артрите с системным началом” [Order of Minzdrav Russia 29.12.2018 #953N “Standard of primari medical aid in uvenial arthritis with systemic onset in children” (In Russ).].
20. Медико-генетический научный центр имени академика Н.П. Бочкова [Medical-Gene Center named by academician Bochkov NP (In Russ).]. Доступно по: https://med-gen.ru/ (дата обращения 22.02.2021).
21. Медицинская компания ИНВИТРО. Клинико-диагностические лаборатории [INVITRO medical company (In Russ).]. Доступно по: https://www.invitro.ru/ (дата обращения 22.02.2021).
22. Постановление Правительства Москвы от 30.12.2020 №2401-ПП «О территориальной программе государственных гарантий бесплатного оказания гражданам медицинской помощи в городе Москве на 2021 г и на плановый период 2022 и 2023 годов» [Govt of Moscow Order #2401-PP 30.12.2021 “Territorial Program of state guarantees of free provision of medical care to the Moscow citizens for 2021 and for the planning period of 2022 and 2023 (In Russ).]. Доступно по: https://mosgorzdrav.ru/ru-RU/targets/default/card/19.html (дата обращения 22.02.2021).
23. Государственный реестр лекарственных средств [The Govt Drugs’ Reestr (In Russ).]. Доступно по: http://grls.rosminzdrav.ru/grls.aspx. (дата обращения 22.02.2021).
24. Государственный реестр предельных отпускных цен [The Govt maximal prices’ Reestr (In Russ).]. Доступно по: http://grls.rosminzdrav.ru/ PriceLims.aspx (дата обращения 22.02.2021).
25. Омельяновский В.В., Авксентьева М.В., Сура М.В., Ивахненко О.И. Методические рекомендации по расчету затрат при проведении клинико-экономических исследований лекарственных препаратов. ФГБУ «ЦЭККМП»; Москва: 2017, 24с. [Omelyanovskiy VV, Avksentyeva MV, Sura MV, Ivakhnenko OI The guidelines for costs calculation in clinical-economic investigations of drugs. FGBU; Moscow: 2017. (In Russ).].
26. Предельные размеры оптовых надбавок и предельные размеры розничных надбавок к ценам на жизненно необходимые и важнейшие лекарственные препараты, установленные в субъектах Российской Федерации (данные по состоянию на 21.10.2020). [Maximal whlesalers’ mark-ups for EDL in Regions of Russia (In Russ).]. Доступно по: https://fas.gov.ru/documents/b-n-5d7183c4-9786-4fc1-9d30-3f3453513bc0 (дата обращения 16.02.2021).
27. ФАРМ-индекс. Российский фармацевтический портал [FARM-index. The Russian pharma portal (In Russ).]. Доступно по: https://www.pharmindex. ru/ (дата обращения 21.02.2021).
28. Комиссия по разработке Территориальной программы обязательного медицинского страхования города Москвы. Тарифное соглашение на оплату медицинской помощи, оказываемой по территориальной программе обязательного медицинского страхования города Москвы на 2021. [The Commission for the development of the Territorial program of obligatory medical insurance of the city of Moscow. Tariff agreement for payment of medical care provided under the territorial program of obligatory medical insurance of the city of Moscow for 2021 (In Russ).]. Доступно по: https://www.mgfoms.ru/strahovye-kompanii/tarifi/2021 (дата обращения 03.03.2021).
29. Федеральный Фонд обязательного медицинского страхования. Методические рекомендации по способам оплаты медицинской помощи за счет средств обязательного медицинского страхования. Протокол заочного заседания членов рабочей группы от 29 декабря 2020 г. №06/11/8. 2020. [Federal Obligatory Medical Insurance Fund. Guidelines on ways for payment for medical care at the expense of obligatory medical insurance. Minutes of the meeting of the working group members dated December 29, 2020 No. 06/11/8. 2020 (In Russ).]. Доступно по: http://www.consultant.ru/document/cons_doc_LAW_373747/ (дата обращения 03.03.2021).
30. Омельяновский В.В., Авксентьева М.В,. Сура М.В. и др. Методические рекомендации по проведению сравнительной клинико-экономической оценки лекарственного препарата (новая редакция). ФГБУ «ЦЭККМП»; Москва: 2018, 45с. [Omelyanovskiy VV, Avksentyeva MV, Sura MV et al. Guidelines for comparative clinical-economic drug evaluation (new edition). FGBU; Moscow: 2018. (In Russ).]. Доступно по: https://rosmedex.ru/wpcontent/uploads/2019/06/MR-KE%60I_novaya-redaktsiya_2018-g..pdf (дата обращения 06.03.2021).
31. Пенсионный фонд Российской Федерации [The Pension Fund of the Russian Federation (In Russ).]. Доступно по: https://pfr.gov.ru/ (дата обращения 19.02.2021).
32. Залетина А.В., Виссарионов С.В., Баиндурашвили А.Г., Садовой М.А., Соловьева К.С., Овечкина А.В., Кокушин Д.Н. Распространенность врожденных пороков развития позвоночника у детей в регионах Российской Федерации. Международный журнал прикладных и фундаментальных исследований. 2018;4:63-66. [Zaletina AV, Vissarionov SV, Baindurashvili AG, Sadovoy MA, Soloveva KS, Ovechkina AV, Kokushin DN. Prevalence of congenital malformations of the spine in children in the regions of the Russian Federation. Int J Appl Fundam Res. 2018;4:63-66. (In Russ).]. doi: 10.17513/mjpfi.12184.
33. Котович М.М., Манеров Ф.К., Лучшева Е.В. Нозологические аспекты гепатомегалии и спленомегалии в детском возрасте. Российский Журнал Гастроэнтерологии, Гепатологии, Колопроктологии. 2016;26(1):54-58. [Kotovich MM, Manerov FK, Luchsheva EV. Nosological aspects of hepatomegaly and splenomegaly at pediatric age. Russian Journal of Gastroenterology, Hepatology, Coloproctology. 2016;26(1):54-58. (In Russ.)] doi: 10.22416/1382-4376-2016-26-1-54-58.
34. Баранов А.А., Алексеева Е.И., Бзарова Т.М. и др. Протокол ведения пациентов с ювенильным артритом. Вопросы Современной Педиатрии. 2013;12(1):37-56. [Baranov AA, Alekseeva EI, Bzarova TM et al. Management protocol for patients with juvenile arthritis. Voprosy sovremennoi pediatrii — Current Pediatrics. 2013;12(1):37-56. (In Russ).].
35. Александрова Г.А., Голубев Н.А., Тюрина Е.М. и др. Заболеваемость детского населения России (0-14 лет) в 2019 году. Статистические материалы. Часть V. Москва: 2020. [Aleksandrova GA, Golubev NA, Tyurina EM et al. Morbidity of the Russian child population (0-14 years old) in 2019. Statistical materials. Chapter V. Moscow: 2020 (In Russ).].
36. Александрова Г.А., Голубев Н.А., Тюрина Е.М. и др. Заболеваемость детского населения России (15-17 лет) в 2019 году. Статистические материалы. Часть IX. Москва: 2020. [Morbidity of the Russian child population (0-14 years old) in 2019. Statistical materials. Chapter IX. Moscow: 2020 (In Russ).].
37. Ульрих Э.В., Мушкин А.Ю., Губин А.В. Врожденные деформации позвоночника у детей: прогноз эпидемиологии и тактика ведения. Хирургия позвоночника. 2009;(2):55-61. [Ulrikh EV, Mushkin AYu, Gubin AV. Congenital Spine Deformities in Children: Epidemiological Prognosis and Management. Hir. Pozvonoc. 2009;(2):55-61. (In Russ).]. doi: 10.14531/ss2009.2.55-61.
38. Askarpour S, Ostadian N, Javaherizadeh H, Chabi S. Omphalocele, gastroschisis: Epidemiology, survival, and mortality in Imam Khomeini Hospital, Ahvaz-Iran. Pol Przegl Chir. 2012;84(2):82-5. doi: 10.2478/v10035-012-0013-4.
39. Воробьев В.В., Костенко В.Н. Аномалии развития влагалищного отростка у детей (паховые грыжи, водянка оболочек яичка, семенного канатика). ДМЖ. 2004:29-34. [Vorobiov VV, Kostenko VN Anomalous formation of peritoneum vaginal process in children (inguinal hernia, hydrocele, funicular hydrocele). DMJ. 2004:29-34. (In Russ).]. Доступно по: http://www.fesmu.ru/SITE/files/editor/file/dmj/2004/200402/200402_09.pdf (дата обращения 03.03.2021).
40. Gragnaniello V, Gueraldi D, Rubert L et al. Report of Five Years of Experience in Neonatal Screening for Mucopolysaccharidosis Type I and Review of the Literature. Int J Neonatal Screen. 2020;6(4):85. doi: 10.3390/ijns6040085.
41. Савостьянов КВ. Оптимизация молекулярной диагностики редких наследственных болезней у российских пациентов: Автореф. диссертации … доктора биологических наук: 03.02.07. Москва; 2021. [Savostyanov KV Optimization of molecular diagnostics of rare hereditary diseases in Russian patients. Mocsow; 2021 (In Russ).]. Доступно по: https://www.dissercat.com/content/optimizatsiya-molekulyarnoi-diagnostiki-redkikh-nasledstvennykhboleznei-u-rossiiskikh-patsi (дата обращения 03.03.2021).
Об авторах
И. С. КрысановРоссия
Крысанов Иван Сергеевич, к. ф. н., доцент, заведующий кафедрой фармации
SPIN-код: 1290-4976
Москва
В. С. Крысанова
Россия
Крысанова Вера Сергеевна, аспирант кафедры клинической фармакологии и пропедевтики внутренних болезней Института клинической медицины им. Н.В. Склифосовского; н. с.; преподаватель кафедры терапии и детских болезней
SPIN-код: 6433-2420
Москва
Красногорск
В. Ю. Ермакова
Россия
Ермакова Виктория Юрьевна, к. ф. н., доцент кафедры химии Института фармации им. А.П. Нелюбина; преподаватель кафедры терапии и детских болезней Медицинского института непрерывного образования
SPIN-код: 8039-3069
Москва
Рецензия
Для цитирования:
Крысанов И.С., Крысанова В.С., Ермакова В.Ю. Клинико-экономическое обоснование скрининга на мукополисахаридоз I типа у детей групп риска. Качественная клиническая практика. 2021;(3):4-15. https://doi.org/10.37489/2588-0519-2021-3-4-15
For citation:
Krysanov I.S., Krysanova V.S., Ermakova V.Yu. Clinical and economic justification of screening for mucopolysaccharidosis type I in children at groups of risks. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2021;(3):4-15. (In Russ.) https://doi.org/10.37489/2588-0519-2021-3-4-15
















































