Перейти к:
Возможность прогнозирования результатов исследований биоэквивалентности на основе последовательного статистического анализа информативных факторов
https://doi.org/10.37489/2588-0519-2020-1-80-99
Аннотация
Резюме. Прогнозирование результатов исследования биоэквивалентности является актуальной и важной задачей при разработке протоколов клинических исследований биоэквивалентности. Цель работы: разработать алгоритм прогнозирования результатов биоэквивалентности на основе факторов, обладающих достаточной степенью информативности.
Материалы и методы: проведен анализ основных факторов, сопряженных с проведением исследований биоэквивалентности, на данных 290 исследований биоэквивалентности; охарактеризована информативность факторов и определены соответствующие балы (прогностические коэффициенты) каждой градации каждого фактора; разработана прогностическая таблица и алгоритм расчета прогноза; выполнен анализ чувствительности и специфичности разработанного прогностического алгоритма в сравнении с контрольной выборкой (данные 65 исследований биоэквивалентной из открытых источников). Статистическую обработку проводили с помощью программ SSPS Statistics v. 25. и Microsoft Office Excel 2016.
Результаты: Описаны результаты выполненных анализов по определению информативных факторов различными методами оценки. Приведены уравнения для выполнения соответствующих расчетов. Показаны ключевые и наиболее информативные признаки, на основании которых создана прогностическая таблица и разработан алгоритм прогноза. Представлены результаты анализа чувствительности и специфичности алгоритма прогнозирования результатов исследований биоэквивалентности.
Заключение: разработан алгоритм прогнозирования результатов биоэквивалентности на основе факторов, обладающих достаточной степенью информативности. Алгоритм показал высокие значения чувствительности и специфичности, а также низкий процент ошибок.
Для цитирования:
Ромодановский Д.П., Хохлов А.Л. Возможность прогнозирования результатов исследований биоэквивалентности на основе последовательного статистического анализа информативных факторов. Качественная клиническая практика. 2020;(1):80-99. https://doi.org/10.37489/2588-0519-2020-1-80-99
For citation:
Romodanovsky D.P., Khokhlov A.L. The ability to predict the results of bioequivalence studies based on a consistent statistical analysis of informative factors. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2020;(1):80-99. (In Russ.) https://doi.org/10.37489/2588-0519-2020-1-80-99
Введение
Прогнозирование результатов исследования биоэквивалентности является актуальной и важной задачей при разработке протоколов клинических исследований биоэквивалентности.
Известно, что успех исследования биоэквивалентности зависит от правильного статистического планирования биоаналитического исследования [1]. Существует прямая связь между количеством субъектов, включённых в исследование, внутрииндивидуальной вариабельностью лекарственных препаратов и мощностью исследования. Чем выше внутрииндивидуальная вариабельность исследуемых препаратов, тем больше количество субъектов исследования требуется для достижения адекватной мощности результатов исследования [2].
Поэтому при планировании исследований биоэквивалентности в настоящее время принято опираться на данные ранее проведённых исследований, а именно на значения внутрииндивидуальной вариабельности, с помощью которых можно спрогнозировать требуемый объём выборки [2].
Вместе с тем, известны случаи, когда для некоторых лекарственных препаратов либо не удаётся подтвердить биоэквивалентность в фармакокинетических исследованиях, либо для этого требуются чрезмерные затраты на проведение исследования, даже с учётом возможности их сокращения путём использования повторного дизайна исследований. В таких случаях, проводят либо исследования по фар- макодинамическим конечным точкам, либо исследования терапевтической эквивалентности [3].
Например, в «Orange book» Американского регулятора обращения лекарственных средств имеется перечень зарегистрированных лекарственных препаратов, для которых имеются доказательства биоэквивалентности, или такие данные отсутствуют. Согласно данным 2020 года, для 12 лекарственных препаратов биоэквивалентность не была подтверждена [4]. В этот перечень вошли препараты со следующими международными непатентованными наименованиями (метилтестостерон, циклоспорин, эритромицин, эстрадиол, фенофибрат, габапентин, изотретионин, метилфенидат, пропранолол, дилтиазем, топирамат, пропилтиоурацил). Стоит отметить, что большинство из этих препаратов были в лекарственных формах с модифицированным высвобождением, для которых предъявляются более строгие требования к доказательству биоэквивалентности [5].
Спрогнозировать результаты фармакокинетического исследования опираясь только на данные внутрииндивидуальной вариабельности, с достаточной степенью точности не представляется возможным. В связи с этим, важной задачей является поиск новых прогностических факторов, которые могли бы с приемлемой чувствительностью и специфичностью прогнозировать результат исследований биоэквивалентности. Отрицательный прогноз, будет говорить о нецелесообразности проведения сравнительного фармакокинетического исследования в пользу выбора проведения сравнительного исследования по фармакодинамическим точкам или терапевтического исследования биоэквивалентности.
Цель работы — разработать алгоритм прогнозирования результатов биоэквивалентности на основе факторов, обладающих достаточной степенью информативности.
Для моделирования прогноза выбрана последовательная процедура распознавания образов, основанная на поэтапном раздельном определении прогностической значимости признаков через оценку их информативности в отношении требуемого конечного результата, расчёте прогностических коэффициентов и создании прогностической таблицы по типу патометрического анализа, известного в клинической практике метода дифференциальной диагностики заболеваний [6].
Для достижения поставленной цели было необходимо определить основные факторы-признаки, сопряжённые с проведением исследований биоэквивалентности; охарактеризовать их информативность и присвоить каждой градации фактора соответствующие балы; разработать прогностическую таблицу основных факторов, влияющих на результаты исследований биоэквивалентности; провести анализ чувствительности и специфичности разработанного прогностического алгоритма.
Материалы и методы исследования
Определение основных факторов связанных с результатами исследований биоэквивалентности было проведено по данным результатов 290 исследований биоэквивалентности лекарственных препаратов, прошедших экспертизу в ФГБУ «НЦЭСМП» Минздрава России. В 252 исследованиях были достигнуты 90 % доверительные интервалы, укладывающиеся в установленный диапазон 80,00-125,00 %, и в 38 исследованиях — границы 90 % доверительных интервалов выходили за рамки указанного диапазона. Таким образом, были сформированы две группы наблюдений (А и B): «эквивалентные» и «неэквивалентные».
По каждому исследованию сформированы факторы, которые могут повлиять на прогноз результатов исследований биоэквивалентности. Нормальность распределения признаков в группах наблюдений определялась с помощью критерия Колмогорова-Смирнова, различия по каждому признаку рассчитывались с помощью критерия Стьюдента в случае нормального распределения или критерия Мана-Уитни в случае распределения отличного от нормального. Для обоснования включения ряда факторов применяли метод корреляционного анализа.
Для наиболее значимых признаков определены значения информативности по формуле Кульбака в модификации Гублера Е.В. Факторы с низкой информативностью были подвергнуты многофакторному анализу с целью извлечения объединённых факторов и оценкой их информативности.
Факторы со значением информативности более 0,5 включены в прогностическую таблицу, в которой для каждого фактора определены интервалы значений и соответствующие им прогностические коэффициенты (баллы). Пороги для принятий решений определены по методу последовательного статистического анализа Вальда А. исходя из значений ошибок I и II рода, принятых в исследованиях биоэквивалентности.
Проверка чувствительности и специфичности были выполнены на обучающей выборке из 290 проанализированных исследований и контрольной выборке из результатов 65 исследований, определённых при случайном поиске по данным литературы.
Результаты и обсуждение
По результатам исследований биоэквивалентности мы выделили 26 факторов-признаков: длительность забора крови; количество точек забора крови; период отмывки; общее количество субъектов; количество мужчин; количество женщин; аналитический метод; нижний предел количественного определения аналитического метода (НПКО); максимальная концентрация в плазме крови (Сmax) исследуемого (T) и референтного (R) препаратов; площадь под кривой «концентрация-время» в интервале времени от 0 до времени забора последнего образца крови с определяемой концентрацией вещества (AUC0-t) T и R; время достижения максимальной концентрации (tmax) T и R; коэффициент внутрииндивидуальной вариабельности (CVintra) Cmax и AUC0-t; категория лекарственного препарата (ЛП) (обычные ЛП, высоковариабельные ЛП, ЛП с узким терапевтически диапазоном, ЛП аналоги эндогенных соединений, высоковариабельные и с узким терапевтическим диапазоном, высоковариабельные аналоги эндогенных соединений); наличие статистически значимых половых различий; класс биофармацевтической классификационной системы (БКС); лекарственная форма (немедленное или модифицированное высвобождение); нижняя граница (Нг) 90 % доверительного интервала (ДИ) Cmax и AUC0-t; верхняя граница (ВГ) 90 % ДИ Cmax и AUC0-t; точечная оценка (point estimate (PE)) C и AUC0-t.
Достоверность отличий в группах А и В, по каждому фактору оценивали по критерию Манна-Уитни, т. к. распределение в большинстве случаев отличалось от нормального, согласно критерию Колмогорова-Смирнова, кроме факторов «НГ 90 % ДИ AUC01» и «PE Cmax», для которых в обеих группах значения переменной достаточно хорошо подчинялись нормальному распределению (табл. 1). Для данных факторов отсутствовали статистически значимые различия и при применении критерия Манна-Уитни, и критерия Стьюдента (p>0,05).
Таблица 1
Нормальность распределения и статистически значимые различия в группах А и В
|
Фактор |
Группа |
Критерий Колмогорова-Смирнова |
Критерий Манна-Уитни |
|---|---|---|---|
|
Асимп. знач. (двухсторонняя) |
Асимп. знач. (двухсторонняя) |
||
|
Длительность забора крови |
А |
<0,0001 |
0,612 |
|
B |
<0,0001 |
||
|
Количество точек |
А |
<0,0001 |
0,563 |
|
B |
0,2 |
||
|
Период отмывки |
А |
<0,0001 |
0,970 |
|
B |
<0,0001 |
||
|
Количество субъектов |
А |
<0,0001 |
0,225 |
|
B |
<0,0001 |
||
|
Количество мужчин |
А |
<0,0001 |
0,474 |
|
B |
<0,0001 |
||
|
Количество женщин |
А |
<0,0001 |
0,045 |
|
B |
<0,0001 |
||
|
Аналитический метод |
А |
<0,0001 |
0,957 |
|
B |
<0,0001 |
Таблица 1 (продолжение) Нормальность распределения и статистически значимые различия в группах А и В
|
НПКО |
А |
<0,0001 |
0,644 |
|
B |
<0,0001 |
||
|
Сmax T |
А |
<0,0001 |
0,483 |
|
B |
<0,0001 |
||
|
Сmax R |
А |
<0,0001 |
0,411 |
|
B |
<0,0001 |
||
|
AUC0-t T |
А |
<0,0001 |
0,675 |
|
B |
<0,0001 |
||
|
AUC0-t R |
А |
<0,0001 |
0,591 |
|
B |
<0,0001 |
||
|
tmax T |
А |
<0,0001 |
0,745 |
|
B |
<0,0001 |
||
|
tmax R |
А |
<0,0001 |
0,877 |
|
B |
<0,0001 |
||
|
CVintra AUC0-t |
А |
0,001 |
<0,0001* |
|
B |
0,2 |
||
|
CVintra Cmax |
А |
0,001 |
<0,0001* |
|
B |
0,2 |
||
|
Категория ЛП |
А |
<0,0001 |
<0,0001* |
|
B |
<0,0001 |
||
|
Половые различия |
А |
<0,0001 |
0,368 |
|
B |
<0,0001 |
||
|
Класс БКС |
А |
<0,0001 |
0,152 |
|
B |
<0,0001 |
||
|
Лекарственная форма |
А |
<0,0001 |
0,407 |
|
B |
<0,0001 |
||
|
НГ 90% ДИ Cmax |
А |
0,033 |
0,001* |
|
B |
0,005 |
||
|
ВГ 90% ДИ Cmax |
А |
0,048 |
0,015* |
|
B |
0,050 |
||
|
НГ 90% ДИ AUC0-t |
А |
0,2 |
0,241 |
|
B |
0,2 |
||
|
ВГ 90% ДИ AUC0-t |
А |
<0,0001 |
<0,0001* |
|
B |
0,104 |
||
|
PE Cmax |
А |
0,2 |
0,666 |
|
B |
0,192 |
||
|
PE AUC0-t |
А B |
0,048 0,2 |
0,092 |
Примечания: НПКО — нижний предел количественного определения аналитического метода; Cmax — максимальная концентрация в плазме крови; AUC0-t — площадь под кривой «концентрация-время» в интервале времени от 0 до времени забора последнего образца крови с определяемой концентрацией вещества; tmax — время достижения максимальной концентрации; T — исследуемый препарат; R —референтный препарат; CVintra — коэффициент внутрииндивидуальной вариабельности; ЛП лекарственный препарат; БКС — биофармацевтическая классификационная система; НГ — нижняя граница 90 % доверительного интервала (90 % ДИ); ВГ — верхняя граница 90 % ДИ; PE — точечная оценка; * — статистически значимо различающиеся факторы.
Статистически значимо различающиеся факторы были включены в анализ оценки информативности (6 факторов).
Также в анализ информативности были включены такие факторы, как:
- НГ 90 % ДИ AUC0-t, PE Cmax, PE AUC0-t, как непосредственно связанные между собой и факторами НГ 90 % ДИ Cmax, ВГ 90 % ДИ Cmax, ВГ 90 % ДИ AUC0-t (коэффициент корреляции составил более 0,7, что говорит о сильной положительной статистически значимой связи (по Спирмену), таблица 2 и факторы;
- Сmax T, Cmax R, AUC0-t T, AUC0-t R, tmax T, tmax R, длительность забора крови, период отмывки, количество точек забора, количество субъектов, т. к. это ключевые параметры, определяющие фармакокинетику ЛП и крайне важны для прогнозирования результатов исследований биоэквивалентности. Факторы Сmax T, Cmax R, AUC0-t T, AUC0-t R, tmax T, tmax R были объединены путём нахождения средних — «Cmax», «AUC0-t» и «tmax» за вычетом резко выделяющихся значений, для снижения дублирующих факторов, т. к. значения в подгруппах T и R очень близки. Факторы Cmax, AUC0-t и tmax также статистически значимо не отличались в группах сравнения А и B, распределение отличалось от нормального (табл. 3).
Таблица 2
Парные корреляции по Спирмену
|
Корреляции |
|||||||
|---|---|---|---|---|---|---|---|
|
|
НГ 90 % ДИ C max |
ВГ 90 % ДИ C max |
НГ 90 % ДИ AUCm |
ВГ 90 % ДИ AUCm |
PE C max |
PE AUC0-t |
|
|
НГ 90 % ДИ Cmax |
Коэффициент корреляции |
1,000 |
0,358 |
0,553 |
0,103 |
0,809 |
0,399 |
|
Знач. (двухсторонняя) |
|
0,000 |
0,000 |
0,079 |
0,000* |
0,000 |
|
|
ВГ 90 % ДИ Cmax |
Коэффициент корреляции |
|
1,000 |
0,212 |
0,575 |
0,812 |
0,471 |
|
Знач. (двухсторонняя) |
|
|
0,000 |
0,000 |
0,000* |
0,000 |
|
|
НГ 90 % ДИ AUC0-t |
Коэффициент корреляции |
|
|
1,000 |
0,301 |
0,439 |
0,798 |
|
Знач. (двухсторонняя) |
|
|
|
0,000 |
0,000 |
0,000* |
|
|
ВГ 90 % ДИ AUC0-t |
Коэффициент корреляции |
|
|
|
1,000 |
0,394 |
0,786 |
|
Знач. (двухсторонняя) |
|
|
|
|
0,000 |
0,000* |
|
|
PE Cmax |
Коэффициент корреляции |
|
|
|
|
1,000 |
0,506 |
|
Знач. (двухсторонняя) |
|
|
|
|
|
0,000 |
|
|
PE AUC0-t |
Коэффициент корреляции |
|
|
|
|
|
1,000 |
|
Знач. (двухсторонняя) |
|
|
|
|
|
|
|
Примечания: Cmax — максимальная концентрация в плазме крови; AUC0-t — площадь под кривой «концентрация-время» в интервале времени от 0 до времени забора последнего образца крови с определяемой концентрацией вещества; НГ — нижняя граница 90 % доверительного интервала (ДИ); ВГ — верхняя граница 90 % ДИ; PE — точечная оценка; * — статистически значимые корреляции.
Таблица 3
Нормальность распределения и статистически значимые различия в группах А и В
|
Фактор |
Группа |
Критерий Колмогорова-Смирнова |
Критерий Манна-Уитни |
|---|---|---|---|
|
Асимп. знач. (двухсторонняя) |
Асимп. знач. (двухсторонняя) |
||
|
Cmax |
А |
<0,0001 |
0,443 |
|
B |
<0,0001 |
||
|
AUC0-t |
А |
<0,0001 |
0,639 |
|
B |
<0,0001 |
||
|
tmax |
А |
<0,0001 |
0,852 |
|
B |
<0,0001 |
Примечания: Cmax — максимальная концентрация в плазме крови; AUC0-t — площадь под кривой «концентрация-время» в интервале времени от 0 до времени забора последнего образца крови с определяемой концентрацией вещества; tmax — время достижения максимальной концентрации.
Как было сказано выше, при построении алгоритма прогнозирования исходов исследований биоэквивалентности нами выбрана «последовательная прогностическая процедура», позволяющая учитывать вклад того или иного фактора в вероятность того или иного прогноза. Данный подход был предложен Вальдом А. и был модифицирован в работах Гублера Е.В. и Генкина А.А. [6, 7] Разработанный алгоритм вместе с применением меры расчёта информативности Кульбака позволяет решать прогностические задачи и получать результаты в виде таблицы прогностических коэффициентов [8, 9].
Выбранные 16 факторов были оценены по их информативности. Для чего были определены интервалы значений каждого фактора в группах А и В, а также частоты попадания значений каждого фактора в данные интервалы. Интервалы для каждого фактора определялись исходя из имеющихся значений и их дискурсивного распределения. Для каждого интервала рассчитаны прогностические коэффициенты и информативность.
Частоты (P) рассчитывались по формуле:
Pi = (ni/N)x100
где i — интервал значений фактора, п. — количество значений фактора в конкретном интервале;
N — сумма всех значений фактора в изучаемой группе.
Прогностические коэффициенты (ПК) интервала фактора рассчитывали по формуле:
ПКi = 5xlog(PAi/PBi)
где РАi и РВi — частоты встречаемости значения фактора в интервале i, в группах, отличающихся исходом (А и В, «эквивалентные» или «неэквивалентные»).
Информативность (I, мера Кульбака) факторов рассчитывали по формуле:

где РАi и РВi — частоты встречаемости значения фактора в интервале ., в группах, отличающихся исходом (А и В, «эквивалентные» или «неэквивалентные»).
Стоит отметить, что существуют различные подходы к расчёту прогностических коэффициентов и информативности. В самом простом виде используются фактические частоты PA и PB (рассчитанные по формуле 1), однако в случае выявления нулевых значений фактора, или значений близких к ±∞, в некоторых интервалах это приводит к случайным колебаниям частостей.
Для снижения этих колебаний предложены следующие виды сглаживания: методом взвешенной скользящей средней, сглаживание на основе аппроксимации эмпирического распределения нормальным, сглаживание путём замены нулевых значений на значения отличные от 1. Метод аппроксимации распределений, несмотря на трудоёмкость вычисления, по данным Гублера Е.В. не всегда приводит к отысканию аппроксимирующего известного распределения [9]. Поэтому в своей работе мы отказались от применения данного метода и решили использовать метод экспоненциального сглаживания, встроенный в пакет анализа данных Microsoft Excel.
Экспоненциальное сглаживание применяется для того, чтобы придать самым актуальным данным большего веса за счёт введённого коэффициента ? (константы сглаживания).
Особенность метода экспоненциального сглаживания заключается в том, что в процедуре нахождения сглаженного уровня используются значения только предшествующих уровней ряда, взятые с определённым весом, причём вес уменьшается по мере удаления его от момента времени, для которого определяется сглаженное значение уровня ряда.
Для константы сглаживания наиболее подходящими являются значения от 0,2 до 0,3. Эти значения показывают, что ошибка текущего прогноза установлена на уровне от 20 до 30 % ошибки предыдущего прогноза. Более высокие значения константы ускоряют отклик, но могут привести к непредсказуемым выбросам. Низкие значения константы могут привести к большим промежуткам между предсказанными значениями.
Как правило, чем больше α, тем больше влияние на прогноз. Мы взяли значение α=0,3 (30 %), что означает, что остальные 70 % веса распределяются на остальные данные.
Сглаживание путём замены «0» значений проводили по формуле [8]:
Pi = (ni+1/N+b)x100
где i — интервал значений фактора;
ni — количество значений фактора в конкретном интервале;
N — сумма всех значений фактора в изучаемой группе;
b — число интервалов фактора.
Сглаживание методом скользящей средней проводили по формуле:
Pi = Σ(ni xWi )/ΣWi
где ί — интервал значений фактора;
ni — количество значений фактора в конкретном интервале;
Wi — весовой коэффициент (при расчётах использовали коэффициент равный порядковому номеру интервала фактора (i) кратный 3, т. е. определялась сумма трёх значений числа наблюдений помноженных на соответствующие номера интервалов и поделённая на сумму интервалов, скольжение проводили кратно 3 интервалам.
Различные подходы давали разные значения информативности факторов (табл. 4).
Таблица 4
Информативность факторов
|
Фактор |
Без сглаживания |
Сглаживание |
Среднее значение 4 методов |
Среднее значение 3 методов |
||
|---|---|---|---|---|---|---|
|
Замена «0» значений |
Скользящая средняя взвешенная |
Экспоненциальное сглаживание |
||||
|
Длительность забора крови |
0,52 |
0,69 |
0,21 |
0,36 |
0,48 |
0,55 |
|
Количество субъектов |
0,21 |
0,28 |
0,06 |
0,24 |
0,23 |
0,28 |
|
AUC0-t |
0,02 |
0,44 |
0,02 |
0,38 |
0,40 |
0,42 |
|
НГ 90 % ДИ Cmax |
0,79 |
2,34 |
0,55 |
0,35 |
1,50 |
2,24 |
|
ВГ 90 % ДИ Cmax |
0,80 |
2,01 |
0,74 |
1,38 |
1,81 |
1,83 |
|
НГ 90 % ДИ AUC0-t |
0,34 |
1,20 |
0,24 |
0,21 |
0,78 |
1,06 |
|
ВГ 90 % ДИ AUC0-t |
0,29 |
0,98 |
0,30 |
0,68 |
0,87 |
0,88 |
|
PE Cmax |
1,26 |
1,51 |
0,83 |
0,82 |
1,33 |
1,45 |
|
PE AUC0-t |
0,66 |
1,04 |
0,41 |
0,61 |
0,88 |
0,93 |
|
Количество точек |
0,26 |
0,23 |
0,12 |
0,19 |
0,21 |
0,23 |
|
CVintra AUC0-t |
0,88 |
0,80 |
0,52 |
0,70 |
0,74 |
0,80 |
|
CVintra Cmax |
0,57 |
0,70 |
0,58 |
0,63 |
0,72 |
0,71 |
|
Период отмывки |
0,01 |
0,37 |
0,05 |
0,20 |
0,24 |
0,29 |
|
НПКО |
0,02 |
0,44 |
0,03 |
0,08 |
0,23 |
0,25 |
|
Cmax |
0,10 |
0,52 |
0,16 |
0,55 |
0,48 |
0,53 |
|
tmax |
0,51 |
0,72 |
0,39 |
0,66 |
0,70 |
0,77 |
|
Категория ЛП |
1,41 |
1,36 |
0,28 |
0,91 |
1,00 |
1,24 |
|
Вариабельность, % |
87,84 |
74,09 |
85,67 |
66,94 |
71,17 |
75,53 |
|
Р по критерию Колмогорова-Смирнова |
0,200 |
0,200 |
0,140 |
0,200 |
0,200 |
0,170 |
|
Рв сравнении со средним 4 методов |
0,076 |
0,424 |
0,008* |
0,166 |
- |
- |
|
Рв сравнении со средним 3 методов |
0,037* |
0,781 |
- |
0,077 |
- |
- |
Примечания: AUC0-t — площадь под кривой «концентрация-время» в интервале времени от 0 до времени забора последнего образца крови с определяемой концентрацией вещества; Cmax — максимальная концентрация в плазме крови; НГ — нижняя граница 90 % доверительного интервала (ДИ); ВГ — верхняя граница 90 % ДИ; PE — точечная оценка; CVintra — коэффициент внутрииндивидуальной вариабельности; НПКО — нижний предел количественного определения аналитического метода; tmax — время достижения максимальной концентрации; ЛП — лекарственный препарат; Р — статистическая значимость различий; * — различия рассчитаны с помощью критерия Стьюдента; жирным шрифтом выделены значения информативности, превышающие значение 0,5 (порог информативности).
Анализ показал, что информативность более — 0,5 (порог информативности) была получена для наибольшего количества факторов (12) при использовании метода сглаживания путём замены «0» значений, наименьшее количество (5) при использовании сглаживания методом скользящей средней взвешенной.
Как видно из таблицы 4, для метода сглаживания скользящей средней взвешенной была продемонстрирована статистическая значимость отличий от средних значений информативности для 4 методов. Таким образом, можно предположить, что данный метод наименее пригоден для построения прогноза, так как статистически значимо отличается от других рассмотренных методов. Аналогичным образом исключён метод без сглаживания, т. к. статистически значимо отличается от средних значений информативности для 3 оставшихся методов.
Среди оставшихся двух методов наименьшую вариабельность продемонстрировал метод экспоненциального сглаживания. Однако данный метод демонстрировал информативность выше порога только для 9 факторов и не включал такие важные факторы как нижние границы 90 % доверительных интервалов для параметров Cmax и AUC0-t и длительность забора крови в сравнении с методом замены «0» значений, описанным Гублером Е.В. [9].
Таким образом, для подготовки прогностической таблицы был выбран метод сглаживания путём замены «0» значений, т. к. он демонстрировал высокую информативность для наибольшего количества факторов и демонстрировал приемлемую флюктуацию значений. Также данный подход позволил получить прогностические коэффициенты для каждого интервала фактора, что более точно позволяет рассчитывать прогноз.
Таким образом, были определены 12 факторов, обладающих приемлемой информативностью для прогнозирования результатов исследований биоэквивалентности.
Один из ключевых факторов планирования исследований — количество субъектов продемонстрировал низкую информативность, однако, по данным литературы, он является основополагающим критерием достижения необходимой мощности исследования [11, 12]. В связи с чем был выполнен факторный анализ методом главных компонентов, всех факторов, которые коррелируют с данным показателем. Факторный анализ показал, что такие факторы, как количество субъектов и внутрииндивидуальная вариабельность Cmax и AUC0-t, демонстрируют сильную положительную связь и могут быть объединены в единый фактор, с извлечением коэффициента линейной регрессии (табл. 5).
Таблица 5
Матрица компонентов факторного анализа
|
Компоненты |
Объединённый фактор |
|---|---|
|
Количество субъектов |
0,729 |
|
CVintra AUC0-t |
0,809 |
|
CVintra Cmax |
0,923 |
Примечания: Метод выделения факторов: метод главных компонент; AUC0-t — площадь под кривой «концентрация-время» в интервале времени от 0 до времени забора последнего образца крови с определяемой концентрацией вещества; Cmax — максимальная концентрация в плазме крови; CVintra — коэффициент внутрииндивидуальной вариабельности.
Данный коэффициент можно назвать коэффициентом связи «выборка-вариабельность». Путём проведения анализа линейной регрессии были определены необходимые коэффициенты для уравнения регрессии, и данное уравнение имеет следующий вид:
К=N х 0,03+CVintraCmax х0,043+CVintroAUC0-t х 0,041 -2,492
где К — коэффициент связи количества субъектов и вариабельности Cmax и AUC0-t,
N — количество субъектов;
CVintra Cmax и CVintra AUC0-t — значения внутрииндивидуальной вариабельности.
Анализ информативности данного объединённого фактора показал информативность по выбранному методу сглаживания — 0,78. Учитывая, что данный фактор демонстрирует приемлемую информативность и позволяет учитывать такой важный показатель как количество субъектов, решили сравнить итоговую модель алгоритма прогнозирования с включением данного фактора вместо отдельных факторов CVintra Cmax и CVintra AUC0-t, и без его включения.
Поэтому по итогам анализа информативности были построены две прогностические таблицы 6 и 7, включающие, соответственно 11 и 12 факторов.
Последовательное суммирование прогностических коэффициентов (балов) по каждому из факторов (для вариантов его наличия или отсутствия, либо для отдельных его градаций) приведённых в прогностической таблице, позволяет рассчитать для каждого исхода и для каждого прогнозируемого результата сумму, соотнесение которой с величинами прогностических порогов позволяет отнести дифференцируемый случай к тому или иному состоянию (прогнозу) с заданной вероятностью.
В математической статистике подобный подход, когда последовательное накопление информации продолжается до момента достижения порога, предложен Вальдом А. [6]. Он является отличительной особенностью последовательного статистического анализа. Вальд А. показал, что при таком подходе требуется в среднем вдвое меньше информации для принятия решения с определенным уровнем надёжности, чем при обычном «классическом».
В общем случае величины порогов для принятия решения с требуемым уровнем надёжности по Вальду А. в модификации Гублера Е.В. определяют по следующей формуле:
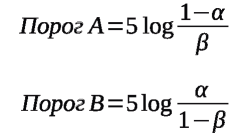
где α и β — ошибки первого и второго рода.
В исследованиях биоэквивалентности ошибка первого рода (α) связана с риском потребителя (выходом на рынок некачественного препарата) и жестко закреплена на уровне не более 5 %, ошибка второго рода (β) связана с риском производителя — невыход на рынок эквивалентного препарата (не менее 20 %).
Таким образом, для исследований биоэквивалентности прогностические пороги составляют:
- для порога А (эквивалентный результат) — +3;
- для порога В (неэквивалентный результат) 6;
В случае если сумма прогностических коэффициентов по каждому фактору из прогностической таблицы будет равна +3 и выше, то можно судить о высокой вероятности получения эквивалентных результатов в исследовании биоэквивалентности, в случае если сумма будет равна -6 или менее, можно судить о высокой вероятности неэквивалентных результатов.
Таблица 6
Прогностическая таблица с учётом коэффициента связи количества субъектов и вариабельности
|
№ |
Фактор |
Интервал |
ПК |
Информативность |
|
|---|---|---|---|---|---|
|
Нижняя |
Верхняя |
||||
|
1 |
НГ 90 % |
0,6 |
0,65 |
-4 |
0,03 |
|
|
|
0,65 |
0,7 |
-5 |
0,09 |
|
|
|
0,7 |
0,75 |
-7 |
0,34 |
|
|
|
0,75 |
0,8 |
-9 |
1,15 |
|
|
|
0,8 |
0,85 |
2 |
0,11 |
|
|
|
0,85 |
0,9 |
1 |
0,04 |
|
|
|
0,9 |
0,95 |
3 |
0,36 |
|
|
|
0,95 |
1 |
1 |
0,04 |
|
|
|
1 |
1,05 |
-1 |
0,01 |
|
|
|
1,05 |
1,1 |
-2 |
0,02 |
|
|
|
1,1 |
1,15 |
-4 |
0,10 |
|
|
|
1,15 |
1,2 |
-4 |
0,03 |
|
|
|
ИТОГО |
2,34 |
||
|
2 |
ВГ 90 % |
0,8 |
0,85 |
-4 |
0,03 |
|
|
|
0,85 |
0,9 |
-5 |
0,09 |
|
|
|
0,9 |
0,95 |
-3 |
0,07 |
|
|
|
0,95 |
1 |
-1 |
0,02 |
|
|
|
1 |
1,05 |
1 |
0,04 |
|
|
|
1,05 |
1,1 |
1 |
0,06 |
|
|
|
1,1 |
1,15 |
4 |
0,39 |
|
|
|
1,15 |
1,2 |
2 |
0,07 |
|
|
|
1,2 |
1,25 |
0 |
0,00 |
|
|
|
1,25 |
1,3 |
-8 |
0,57 |
|
|
|
1,3 |
1,35 |
-8 |
0,57 |
|
|
|
1,35 |
1,4 |
-5 |
0,09 |
|
|
|
ИТОГО |
2,01 |
||
|
3 |
PE Cmax |
0,7 |
0,75 |
-4 |
0,03 |
|
|
|
0,75 |
0,8 |
-5 |
0,09 |
|
|
|
0,8 |
0,85 |
-6 |
0,17 |
|
|
|
0,85 |
0,9 |
-3 |
0,12 |
|
|
|
0,9 |
0,95 |
-1 |
0,03 |
|
|
|
0,95 |
1 |
2 |
0,22 |
|
|
|
1 |
1,05 |
3 |
0,34 |
|
|
|
1,05 |
1,1 |
1 |
0,02 |
|
|
|
1,1 |
1,15 |
-3 |
0,18 |
|
|
|
1,15 |
1,2 |
-4 |
0,10 |
|
|
|
1,2 |
1,25 |
-6 |
0,17 |
|
|
|
1,25 |
1,3 |
-4 |
0,03 |
|
|
|
ИТОГО |
1,51 |
||
|
4 |
Категория ЛП |
Обычный ЛП |
3 |
0,69 |
|
|
|
|
Высоковариабельный ЛП |
-2 |
0,28 |
|
|
|
|
ЛП с УТД |
-1 |
0,03 |
|
|
|
|
ЛП АЭС |
2 |
0,04 |
|
|
|
|
ЛП с УТД и высокой |
вариабельностью ФК |
-5 |
0,26 |
|
|
|
ЛП АЭС с высокой вариабельностью ФК |
-2 |
0,06 |
|
|
|
|
ИТОГО |
1,36 |
||
|
5 |
НГ 90 % ДИ AUC0-t |
0,6 |
0,65 |
-4 |
0,03 |
|
|
|
0,65 |
0,7 |
-4 |
0,03 |
|
|
|
0,7 |
0,75 |
-4 |
0,03 |
|
|
|
0,75 |
0,8 |
-8 |
0,54 |
|
|
|
0,8 |
0,85 |
0 |
0,00 |
|
|
|
0,85 |
0,9 |
1 |
0,05 |
|
|
|
0,9 |
0,95 |
1 |
0,06 |
|
|
|
0,95 |
1 |
2 |
0,15 |
|
|
|
1 |
1,05 |
-2 |
0,06 |
|
|
|
1,05 |
1,1 |
-6 |
0,17 |
|
|
|
1,1 |
1,15 |
-4 |
0,03 |
|
|
|
1,15 |
1,2 |
-4 |
0,03 |
|
|
|
ИТОГО |
1,20 |
||
|
6 |
PE AUC0-t |
0,7 |
0,75 |
-4 |
0,03 |
|
|
|
0,75 |
0,8 |
-4 |
0,03 |
|
|
|
0,8 |
0,85 |
-4 |
0,03 |
|
|
|
0,85 |
0,9 |
-3 |
0,09 |
|
|
|
0,9 |
0,95 |
-1 |
0,02 |
|
|
|
0,95 |
1 |
2 |
0,27 |
|
|
|
1 |
1,05 |
1 |
0,07 |
|
|
|
1,05 |
1,1 |
-1 |
0,03 |
|
|
|
1,1 |
1,15 |
-3 |
0,12 |
|
|
|
1,15 |
1,2 |
-6 |
0,17 |
|
|
|
1,2 |
1,25 |
-5 |
0,09 |
|
|
|
1,25 |
1,3 |
-5 |
0,09 |
|
|
|
ИТОГО |
1,04 |
||
|
7 |
ВГ 90 % ДИ AUC0-t |
0,8 |
0,85 |
-4 |
0,03 |
|
|
|
0,85 |
0,9 |
-4 |
0,03 |
|
|
|
0,9 |
0,95 |
-2 |
0,01 |
|
|
|
0,95 |
1 |
0 |
0,00 |
|
|
|
1 |
1,05 |
1 |
0,06 |
|
|
|
1,05 |
1,1 |
2 |
0,18 |
|
|
|
1,1 |
1,15 |
0 |
0,00 |
|
|
|
1,15 |
1,2 |
-1 |
0,02 |
|
|
|
1,2 |
1,25 |
-1 |
0,02 |
|
|
|
1,25 |
1,3 |
-7 |
0,27 |
|
|
|
1,3 |
1,35 |
-6 |
0,17 |
|
|
|
1,35 |
1,4 |
-6 |
0,17 |
|
|
|
ИТОГО |
0,98 |
||
Таблица 6 (продолжение)
Прогностическая таблица с учётом коэффициента связи количества субъектов и вариабельности
|
№ |
Фактор |
Интервал |
ПК |
Информативность |
|
|---|---|---|---|---|---|
|
Нижняя |
Верхняя |
||||
|
8 |
Коэффициент связи количества субъектов и вариабельности Cmax и AUC0-t |
-1,70 |
-1,25 |
1 |
0,01 |
|
|
|
-1,25 |
-0,80 |
4 |
0,35 |
|
|
|
-0,80 |
-0,35 |
1 |
0,03 |
|
|
|
-0,35 |
0,10 |
1 |
0,02 |
|
|
|
0,10 |
0,55 |
-1 |
0,04 |
|
|
|
0,55 |
1,00 |
0 |
0,00 |
|
|
|
1,00 |
1,45 |
-1 |
0,03 |
|
|
|
1,45 |
1,90 |
-2 |
0,05 |
|
|
|
1,90 |
2,35 |
1 |
0,01 |
|
|
|
2,35 |
2,80 |
-4 |
0,13 |
|
|
|
2,80 |
3,25 |
-4 |
0,03 |
|
|
|
3,25 |
3,70 |
-5 |
0,09 |
|
|
|
ИТОГО |
0,78 |
||
|
9 |
tmax, ч |
0 |
0,65 |
2 |
0,03 |
|
|
|
0,65 |
1,3 |
2 |
0,13 |
|
|
|
1,3 |
1,95 |
-1 |
0,06 |
|
|
|
1,95 |
2,6 |
-1 |
0,03 |
|
|
|
2,6 |
3,25 |
-1 |
0,01 |
|
|
|
3,25 |
3,9 |
4 |
0,22 |
|
|
|
3,9 |
4,55 |
1 |
0,01 |
|
|
|
4,55 |
5,2 |
1 |
0,00 |
|
|
|
5,2 |
5,85 |
0 |
0,00 |
|
|
|
5,85 |
6,5 |
-1 |
0,01 |
|
|
|
6,5 |
7,15 |
1 |
0,01 |
|
|
|
7,15 |
7,8 |
1 |
0,01 |
|
|
|
7,8 |
8,45 |
0 |
0,00 |
|
|
|
8,45 |
9,1 |
-3 |
0,04 |
|
|
|
9,1 |
9,75 |
-2 |
0,01 |
|
|
|
9,75 |
10,4 |
-3 |
0,02 |
|
|
|
10,4 |
11,05 |
-5 |
0,08 |
|
|
|
11,05 |
11,7 |
-3 |
0,02 |
|
|
|
11,7 |
12,35 |
-3 |
0,02 |
|
|
|
12,35 |
13 |
-2 |
0,01 |
|
|
|
ИТОГО |
0,82 |
||
|
10 |
Длительность забора крови, ч |
0 |
12 |
2 |
0,04 |
|
|
|
12 |
24 |
-1 |
0,01 |
|
|
|
24 |
36 |
0 |
0,00 |
|
|
|
36 |
48 |
0 |
0,00 |
|
|
|
48 |
60 |
1 |
0,05 |
|
|
|
60 |
72 |
-2 |
0,04 |
|
|
|
72 |
84 |
3 |
0,24 |
|
|
|
84 |
96 |
-3 |
0,04 |
|
|
|
96 |
108 |
-2 |
0,04 |
|
|
|
108 |
120 |
-3 |
0,02 |
|
|
|
120 |
132 |
-1 |
0,01 |
|
|
|
132 |
144 |
-3 |
0,02 |
|
|
|
144 |
156 |
0 |
0,00 |
|
|
|
156 |
168 |
-3 |
0,02 |
|
|
|
168 |
180 |
-2 |
0,03 |
|
|
|
180 |
192 |
-3 |
0,02 |
|
|
|
192 |
204 |
-3 |
0,06 |
|
|
|
204 |
216 |
-3 |
0,02 |
|
|
|
216 |
228 |
-2 |
0,01 |
|
|
|
228 |
240 |
-3 |
0,02 |
|
|
|
ИТОГО |
0,69 |
||
|
11 |
C max, нг
|
0,00 |
465,00 |
1 |
0,12 |
|
|
|
465,00 |
930,00 |
0 |
0,00 |
|
|
|
930,00 |
1395,00 |
-1 |
0,00 |
|
|
|
1395,00 |
1860,00 |
-3 |
0,06 |
|
|
|
1860,00 |
2325,00 |
-1 |
0,00 |
|
|
|
2325,00 |
2790,00 |
-2 |
0,02 |
|
|
|
2790,00 |
3255,00 |
-1 |
0,00 |
|
|
|
3255,00 |
3720,00 |
1 |
0,00 |
|
|
|
3720,00 |
4185,00 |
-1 |
0,00 |
|
|
|
4185,00 |
4650,00 |
0 |
0,00 |
|
|
|
4650,00 |
5115,00 |
1 |
0,00 |
|
|
|
5115,00 |
5580,00 |
-2 |
0,01 |
|
|
|
5580,00 |
6045,00 |
-2 |
0,01 |
|
|
|
6045,00 |
6510,00 |
-6 |
0,14 |
|
|
|
6510,00 |
6975,00 |
-1 |
0,00 |
|
|
|
6975,00 |
7440,00 |
-3 |
0,02 |
|
|
|
7440,00 |
7905,00 |
-3 |
0,02 |
|
|
|
7905,00 |
8370,00 |
-2 |
0,01 |
|
|
|
8370,00 |
8835,00 |
-2 |
0,01 |
|
|
|
8835,00 |
9300,00 |
-5 |
0,08 |
|
|
|
ИТОГО |
0,52 |
||
Примечание: ПК — прогностический коэффициент; С max— максимальная концентрация в плазме крови; AUC0-t — площадь под кривой «концентрация-время» в интервале времени от 0 до времени забора последнего образца крови с определяемой концентрацией вещества; t max— время достижения максимальной концентрации; ЛП лекарственный препарат; УТД — узкий терапевтический диапазон; АЭС — аналог эндогенного соединения; ФК — фармакокинетика; НГ — нижняя граница 90 % доверительного интервала (ДИ); ВГ — верхняя граница 90 % ДИ; PE — точечная оценка.
Таблица 7
Прогностическая таблица с учётом коэффициентов внутрииндивидуальной вариабельности
|
№ |
Фактор |
Интервал |
ПК |
Информативность |
|
|---|---|---|---|---|---|
|
Нижняя |
Верхняя |
||||
|
1 |
НГ 90 % ДИ Cmax |
0,6 |
0,65 |
-4 |
0,03 |
|
|
|
0,65 |
0,7 |
-5 |
0,09 |
|
|
|
0,7 |
0,75 |
-7 |
0,34 |
|
|
|
0,75 |
0,8 |
-9 |
1,15 |
|
|
|
0,8 |
0,85 |
2 |
0,11 |
|
|
|
0,85 |
0,9 |
1 |
0,04 |
|
|
|
0,9 |
0,95 |
3 |
0,36 |
|
|
|
0,95 |
1 |
1 |
0,04 |
|
|
|
1 |
1,05 |
-1 |
0,01 |
|
|
|
1,05 |
1,1 |
-2 |
0,02 |
|
|
|
1,1 |
1,15 |
-4 |
0,10 |
|
|
|
1,15 |
1,2 |
-4 |
0,03 |
|
|
|
ИТОГО |
2,34 |
||
|
2 |
ВГ 90 % ДИ Cmax |
0,8 |
0,85 |
-4 |
0,03 |
|
|
|
0,85 |
0,9 |
-5 |
0,09 |
|
|
|
0,9 |
0,95 |
-3 |
0,07 |
|
|
|
0,95 |
1 |
-1 |
0,02 |
|
|
|
1 |
1,05 |
1 |
0,04 |
|
|
|
1,05 |
1,1 |
1 |
0,06 |
|
|
|
1,1 |
1,15 |
4 |
0,39 |
|
|
|
1,15 |
1,2 |
2 |
0,07 |
|
|
|
1,2 |
1,25 |
0 |
0,00 |
|
|
|
1,25 |
1,3 |
-8 |
0,57 |
|
|
|
1,3 |
1,35 |
-8 |
0,57 |
|
|
|
1,35 |
1,4 |
-5 |
0,09 |
|
|
|
ИТОГО |
2,01 |
||
|
3 |
PE Cmax |
0,7 |
0,75 |
-4 |
0,03 |
|
|
|
0,75 |
0,8 |
-5 |
0,09 |
|
|
|
0,8 |
0,85 |
-6 |
0,17 |
|
|
|
0,85 |
0,9 |
-3 |
0,12 |
|
|
|
0,9 |
0,95 |
-1 |
0,03 |
|
|
|
0,95 |
1 |
2 |
0,22 |
|
|
|
1 |
1,05 |
3 |
0,34 |
|
|
|
1,05 |
1,1 |
1 |
0,02 |
|
|
|
1,1 |
1,15 |
-3 |
0,18 |
|
|
|
1,15 |
1,2 |
-4 |
0,10 |
|
|
|
1,2 |
1,25 |
-6 |
0,17 |
|
|
|
1,25 |
1,3 |
-4 |
0,03 |
|
|
|
ИТОГО |
1,51 |
||
|
4 |
Категория ЛП |
Обычный ЛП |
3 |
0,69 |
|
|
|
|
Высоковариабельный ЛП |
-2 |
0,28 |
|
|
|
|
ЛП с УТД |
-1 |
0,03 |
|
|
|
|
ЛП АЭС |
2 |
0,04 |
|
|
|
|
ЛП с УТД и высокой вариабельностью ФК |
-5 |
0,26 |
|
|
|
|
ЛП АЭС с высокой вариабельностью ФК |
-2 |
0,06 |
|
|
|
|
ИТОГО |
1,36 |
||
|
5 |
НГ 90 % ДИ AUC0-t |
0,6 |
0,65 |
-4 |
0,03 |
|
|
|
0,65 |
0,7 |
-4 |
0,03 |
|
|
|
0,7 |
0,75 |
-4 |
0,03 |
|
|
|
0,75 |
0,8 |
-8 |
0,54 |
|
|
|
0,8 |
0,85 |
0 |
0,00 |
|
|
|
0,85 |
0,9 |
1 |
0,05 |
|
|
|
0,9 |
0,95 |
1 |
0,06 |
|
|
|
0,95 |
1 |
2 |
0,15 |
|
|
|
1 |
1,05 |
-2 |
0,06 |
|
|
|
1,05 |
1,1 |
-6 |
0,17 |
|
|
|
1,1 |
1,15 |
-4 |
0,03 |
|
|
|
1,15 |
1,2 |
-4 |
0,03 |
|
|
|
ИТОГО |
1,20 |
||
|
6 |
PE AUC0-t |
0,7 |
0,75 |
-4 |
0,03 |
|
|
|
0,75 |
0,8 |
-4 |
0,03 |
|
|
|
0,8 |
0,85 |
-4 |
0,03 |
|
|
|
0,85 |
0,9 |
-3 |
0,09 |
|
|
|
0,9 |
0,95 |
-1 |
0,02 |
|
|
|
0,95 |
1 |
2 |
0,27 |
|
|
|
1 |
1,05 |
1 |
0,07 |
|
|
|
1,05 |
1,1 |
-1 |
0,03 |
|
|
|
1,1 |
1,15 |
-3 |
0,12 |
|
|
|
1,15 |
1,2 |
-6 |
0,17 |
|
|
|
1,2 |
1,25 |
-5 |
0,09 |
|
|
|
1,25 |
1,3 |
-5 |
0,09 |
|
|
|
ИТОГО |
1,04 |
||
|
7 |
ВГ 90 % ДИ AUC0-t |
0,8 |
0,85 |
-4 |
0,03 |
|
|
|
0,85 |
0,9 |
-4 |
0,03 |
|
|
|
0,9 |
0,95 |
-2 |
0,01 |
|
|
|
0,95 |
1 |
0 |
0,00 |
|
|
|
1 |
1,05 |
1 |
0,06 |
|
|
|
1,05 |
1,1 |
2 |
0,18 |
|
|
|
1,1 |
1,15 |
0 |
0,00 |
|
|
|
1,15 |
1,2 |
-1 |
0,02 |
|
|
|
1,2 |
1,25 |
-1 |
0,02 |
|
|
|
1,25 |
1,3 |
-7 |
0,27 |
|
|
|
1,3 |
1,35 |
-6 |
0,17 |
|
|
|
1,35 |
1,4 |
-6 |
0,17 |
|
|
|
ИТОГО |
0,98 |
||
Таблица 7 (продолжение)
Прогностическая таблица с учётом коэффициента связи количества субъектов и вариабельности
|
№ |
Фактор |
Интервал |
ПК |
Информативность |
|
|---|---|---|---|---|---|
|
Нижняя |
Верхняя |
||||
|
8 |
CVintra AUC0-t |
1,50 |
6,50 |
1 |
0,01 |
|
|
|
6,50 |
11,50 |
2 |
0,08 |
|
|
|
11,50 |
16,50 |
3 |
0,30 |
|
|
|
16,50 |
21,50 |
0 |
0,00 |
|
|
|
21,50 |
26,50 |
-1 |
0,04 |
|
|
|
26,50 |
31,50 |
-1 |
0,02 |
|
|
|
31,50 |
36,50 |
-3 |
0,15 |
|
|
|
36,50 |
41,50 |
-3 |
0,09 |
|
|
|
41,50 |
46,50 |
-1 |
0,00 |
|
|
|
46,50 |
51,50 |
-4 |
0,07 |
|
|
|
51,50 |
56,50 |
-4 |
0,03 |
|
|
|
ИТОГО |
|
|
0,80 |
|
9 |
t max, ч
|
0 |
0,65 |
2 |
0,03 |
|
|
|
0,65 |
1,3 |
2 |
0,13 |
|
|
|
1,3 |
1,95 |
-1 |
0,06 |
|
|
|
1,95 |
2,6 |
-1 |
0,03 |
|
|
|
2,6 |
3,25 |
-1 |
0,01 |
|
|
|
3,25 |
3,9 |
4 |
0,22 |
|
|
|
3,9 |
4,55 |
1 |
0,01 |
|
|
|
4,55 |
5,2 |
1 |
0,00 |
|
|
|
5,2 |
5,85 |
0 |
0,00 |
|
|
|
5,85 |
6,5 |
-1 |
0,01 |
|
|
|
6,5 |
7,15 |
1 |
0,01 |
|
|
|
7,15 |
7,8 |
1 |
0,01 |
|
|
|
7,8 |
8,45 |
0 |
0,00 |
|
|
|
8,45 |
9,1 |
-3 |
0,04 |
|
|
|
9,1 |
9,75 |
-2 |
0,01 |
|
|
|
9,75 |
10,4 |
-3 |
0,02 |
|
|
|
10,4 |
11,05 |
-5 |
0,08 |
|
|
|
11,05 |
11,7 |
-3 |
0,02 |
|
|
|
11,7 |
12,35 |
-3 |
0,02 |
|
|
|
12,35 |
13 |
-2 |
0,01 |
|
|
|
ИТОГО |
0,82 |
||
|
10 |
CVintra Cmax |
1,50 |
6,50 |
2 |
0,03 |
|
|
|
6,50 |
11,50 |
2 |
0,10 |
|
|
|
11,50 |
16,50 |
1 |
0,04 |
|
|
|
16,50 |
21,50 |
1 |
0,04 |
|
|
|
21,50 |
26,50 |
0 |
0,00 |
|
|
|
26,50 |
31,50 |
-1 |
0,01 |
|
|
|
31,50 |
36,50 |
-1 |
0,02 |
|
|
|
36,50 |
41,50 |
-2 |
0,04 |
|
|
|
41,50 |
46,50 |
-3 |
0,11 |
|
|
|
46,50 |
51,50 |
-4 |
0,13 |
|
|
|
51,50 |
56,50 |
-6 |
0,17 |
|
|
|
ИТОГО |
0,70 |
||
|
11 |
Длительность забора крови, ч |
0 |
12 |
2 |
0,04 |
|
|
|
12 |
24 |
-1 |
0,01 |
|
|
|
24 |
36 |
0 |
0,00 |
|
|
|
36 |
48 |
0 |
0,00 |
|
|
|
48 |
60 |
1 |
0,05 |
|
|
|
60 |
72 |
-2 |
0,04 |
|
|
|
72 |
84 |
3 |
0,24 |
|
|
|
84 |
96 |
-3 |
0,04 |
|
|
|
96 |
108 |
-2 |
0,04 |
|
|
|
108 |
120 |
-3 |
0,02 |
|
|
|
120 |
132 |
-1 |
0,01 |
|
|
|
132 |
144 |
-3 |
0,02 |
|
|
|
144 |
156 |
0 |
0,00 |
|
|
|
156 |
168 |
-3 |
0,02 |
|
|
|
168 |
180 |
-2 |
0,03 |
|
|
|
180 |
192 |
-3 |
0,02 |
|
|
|
192 |
204 |
-3 |
0,06 |
|
|
|
204 |
216 |
-3 |
0,02 |
|
|
|
216 |
228 |
-2 |
0,01 |
|
|
|
228 |
240 |
-3 |
0,02 |
|
|
|
ИТОГО |
0,69 |
||
|
12 |
C max, нг |
0,00 |
465,00 |
1 |
0,12 |
|
|
|
465,00 |
930,00 |
0 |
0,00 |
|
|
|
930,00 |
1395,00 |
-1 |
0,00 |
|
|
|
1395,00 |
1860,00 |
-3 |
0,06 |
|
|
|
1860,00 |
2325,00 |
-1 |
0,00 |
|
|
|
2325,00 |
2790,00 |
-2 |
0,02 |
|
|
|
2790,00 |
3255,00 |
-1 |
0,00 |
|
|
|
3255,00 |
3720,00 |
1 |
0,00 |
|
|
|
3720,00 |
4185,00 |
-1 |
0,00 |
|
|
|
4185,00 |
4650,00 |
0 |
0,00 |
|
|
|
4650,00 |
5115,00 |
1 |
0,00 |
|
|
|
5115,00 |
5580,00 |
-2 |
0,01 |
|
|
|
5580,00 |
6045,00 |
-2 |
0,01 |
|
|
|
6045,00 |
6510,00 |
-6 |
0,14 |
|
|
|
6510,00 |
6975,00 |
-1 |
0,00 |
|
|
|
6975,00 |
7440,00 |
-3 |
0,02 |
|
|
|
7440,00 |
7905,00 |
-3 |
0,02 |
|
|
|
7905,00 |
8370,00 |
-2 |
0,01 |
|
|
|
8370,00 |
8835,00 |
-2 |
0,01 |
|
|
|
8835,00 |
9300,00 |
-5 |
0,08 |
|
|
|
ИТОГО |
0,52 |
||
Примечания: ПК — прогностический коэффициент; Сmax — максимальная концентрация в плазме крови; AUC0-t — площадь под кривой «концентрация-время» в интервале времени от 0 до времени забора последнего образца крови с определяемой концентрацией вещества; CVintra — коэффициент внутрииндивидуальной вариабельности; tmax — время достижения максимальной концентрации; ЛП лекарственный препарат; УТД — узкий терапевтический диапазон; АЭС — аналог эндогенного соединения; ФК — фармакокинетика; НГ — нижняя граница 90 % доверительного интервала (ДИ); ВГ — верхняя граница 90 % ДИ; PE — точечная оценка.
Если же, сумма прогностических коэффициентов находится в пределах установленных порогов (от А до В), то выносят решение: имеющейся информации недостаточно для принятия решения с намеченным уровнем ошибок.
Алгоритм принятия решений по разработанным прогностическим таблицам выглядит следующим образом:
Для прогнозирования определяются интересующие значения факторов, по таблицам и находится соответствующий интервал, в который попадает данное значения фактора, и определяется соответствующий прогностический коэффициент. В случае если значение попадает в крайние значения верхнего и нижнего интервалов следует использовать крайний верхний или нижний прогностический коэффициент. Например, если коэффициент связи количества субъектов и вариабельности равен -2 или 4, то используются прогностические коэффициенты 1 и -5, соответственно. Процедуру требуется повторить для каждого фактора. Далее необходимо рассчитать сумму полученных прогностических коэффициентов, и в зависимости от полученного значения определить достигнут порог А (эквивалентность) или достигнут порог B (неэквивалентность). В случае нахождения значения суммы прогностических коэффициентов в диапазоне между порогами А и В, то выносят решение: «не информативно» (имеющейся информации недостаточно для принятия решения с намеченным уровнем ошибок).
Анализ чувствительности и специфичности разработанного метода по таблице прогнозирования №6 составил соответственно 94 и 87 % для 290 исследований. Для анализа полученные значения, относящиеся к решению «не информативно», рассматривались как отрицательные (неправильные).
Для проверки модели были собраны результаты 65 исследований биоэквивалентности (52 эквивалентных и 13 неэквивалентных) из открытых литературных источников [12—55]. Проведённый анализ чувствительности и специфичности на данной контрольной выборке показал сходные результаты — 92 и 77 %. Анализ на объединённых данных 355 исследований (304 эквивалентных и 51 неэквивалентных) показал результаты — 93 и 84 %.
Анализ чувствительности и специфичности метода по таблице прогнозирования 7 составил соответственно — 92 и 92 % для основной группы, 96 и 77 % для контрольной группы, 93 и 88 % для объединенных данных.
В табл. 8 представлены результаты проверки прогностических таблиц учётом правильных и неправильных ответов № 6.
Таблица 8
Результаты проверки диагностической таблицы
|
Группы |
Число исследований |
Ответы (в %) |
|
|---|---|---|---|
|
правильные |
неправильные |
||
|
С учётом коэффициента связи количества субъектов и вариабельности |
|||
|
Основная |
290 |
92,7 |
7,3 |
|
Контрольная |
65 |
89,2 |
10,8 |
|
Обе вместе |
355 |
92,1 |
7,9 |
|
С учётом коэффициентов внутрииндивидуальной вариабельности |
|||
|
Основная |
290 |
92,2 |
7,8 |
|
Контрольная |
65 |
92,3 |
7,7 |
|
Обе вместе |
355 |
92 |
8,0 |
Результаты проверки модели прогнозирования результатов исследований биоэквивалентности на основе обеих прогностических таблиц показали высокие значения чувствительности и специфичности. Максимальный процент ошибочных результатов в контрольной группе составил всего около 10 % при использовании прогностической таблицы с учётом коэффициента связи количества добровольцев и внутрииндивидуальной вариабельности. При использовании прогностической таблицы без учёта этого фактора, но с учётом данных по внутрииндивидуальной вариабельности Cmax и AUC0-t получены более точные прогнозы, процент ошибок по всем группам составил около 8 %.
Более точный прогноз с учётом коэффициентов внутрииндивидуальной вариабельности по всей видимости обусловлен, тем фактом, что коэффициенты внутрииндивидуальной вариабельности сами по себе демонстрируют связь между количеством добровольцев и мощностью исследований [2, 11]. Другими словами, факторы внутрииндивидуальной вариабельности Cmax и AUC0-t уже включают в себя фактор количества субъектов — чем выше вариабельность, тем больше количество добровольцев. В связи с чем включение дополнительного фактора, учитывающего размер выборки, вносит дополнительную погрешность в прогноз результатов исследований биоэквивалентности. Поэтому для получения более точного прогноза можно рекомендовать использовать прогностическую таблицу 7.
Ограничением предлагаемого метода прогноза может является, то, что 287 из 290 исследований были выполнены с простым перекрестным дизайном, и только 3 исследования с повторным дизайном.
Поэтому данный алгоритм должен использоваться при планировании исследований с простым перекрестным дизайном. Для исследований с повторным дизайном, данный алгоритм может быть также полезен, однако требует проведения дополнительного анализа чувствительности, специфичности и точности прогноза, с включением большого количества результатов исследований с повторным дизайном.
В настоящее время количество исследований с повторным дизайном ограничено т. к., не смотря на привлекательность уменьшения размера выборки, они сопряжены с определёнными трудностями, такими как временные затраты, сложность проведения самого исследования, сложность статистического анализа, более высокая нагрузка аналитической части исследования (большое количество отобранного материала для биоаналитического анализа) и др. Проверка разработанного алгоритма на основе результатов исследований с повторным дизайном будет являться целью последующих исследований.
Таким образом, разработанный алгоритм прогнозирования может использоваться при планировании исследований биоэквивалентности. В построенную модель включены регулируемые факторы (длительность забора крови, количество субъектов), факторы, оцениваемые по данным ранее проведённых исследований Cmax, tmax, CVintra Cmax CVintra AUC0-t), и планируемые факторы (т. е. ожидаемые границы 90 % доверительных интервалов и значения точечной оценки).
В случае получения отрицательного или неинформативного прогноза следует внести коррекцию в дизайн исследования, либо рассмотреть возможность проведения иных исследований, результаты которых могут позволить регистрацию воспроизведённого лекарственного препарата. Например, исследования терапевтической эквивалентности или исследования с фармакодинамическими конечными точками.
Стоит отметить, что данный алгоритм прогнозирования можно модифицировать с учётом накопления дополнительных данных, например, большего количества исследований или путём добавления дополнительных факторов, демонстрирующих достаточную информативность. Среди таких перспективных для анализа факторов могут быть результаты растворения in vitro или иные параметры связанные с качеством лекарственных препаратов (однородность дозирования действующего вещества, качественные и количественные различия состава вспомогательных веществ и т. д.), которые можно оценить до проведения исследований биоэквивалентности, и тем самым увеличив шансы на положительные результаты исследования.
Выводы
- Оценены показатели прогностической информативности различных факторов в отношении прогноза результатов биоэквивалентности. Наиболее информативные факторы: нижние и верхние границы 90 % доверительных интервалов для Cmax и AUC0-t, значения точечной оценки Cmax и AUC0-t, категория лекарственного препарата, коэффициент связи размера выборки и вариабельности Cmax и AUC0-t, коэффициенты внутрииндивидуальной вариабельности для Cmax и AUC0-t, значения tmax,
длительность забора крови, значения Cmax.
- Разработана прогностическая таблица наиболее информативных факторов со значениями прогностических коэффициентов (балов), сумма которых позволяет оценить прогноз результатов исследований биоэквивалентности.
- Разработан алгоритм прогнозирования результатов биоэквивалентности, который продемонстрировал высокие значения чувствительности (на уровне 90 %) и специфичности (на уровне 80 %) для основной и контрольной выборки исследований биоэквивалентности. Процент ошибочных результатов для основной и контрольной групп составил около 8 %.
Список литературы
1. Хохлов А.Л., Рыска М., Кукес В.Г. с соавт. Современные подходы к проведению биоаналитических исследований при создании лекарственных препаратов. – М.: Российская академия наук; 2018. [Khokhlov AL., Ryska M., Kukes VG. et al. Sovremennye podhody k provedeniju bioanaliticheskih issledovanij pri sozdanii lekarstvennyh preparatov. Moscow: Russian Academy of Sciences; 2018. (in Russ).].
2. Arnautov VS, Reikhart DV, Borisov AS. Determination of cohort size for studies of bioequivalence using computer modeling. Pharmaceutical Chemistry Journal. 2017;51(7):8 12. DOI: 10.1007/s11094-017-1648-6.
3. Решение Совета евразийской экономической комиссии от 3 ноября 2016 г. № 85 «Об утверждении Правил проведения исследований биоэквивалентности лекарственных препаратов в рамках Евразийского экономического союза» [Decision of the Council of the Eurasian Economic Commission of November 3, 2016 No. 85 « Ob utverzhdenii Pravil provedenija issledovanij biojekvivalentnosti lekarstvennyh preparatov v ramkah Evrazijskogo jekonomicheskogo sojuza». (In Russ).] Доступно по: https://docs.eaeunion.org/ria/ru-ru/0121136/ria_30062015_att.pdf. Ссылка активна на 08.05.2020.
4. US FDA (2014). Approved Drug Products with Therapeutic Equivalence Evaluations (Orange Book), 40th ed. [internet]; [cited 2020 May 08]; Available from: https://www.fda.gov/media/71474/download.
5. Тиньков А.Н., Московцева Н.И., Столбова М.В. Алгоритмы прогнозирования неблагоприятного течения ИБС после впервые перенесенного инфаркта миокарда. Современные проблемы науки и образования. 2013; 1: 59 69. [Tinkov AN, Moskovtseva NI, Stolbova MV. Algoritmy prognozirovanija neblagoprijatnogo techenija IBS posle vpervye perenesennogo infarkta miokarda. Modern problems of science and education. 2013; 1: 59 69. (in Russ).].
6. Вальд А. Последовательный анализ. М.: Физматлит; 1960. [Vald A. Posledovatel'nyj analiz. Moscow: Fizmatlit; 1960. (in Russ).]
7. Гублер Е.В., Генкин А.А. Применение непараметрических методов статистики в медико-биологических исследованиях. – Л.: Медицина; 1973. [Gubler EV, Genkin AA. Primenenie neparametricheskih metodov statistiki v mediko-biologicheskih issledovanijah. Leningrad: Medicina; 1973. (in Russ).].
8. Гублер Е.В. Вычислительные методы распознавания патологических процессов. Л.: Медицидна; 1970. [Gubler EV. Vychislitel'nye metody raspoznavanija patologicheskih processov. Leningrad: Medicina; 1970. (in Russ).].
9. Гублер Е.В. Информатика в патологии, клинической медицине и педиатрии. Л.: Медицина; 1990. [Gubler EV. Informatika v patologii, klinicheskoj medicine i pediatrii. Leningrad: Medicina; 1990 (in Russ).].
10. Chow S, Wang H. On sample size calculation in bioequivalence trials. J Pharmacokinet Pharmacodyn. 2001;28:155–169. DOI: 10.1023/A:1011503032353.
11. Ring A, Lang B, Kazaroho C, Labes D, et al. Sample size determination in bioequivalence studies using statistical assurance. British Journal of Clinical Pharmacology. 2019;85(10):2369 2377. DOI: 10.1111/bcp.14055.
12. Zakeri-Milani P, Ghanbarzadeh S, Lotfi poor F, Milani M, Valizadeh H. Pharmacokinetic study of two macrolide antibiotic oral suspensions using an optimized bioassay procedure. J Bioequiv Availab. 2010;2:111 115. DOI: 10.4172/jbb.1000041
13. Public assessment report of the Medicines Evaluation Board in the Netherlands azithromycin (as dihydrate). EU-procedure number: NL/H/2415/001-002/DC. [Internet]. [cited 2020 May 08]. Available from: https://www.geneesmiddeleninformatiebank.nl/Pars/h110860.pdf.
14. Yun M, Woo J, Kwon K. Bioequivalence and pharmacokinetics of 70 mg alendronate sodium tablets by measuring alendronate in plasma. Arch Pharm Res. 2006;29(4):328 32. DOI: 10.1007/BF02968579.
15. Liu Y, Jia J, Liu G, et al. Pharmacokinetics and bioequivalence evaluation of two formulations of 10-mg amlodipine besylate: an open-label, single-dose, randomized, two-way crossover study in healthy Chinese male volunteers. Clin Ther. 2009;31(4): 777–783. DOI: 10.1016/j.clinthera.2009.04.013.
16. Del Tacca M, Pasqualetti G, Di Paolo A, et al. Lack of pharmacokinetic bioequivalence between generic and branded amoxicillin formulations. A post-marketing clinical study on healthy volunteers. Br J Clin Pharmacol. 2009;68(1):34–42. DOI: 10.1111/j.1365-2125.2009.03399.x.
17. Li W, Bu F, Li R, et al. Bioequivalence study of warfarin in healthy chinese volunteers with a validated high-performance liquid chromatography-mass spectrometry method. Clin Pharmacol Drug Dev. 2018;7(3):256-262. DOI: 10.1002/cpdd.348.
18. Sornsuvit C, Niamhun N, Luengpiansamut N, et al. Pharmacokinetics and bioequivalence studies of warfarin sodium 5 milligrams tablet in healthy thai subjects. International Journal of Pharmacy and Pharmaceutical Sciences. 2015; 7(3):219 222.
19. Tjandrawinata RR, Setiawati E, Putri RS, et al. Single dose pharmacokinetic equivalence study of two gabapentin preparations in healthy subjects. Drug Des Devel Ther. 2014;8:1249–1255. DOI: 10.2147/DDDT.S69326.
20. Mak WY, Tan SS, Wong JW, et al. Pharmacokinetic comparison of two gabapentin formulations in healthy volunteers. J Bioequiv Availab. 2016;8:055 058. DOI: 10.4172/jbb.1000267.
21. Abbas M, Shaukat A, Nawaz M, et al. Bioequivalence of two formulations of gabapentin 400 mg capsules: single-dose, open-label, randomized, two- period crossover comparison in healthy pakistani adult subjects. Proceedings of the 6th Panhellenic Congress of Pharmacology; 2010 Jun 4-6; Heraklion, Crete, Hellas: Review of clinical pharmacology and pharmacocinetics, international edition; 2010. p. 116-19.
22. Yu Y, Teerenstra S, Vanmolkot F, et al. Interchangeability of gabapentin generic formulations in the netherlands: a comparative bioavailability study. Clinical Pharmacology & Therapeutics. 2013;94(4):519 524. DOI: 10.1038/clpt.2013.108
23. Hammami MM, De Padua SJS, Hussein R, et al. Generic-reference and generic-generic bioequivalence of forty-two, randomly-selected, on-market generic products of fourteen immediate-release oral drugs. BMC Pharmacol Toxicol. 2017;18(1):78. DOI: 10.1186/s40360-017-0182-1.
24. Public assessment report of the Medicines Evaluation Board in the Netherlands diltiazem hydrochloride EU-procedure number: NL/H/2691/001-002/DC. [Internet]. [cited 2020 May 08]. Available from: https://www.geneesmiddeleninformatiebank.nl/Pars/h112064.pdf.
25. Public assessment report scientific discussion Isotretinoin: DK/H/2242/001-002/DC. [Internet]. [cited 2020 May 08]. Available from: https://mri.cts-mrp.eu/Human/Downloads/DK_H_2242_002_PAR.
26. Public assessment report scientific discussion Isotretinoin: DK/H/2687/001-004/DC. [Internet]. [cited 2020 May 08]. Available from: https://mri.cts-mrp.eu/Human/Downloads/DK_H_2687_004_PAR.pdf.
27. Public assessment report scientific discussion Isotretinoin: NL/H/3739/001-002/DC. [Internet]. [cited 2020 May 08]. Available from: https://mri.cts-mrp.eu/Human/Downloads/nl_H_3739_002_PAR.pdf.
28. Vargas M, Villarraga E, Batista M, et al. Bioequivalence study of two formulations that contain isotretinoin 20 mg capsules in healthy Colombian volunteers. J Bioequiv Availab. 2016;8(6):274 277. DOI: 10.4172/jbb.1000308
29. Vargas M, Villarraga E, Mantilla P, et al. Bioequivalence study of two formulations containing isotretinoin in fed condition in Colombian healthy volunteers. MOJ Bioequiv Availab. 2018;5(6):288‒291. DOI: 10.15406/mojbb.2018.05.00116
30. Georgarakis M, Zougrou F, Tzavara S, et al. Comparative bioequivalence study of two isotretinoin soft gel capsule formulations in healthy male volunteers. International Journal of Clinical Pharmacology and Therapeutics. 2003;41(7):316‒322.
31. Public assessment report of the Medicines Evaluation Board in the Netherlands clarithromycin EU-procedure number: NL/H/2087/001-002/DC. [Internet]. [cited 2020 May 08]. Available from: https://www.geneesmiddeleninformatiebank.nl/Pars/h107902.pdf.
32. Public assessment report of the Medicines Evaluation Board in the Netherlands clarithromycin EU-procedure number: NL/H/2099/001-002/DC. [Internet]. [cited 2020 May 08]. Available from: https://www.geneesmiddeleninformatiebank.nl/Pars/h108098.pdf.
33. Richter W, Erenmemisoglu A, Van der Meer MJ, et al. Bioequivalence study of two different clopidogrel bisulfate film-coated tablets. Arzneimittelforschung. 2009;59(6):297 302. DOI: 10.1055/s-0031-1296400.
34. Public assessment report scientific discussion clopidogrel EU-procedure number: EMEA/H/C/001053. [Internet]. [cited 2020 May 08]. Available from: https://www.ema.europa.eu/en/documents/assessment-report/clopidogrel-teva-hydrogen-sulphate-epar-public-assessment-report_en.pdf.
35. Wright DH, Mols R, Brown KR, et al. Bioequivalence of alendronate and vitamin d3 in a combination tablet versus corresponding-dose individual tablets in healthy taiwanese volunteers, determined using a novel plasma alendronate assay. Curr Ther Res Clin Exp. 2015;77(10):116 121. DOI: 10.1016/j.curtheres.2015.10.001.
36. Adjei A, Teuscher NS, Kupper RJ, et al. Single-dose pharmacokinetics of methylphenidate extended-release multiple layer beads administered as intact capsule or sprinkles versus methylphenidate immediate-release tablets (ritalin) in healthy adult volunteers. Journal of child and adolescent psychopharmacology. 2014;24(10):570 578. DOI: 10.1089/cap.2013.0135
37. Weidekamm E, Rusing G, Caplain H, et al. Lack of bioequivalence of a generic mefloquine tablet with the standard product. Eur J Clin Pharmacol. 1998;54:615 619.
38. Ramírez Correa GS, Restrepo Valencia P, Pérez Guzmán M, et al. Estudio comparativo, cruzado, al azar, para la determinación de la bioequivalencia entre dos formulaciones de oxcarbazepina en tabletas. Iatreia. 2009;22(3): 205 212. (in Spanish).
39. Di Girolamo G, Opezzo JA, Schere D, et al. Parent drug and/or metabolite? Which of them is most appropriate to establish bioequivalence of two oral oxcarbazepine formulations in healthy volunteers? Expert Opin Pharmacother. 2007;8(10):1415 1423.
40. Jin C, Jeon JY, Im YJ, et al. Pharmacokinetic properties and bioequivalence of olmesartan medoxomil/hydrochlorothiazide in healthy Korean male subjects. Int. Journal of Clinical Pharmacology and Therapeutics. 2014;52(01):64–72. DOI: 10.5414/cp201991.
41. Lee J, Kim A, Yu KS, et al. Erratum: Pharmacokinetics and bioequivalence of two different 20 mg olmesartan tablets: A randomized, single-dose, two-period crossover study in healthy Korean male volunteers. Transl Clin Pharmacol. 2016;24(2):111 111. DOI: 10.12793/tcp.2016.24.2.111
42. Public assessment report scientific discussion olmesartan medoxomil EU-procedure number: NL/H/3128/001-003/DC. [Internet]. [cited 2020 May 08]. Available from: https://db.cbg-meb.nl/Pars/h115135.pdf.
43. Public assessment report scientific discussion olmesartan medoxomil EU-procedure number: DK/H/2520/001-003/DC. [Internet]. [cited 2020 May 08]. Available from: https://mri.cts-mrp.eu/Human/Downloads/DK_H_2520_003_PARSummary.
44. Ismail Z, Wahab MSA, Rahman ARA. Bioequivalence study of propranolol tablets. Eur J Gen Med. 2004;1(4):42-7. DOI: 10.29333/ejgm/82227.
45. Public assessment report of the Medicines Evaluation Board in the Netherlands propranolol hydrochloride EU-procedure number: NL/H/2564/001-003/MR. [Internet]. [cited 2020 May 08]. Available from: https://mri.cts-mrp.eu/Human/Downloads/nl_H_2564_003_PAR.pdf.
46. Public assessment report of the Medicines Evaluation Board in the Netherlands topiramate EU-procedure number: NL/H/861/03-04/DC. [Internet]. [cited 2020 May 08]. Available from: https://db.cbg-meb.nl/mri/par/nlh-0861-003-004.pdf.
47. Public assessment report of the Medicines Evaluation Board in the Netherlands topiramate EU-procedure number: NL/H/2916/001-004/MR. [Internet]. [cited 2020 May 08]. Available from: https://mri.cts-mrp.eu/Human/Downloads/nl_H_2916_004_PAR.pdf.
48. Saavedra I, Tamayo E, Gamboa A, et al. Relative bioavailability study with two oral formulations of topiramate using a validated UPLC-MS/MS method. Int J Clin Pharmacol Ther. 2010;48(5):342 348. DOI: 10.5414/cpp48342.
49. Godfrey AR, DiGiacinto J, Davis MW. Single-dose bioequivalence of 105-mg fenofibric acid tablets versus 145-mg fenofibrate tablets under fasting and fed conditions: a report of two phase i, open-label, single-dose, randomized, crossover clinical trials. Clinical Therapeutics. 2009;33(6):766 775. DOI: 10.1016/j.clinthera.2011.05.0470149-2918/$.
50. Verbeeck RK., De Niet S, Lebrun S, et al. The lidose hard capsule formulation of fenofibrate is suprabioavailable compared to the nanoparticle tablet formulation under high-fat fed conditions. J Pharm Pharm Sci. 2015;18(1):61 67.
51. Kees F, Bucher M, Schweda F, et al. Neoimmun versus Neoral: a bioequivalence study in healthy volunteers and influence of a fat-rich meal on the bioavailability of Neoimmun. Naunyn-Schmiedeberg’s Arch Pharmacol. 2007;375(6):393–399. DOI: 10.1007/s00210-007-0169-3.
52. Public assessment report scientific discussion everolimus EU-procedure number: SE/H/1707/01-03/DC. [Internet]. [cited 2020 May 08]. Available from: https://docetp.mpa.se/LMF/Everolimus%20Ethypharm%20tablet%20ENG%20PAR_09001be682a5d3bf.pdf.
53. Public assessment report scientific discussion everolimus EU-procedure number: NL/H/3987/001-003/DC. [Internet]. [cited 2020 May 08]. Available from: https://mri.cts-mrp.eu/Human/Downloads/nl_H_3987_003_PAR.pdf.
54. Public assessment report scientific discussion everolimus EU-procedure number: NL/H/3987/001-003/DC. [Internet]. [cited 2020 May 08]. Available from: https://mri.cts-mrp.eu/Human/Downloads/nl_H_3987_003_PAR.pdf.
55. Public assessment report of the medicines evaluation board in the Netherlands estradiol hemihydrate EU-procedure number: NL/H/685/01/MR. [Internet]. [cited 2020 May 08]. Available from: https://db.cbg-meb.nl/mri/par/nlh-0685-001.pdf.
Об авторах
Д. П. РомодановскийРоссия
к.м.н., главный эксперт управления №1 по эффективности и безопасности лекарственных средств Центра экспертизы и контроля готовых лекарственных средств, ФГБУ «Научный центр экспертизы средств медицинского применения»
А. Л. Хохлов
Россия
д.м.н., профессор, член-корр. РАН, зав. кафедрой клинической фармакологии, ФГБОУ ВО «Ярославский государственный медицинский университет»
Рецензия
Для цитирования:
Ромодановский Д.П., Хохлов А.Л. Возможность прогнозирования результатов исследований биоэквивалентности на основе последовательного статистического анализа информативных факторов. Качественная клиническая практика. 2020;(1):80-99. https://doi.org/10.37489/2588-0519-2020-1-80-99
For citation:
Romodanovsky D.P., Khokhlov A.L. The ability to predict the results of bioequivalence studies based on a consistent statistical analysis of informative factors. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2020;(1):80-99. (In Russ.) https://doi.org/10.37489/2588-0519-2020-1-80-99
















































