Перейти к:
Цифровизация клинических исследований: новые возможности применения искусственного интеллекта
https://doi.org/10.37489/2588-0519-2025-3-62-72
EDN: FAVBZS
Аннотация
Актуальность. Внедрение технологий искусственного интеллекта (ИИ) в клинические исследования (КИ) открывает новые горизонты для разработки лекарственных средств, однако сопряжено со значительными методологическими и регуляторными вызовами. Разрыв между скоростью технологического прогресса и его практической имплементацией требует разработки комплексных подходов для эффективной интеграции ИИ в исследовательскую практику.
Цель. Обобщить и систематизировать ключевые направления применения ИИ на этапе клинических исследований, выявить существующие барьеры и предложить решения для их преодоления.
Материалы и методы. Проведён обзор литературы и обобщение данных из актуальных научных публикаций, регуляторных документов и методических рекомендаций, посвящённых использованию ИИ в КИ в период с 01.09.2019 по 28.08.2025 гг. В качестве основы для структурирования материала использована концепция многоуровневой архитектуры ИИ, включающая перцептивный, когнитивный и решающий интеллект.
Результаты. В ходе настоящего анализа выделены ключевые направления применения ИИ в КИ: разработка дизайна и оптимизация рекрутинга пациентов с использованием цифровых «двойников», децентрализованный мониторинг данных, а также предиктивное выявление и оценка нежелательных явлений. Вместе с тем установлено, что потенциальное внедрение ИИ ограничивается рядом факторов: низким качеством и недостаточной полнотой исходных данных, трудностями интерпретации работы алгоритмов, отсутствием единых стандартов проверки достоверности, а также неопределённостью нормативно-правового регулирования. Для преодоления этих препятствий предложена многоуровневая модель интеграции ИИ, включающая технологический, организационный, этический и регуляторный уровни.
Заключение. Полноценная интеграция цифровых технологий в клинические исследования способна кардинально повысить их эффективность, при этом сократить сроки и стоимость разработки новых лекарственных средств. Мы считаем, что преодоление существующих барьеров требует скоординированных усилий научного сообщества, регуляторных органов и фармацевтической индустрии для создания единой экосистемы, обеспечивающей прозрачность, надежность и этичность применения цифровых технологий.
Ключевые слова
Для цитирования:
Зырянов С.К., Паршенков М.А., Яворский А.Н. Цифровизация клинических исследований: новые возможности применения искусственного интеллекта. Качественная клиническая практика. 2025;(3):62-72. https://doi.org/10.37489/2588-0519-2025-3-62-72. EDN: FAVBZS
For citation:
Zyryanov S.K., Parshenkov M.A., Yavorskiy A.N. Clinical trial digitalization: new opportunities for the use of artificial intelligence. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2025;(3):62-72. (In Russ.) https://doi.org/10.37489/2588-0519-2025-3-62-72. EDN: FAVBZS
Введение / Introduction
В XXI веке два таких взаимосвязанных элемента единой системы охраны здоровья человека как медицина и фармация переживают качественную трансформацию в условиях стремительной цифровизации и бурного развития искусственного интеллекта (ИИ) [1][2]. Ключевым фактором этих изменений выступает интеграция передовых цифровых технологий: больших языковых моделей (от англ. Large Language Models; LLM), алгоритмов машинного обучения, мультиомных аналитических платформ, систем компьютерного зрения для анализа медицинских изображений, а также решений для обработки данных с носимых устройств в реальном времени и сенсоров дистанционного мониторинга [3]. Представленные инструменты играют значимую роль в том числе на этапе клинических исследований лекарственных средств (ЛС); например, при уточнении критериев включения / невключения и стратификации пациентов, прогнозировании потенциальных нежелательных явлений (НЯ), выявлении и валидации референсных биомаркеров, а также уже на этапе анализа клинической данных [4][5].
В Российской Федерации развитие технологий искусственного интеллекта (ИИ) в здравоохранении отнесено к числу приоритетных направлений государственной политики, что закреплено Указом Президента РФ № 490 (ред. 15.02.2024) «О развитии искусственного интеллекта в Российской Федерации» [6]. Сопоставимые меры реализуются на международном уровне: «Европейский регламент об искусственном интеллекте» (от англ. Artificial Intelligence Act, 2024) и финальное правило HTI-1 (от англ. Health Data, Technology, and Interoperability: Certification Program Updates, Algorithm Transparency, and Information Sharing, 2023) Министерства здравоохранения США ориентированы на прозрачность при обмене цифровых данных, а также управлением рисками в области применения ИИ [7–9].
Тем не менее полноценное внедрение цифровых решений в рутинную практику на этапе клинических исследований (КИ) остаётся достаточно фрагментарным. Этот парадокс, получивший в научной литературе название «разрыв внедрения» (от англ. implementation gap) или «пропасть ИИ» (от англ. AI chasm), описывает системное несоответствие между скоростью научно-технического прогресса цифровизации и его фактической интеграцией на всех стадиях жизненного цикла ЛС [10][11].
Причины этого феномена многофакторны и включают технические, организационные и нормативно-правовые барьеры: отсутствие унифицированной валидации ИИ-моделей [12], ограниченная интерпретируемость сложных компьютерных моделей [13], неопределённость этических рамок [14][15]; неоднородность регулирования [16], а также банальный дефицит высококвалифицированных кадров [17]. Ситуацию усугубляет «линейная» модель внедрения цифровых технологий [18][19].
Несмотря на наличие значительного объёма исследований в специализированной литературе, комплексные методики интеграции ИИ в клиническую практику остаются лишь на ранней стадии развития. Отсутствие устоявшихся подходов к поэтапному внедрению и адаптации сложных компьютерных алгоритмов усиливает разрыв между лабораторными результатами и их реальным клиническим эффектом. Важнейшую роль в этом процессе играет грамотное управление клиническими исследованиями, которое, как подчёркивается в методическом руководстве под редакцией Белоусова Д. Ю., Зырянова С. К. и Колбина А. С., является основой для успешной разработки и внедрения новых лекарственных средств [20]. ИИ способен стать ключевым инструментом в руках исследователей, позволяя оптимизировать все этапы КИ, от планирования до анализа данных, и тем самым повысить их эффективность и качество.
В настоящем обзоре обобщены ключевые направления интеграции цифровых технологий в КИ, интегрирующие клинические, организационные, этические и регуляторные элементы, что позволяет не только унифицировать существующий опыт, но и предложить теоретическую основу для его воспроизводимой имплементации в рутинную исследовательскую практику.
Цель / Objective
Обобщить и систематизировать ключевые направления применения ИИ на этапе клинических исследований, выявить существующие барьеры и предложить решения для их преодоления.
Цифровые технологии на стадии разработки клинических исследований / Digital technologies
in clinical trial development
Искусственный интеллект представляют собой многоуровневую технологическую систему, включающую три взаимосвязанных блока: перцептивный интеллект (от англ. perceptual intelligence), отвечающий за способность «воспринимать» данные, аналогично человеческим органам чувств, с использованием технологий компьютерного зрения, распознавания речи и сенсорных систем [21][22]; когнитивный интеллект (от англ. cognitive intelligence), реализующий способность к логическим рассуждениям, индукции, выявлению закономерностей и накоплению знаний на основе методов обработки естественного языка, графов знаний и механизмов непрерывного обучения [23]; и наконец интеллект принятия решений (от англ. decision-making intelligence), ответственный за применение данных и алгоритмов для выбора оптимальных стратегий, включая автоматическое планирование, экспертные системы и платформы поддержки принятия решений (см. рис.) [24][25].
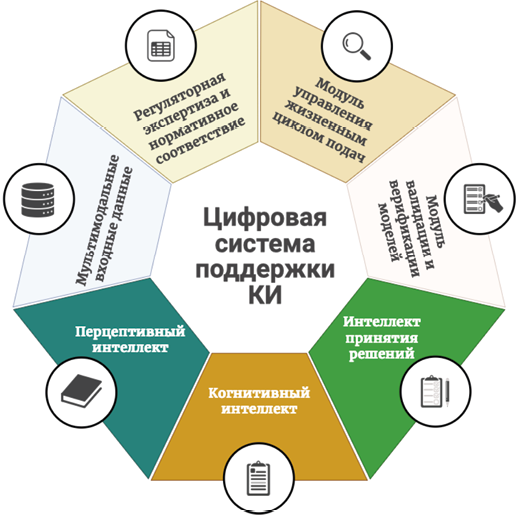
Рис. Система поддержки клинических исследований при помощи цифровых технологий
Fig. System for clinical trial support using digital technologies
Интеграция всех трёх уровней ИИ в архитектуру клинических исследований позволяет автоматизировать критически важные процессы на всех ключевых этапах. К примеру, на стадии подготовки к КИ цифровые технологии могут быть задействованы при аналитическом обзоре доказательной базы и формулировании гипотезы в структуре PICO (от англ. Patient, Intervention, Comparison, Outcome) [26]; согласовании протокола эксперимента с исследовательскими центрами; при расчёте мощности и размера необходимой выборки пациентов; подготовке документов и индивидуальных регистрационных карт (ИРК) / электронных ИРК (англ. Case Report Form; CRF / electronic Case Report Form; eCRF) [27][28]; наконец для централизованной валидации критериев включения / невключения и маршрутизации пациентов между площадками. Так, например в последней работе Kudrin et al., был представлен мультимодальный ИИ-движок для прогнозирования исходов КИ, что позволило заранее оценить вероятность успеха исследования и скорректировать его дизайн [29].
В то же время, параллельно другие учёные Denniston [30] и Agboola et al. [31] отмечают, что качество прогнозов цифровых технологий напрямую зависит от полноты и репрезентативности обучающих данных. Предвзятость в «исторических данных» (то есть базовые критерии / показатели, по которым осуществляется первоначальный и последующие итерации обучения цифровой модели) может привести к систематическим ошибкам в дизайне исследования, что, в свою очередь, негативно скажется на валидности и обобщаемости результатов [32]. Это подчёркивает необходимость строгой валидации ИИ-моделей и постоянного мониторинга их производительности в реальных условиях.
Оптимизация рекрутинга и стратификации пациентов. Одним из наиболее ресурсозатратных этапов клинических исследований является рекрутинг пациентов, где сложность обусловлена как строгими критериями включения / невключения, так и необходимостью их строгой верификации [33][34]. Применение методов ИИ открывает возможности для радикального пересмотра этого процесса. Анализируя электронные медицинские карты (ЭМК), лабораторные показатели и даже неструктурированные клинические заметки, ИИ способен автоматически выделять потенциальных кандидатов, соответствующих сложным протокольным требованиям [35-37], что сокращает время скрининга и снижает затраты медицинского учреждения.
Однако значение таких цифровых систем выходит далеко за пределы простого подбора участников. Алгоритмы машинного обучения позволяют формировать так называемые «пациентские траектории» — динамические модели, в которых интегрируются данные из различных источников данных: от многолетней истории анализов до результатов молекулярно-генетического профилирования каждого отдельно взятого человека [38][39]. Такой подход не только оптимизирует размер выборки, но и способствует выявлению наиболее релевантных конечных точек (то есть измеряемых клинических исходов), адаптированных к специфике пациентских подгрупп [40]. Более того, использование ИИ для прогнозирования исходов на основе полных массивов персонализированных данных делает возможным переход от статичной схемы набора к гибкой, итеративной стратегии рекрутинга и стратификации [41].
Цифровые «двойники». Применение цифровых «двойников» представляет собой одно из наиболее перспективных направлений оптимизации клинических исследований. Этот инструмент представляет собой инновационную технологию ИИ, обученную на обширных ретроспективных данных и модельных предсказаниях; причём уже сейчас технология позволяют существенно сокращать необходимый объём выборки и сроки проведения КИ, сохраняя при этом статистическую значимость результатов [42][43].
В медицинской литературе данная концепция описана как TwinRCTs (от англ. Twin Randomized Controlled Trials), основанная на создании «виртуального аватара» для каждого участника на базе ретроспективных данных о течении заболевания [44], которая позволяет достоверно оценить эффективность терапии путём сопоставления фактического эффекта у пациента с прогнозируемым исходом его цифрового двойника, устраняя необходимость в обширных плацебо-группах [45][46].
Данный подход уже получил предварительное одобрение Европейского агентства лекарственных средств (англ. European Medicines Agency; EMA), которое в проекте руководящих принципов допустило использование цифровых двойников в качестве контроля на поздних фазах КИ, отметив отсутствие значимой систематической погрешности цифровой модели [47]. Это решение отражает постепенное смещение регуляторной политики в сторону признания модельных данных как валидного источника доказательств, хотя пока оно носит только пилотный характер и требует подтверждения на более широких массивах клинических данных.
Вызовы внедрения цифровых «двойников». Несмотря на очевидные преимущества, широкое внедрение «цифровых пациентов» в клиническую практику сопряжено с рядом существенных вызовов и ограничений.
Во-первых, критически важным аспектом является качество и репрезентативность исходных данных, на которых обучаются модели цифровых «двойников». Неполные, предвзятые или нерелевантные данные могут привести к созданию клонов, неточно отражающих реальную биологию и реакцию пациентов на терапию, что, в свою очередь, ставит под сомнение валидность результатов КИ [48, 49]. В свою очередь, диспропорция полового состава участников (в зарубежной литературе чаще обозначаемая термином «гендерный разрыв данных», от англ. gender data gap) и недостаточное представительство различных этнических групп в существующих базах данных наглядно иллюстрируют данное ограничение, подчёркивая необходимость системных мер по его преодолению для обеспечения справедливости и непредвзятой воспроизводимости моделей ИИ [50].
Во-вторых, интерпретируемость и прозрачность алгоритмов, лежащих в основе цифровых «двойников», остаются серьёзной проблемой. Для регуляторных органов и клиницистов крайне важно понимать, как именно модель приходит к своим предсказаниям, чтобы обеспечить доверие и безопасность её использования. Отсутствие такой прозрачности может стать барьером для широкого принятия технологии, несмотря на её потенциальную эффективность [19].
В-третьих, нормативно-правовая база для использования цифровых «двойников» в КИ находится на стадии формирования. Хотя Европейское агентство лекарственных средств демонстрирует открытость к инновациям, тем не менее отсутствие чётких, унифицированных стандартов для валидации, верификации и регулирования этих технологий замедляет их масштабирование. Необходимость разработки новых подходов к оценке надёжности и безопасности виртуальных контрольных групп, а также их сопоставимости с традиционными методами, является первостепенной задачей [51][52].
Преодоление вызовов, связанных с внедрением цифровых «двойников» в КИ, возможно лишь при условии международной координации усилий научного сообщества, регуляторов и специалистов в области здравоохранения и цифровых технологий. Ключевым направлением в данном контексте является развитие методов объяснимого ИИ (от англ. Explainable Artificial Intelligence; XAI) [53], что в теории позволит повысить прозрачность алгоритмов и обеспечить их интерпретируемость. В добавок, фундаментальной предпосылкой надёжности моделей является создание обширных и репрезентативных массивов данных, отражающих разнородные реальные «учебные датасеты» (лишённые при этом любого рода предвзятости) — то есть массивы клинических показателей, на которых будет обучаться цифровая модель, поскольку именно такой подход определит справедливость и корректность реальных прогнозов.
Оценка эффективности и безопасности лекарственного средства. Несмотря на то, что каждая фаза КИ имеет свои уникальные цели и значение, в контексте данной работы особый интерес представляет именно II фаза КИ, где формируются основы определения оптимального диапазона доз и режимов введения лекарственных средств, а также предварительная оценка терапевтической эффективности и безопасности препарата в целевой популяции (в добавок, в отличие от I фазы КИ, сосредоточенной преимущественно на безопасности ЛС, именно II фаза позволяет перейти к проверке гипотезы о клинической эффективности) [22][54].
Таблица 1
Применение ИИ во II фазе клинических исследований: возможности и вызовы с учётом актуальных данных
Table 1
Application of AI in phase II clinical trials: prospects and challenges based on recent evidence
Область применения цифровых технологий | Возможности применения | Ключевые барьеры | Источники |
Оптимизация дозирования ЛС | Прогнозирование индивидуальной фармакокинетики / фармакодинамики; динамическая корректировка доз на основе персонализированных биомаркеров | Необходимость в больших объёмах высококачественных, мультимодальных данных; сложность валидации моделей для индивидуального дозирования | 59, 60 |
Стратификация пациентов | Выявление подгрупп пациентов с уникальным ответом на терапию; прецизионный отбор | Риск предвзятости в «обучающих» и «реальных» данных; этические вопросы, связанные с исключением пациентов; потребность в прозрачности алгоритмов | 54, 59 |
Прогноз эффективности / безопасности | Раннее выявление НЯ; прогнозирование ответа на лечение на основе комплексных данных | Недостаток стандартизированных методов оценки прогностической точности; сложность учёта всех факторов, влияющих на исход | 56, 61 |
Адаптация дизайн-моделей КИ | Динамическая корректировка протокола (размер выборки, дозовые группы) в реальном времени | Регуляторные барьеры; сложность статистического анализа данных из разнородных адаптивных исследований | 56, 62 |
Эффективность финансовых затрат | Автоматизация рутинных задач; оптимизация ресурсов; сокращение времени на принятие решений | Высокие начальные инвестиции | 26, 63 |
Примечания: ЛС — лекарственное средство; КИ — клинические исследования; НЯ — нежелательные явления.
Notes: ЛС — drug; КИ — clinical trials; НЯ — adverse events.
Цифровые решения вносят фундаментальные изменения в методологию II фазы КИ, предлагая беспрецедентные возможности для оптимизации дозирования и прецизионной стратификации пациентов (табл. 1). Традиционные подходы, основанные на эмпирическом подборе доз и широких критериях включения, часто приводят к неоптимальным результатам, увеличивая продолжительность и стоимость исследований, а также подвергая пациентов риску неэффективного лечения или нежелательных реакций [55][56]. Модели ИИ, напротив, способны анализировать гетерогенные и высокоразмерные данные, включая мультиомиксные профили (геномные, транскриптомные, протеомные, метаболомные и др.), данные электронных медицинских карт и показатели с носимых устройств, что позволяет выявлять тонкие биомаркеры ответа на терапию и прогнозировать нежелательные явления на индивидуальном уровне [57][58].
Как отмечают Azenkot T et al. (2025 г.), применение ИИ в онкологических КИ II и III фаз значительно повышает эффективность отбора пациентов и их дальнейшую стратификацию, что критически важно для определения оптимальной дозы и выявления подгрупп пациентов с наилучшим соотношением польза / риск [59]. Аналогично, в работе Shoda K et al. (2025 г.) показано, как ИИ-алгоритмы могут оптимизировать дозирование в реальном времени, предоставляя обратную связь и автоматизируя систему рисков, что особенно актуально для сложных заболеваний, таких как рак желудка [60]. Это позволяет не только сократить количество пациентов, подвергающихся неэффективному лечению, но и ускорить процесс принятия решений о переходе к следующей фазе исследования.
ИИ также способствует разработке адаптивных дизайнов II фазы КИ, где протокол исследования может динамически корректироваться на основе промежуточных данных. Это включает изменение размера выборки, корректировку дозовых групп или перераспределение пациентов между группами на основе их индивидуального ответа. Подобные адаптивные стратегии, усиленные ИИ, позволяют более эффективно использовать ресурсы и быстрее достигать статистически значимых результатов [19]. Однако, несмотря на очевидные преимущества, внедрение ИИ во II фазу КИ сталкивается с вызовами, связанными с необходимостью в высококачественных, стандартизированных и репрезентативных данных, а также с вопросами валидации, интерпретируемости и регуляторного одобрения ИИ-решений [64].
Перспективы развития цифровых технологий / Future Prospects of Digital Technologies
Несмотря на значительные достижения, будущее ИИ в области исследования ЛС зависит от решения ряда фундаментальных проблем, выходящих за рамки чисто технологических аспектов. Можно полагать, что дальнейшее развитие должно быть сосредоточено на создании целостной экосистемы цифровых инструментов, где инновации гармонично будут сочетаться с этическими нормами, регуляторной ясностью и междисциплинарным сотрудничеством.
Одним из ключевых направлений является переход от изолированных ИИ-решений к интегрированным платформам, способным поддерживать весь жизненный цикл КИ (от начальной гипотезы на этапе «поиска молекулы» до пострегистрационного мониторинга уже финального лекарственного препарата). Так, Bhaskar SMM (2025 г.) в своей последней работе выдвигают схожее предположение. Исследователи считают, что будущее медицины за гибридными моделями, сочетающими предиктивную аналитику, генеративный ИИ и симуляционное моделирование — что позволит не только оптимизировать отдельные лабораторные этапы исследований ЛС, но и создавать динамические, самообучающиеся системы для непрерывного улучшения всех фаз КИ [65]. Это требует разработки новых стандартов интероперабельности данных и интерфейсов прикладного программирования (от англ. Application Programming Interface; API), обеспечивающих бесшовный обмен информацией между различными системами и участниками исследований. В контексте этих перспектив особое внимание уделяется квантовым технологиям, которые, как отмечают российские учёные Кобякова О. С. и др., открывают новые горизонты для здравоохранения, предлагая беспрецедентные возможности для обработки огромных объёмов данных и моделирования сложных биологических систем, что может значительно ускорить разработку новых лекарственных препаратов и персонализированных терапий [66].
Другим критически важным аспектом является решение проблемы «регуляторной неопределённости». Ezeogu FL et al. (2025 г.) подчёркивают, что, несмотря на отдельные инициативы, до сих пор отсутствуют глобальные, гармонизированные стандарты валидации и сертификации ИИ-алгоритмов для использования в КИ [67]. Это создаёт серьёзные барьеры для масштабирования и международного признания ИИ-решений. Будущие усилия должны быть направлены на создание международных рабочих групп с участием регуляторов, представителей индустрии и научного сообщества для разработки единых протоколов оценки надёжности, безопасности и эффективности ИИ-инструментов.
Кроме того, необходимо уделить особое внимание этическим и социальным аспектам внедрения ИИ. Вопросы этики применения искусственного интеллекта в здравоохранении особенно остро обсуждаются в области здравоохранения в российском научном сообществе сегодня. Как отмечают многие исследователи, разработка и внедрение этических кодексов / принципов являются ключевыми для обеспечения ответственного использования ИИ в медицинской практике [68–70]. При этом этические принципы, например прозрачность, справедливость, подотчётность и безопасность данных, должны быть интегрированы на всех этапах жизненного цикла ИИ-систем, от их проектирования до внедрения и мониторинга. Васильев Ю. А. и соавторы в своей работе рассматривают ещё одну сторону вопроса этики и цифровых технология, подчёркивая важность этических принципов при разработке систем искусственного интеллекта для здравоохранения на самом начальном этапе, а также акцентируя внимание на необходимость соблюдения конфиденциальности данных, предотвращения дискриминации и обеспечения автономии пациента [71]. В России уже принят «Кодекс этики применения искусственного интеллекта в сфере охраны здоровья», который служит важным ориентиром для всех участников процесса [74][75]. Этот документ призван обеспечить баланс между инновационным потенциалом ИИ и защитой прав и интересов пациентов, а также способствовать формированию доверия к новым технологиям в обществе.
С другой стороны, Rosenzweig M et al. (2924 г.) указывают на риск усугубления существующего неравенства в доступе к инновационным методам лечения, если ИИ-модели будут обучаться на данных, не отражающих всё разнообразие популяций [74]. Исследователи считают, данный аспект требует разработки методологий для оценки и снижения предвзятости в алгоритмах, а также создания механизмов общественного контроля и вовлечения пациентов в процесс разработки и внедрения ИИ-технологий.
Наконец, будущие исследования должны быть направлены на изучение долгосрочного влияния ИИ на клиническую практику и систему здравоохранения в целом. Это включает оценку экономической эффективности ИИ-решений, их влияния на качество медицинской помощи и удовлетворённость пациентов, а также на трансформацию ролей и компетенций медицинских работников. Можно предполагать, что успех ИИ будет измеряться не только технологическими прорывами, но и его способностью реально улучшить исходы для пациентов и сделать систему здравоохранения более справедливой и эффективной.
Заключение / Conclusion
В настоящей работе были проанализированы ключевые направления применения искусственного интеллекта в клинических исследованиях. Целью анализа было показать реальную сторону вопроса интеграции цифровых решений в области исследования лекарственных средств.
При этом очевидно, что дальнейшее развитие невозможно без преодоления системных вызовов, включая вопросы валидации, стандартизации и этической приемлемости мультимодальных цифровых инструментов и методик. Очевидно, что успешная интеграция ИИ требует не локальных пилотных инициатив, а согласованных усилий международного сообщества, направленных на формирование единых подходов и создание устойчивой исследовательской экосистемы.
Истинная ценность ИИ заключается не в замещении, а в дополнении человеческой экспертизы. Только синергия алгоритмов и профессионального опыта клиницистов и исследователей позволит реализовать потенциал цифровых технологий, обеспечив новые стандарты эффективности, прозрачности и справедливости в разработке лекарственных средств.
Список литературы
1. Фармацевтическая отрасль 4.0. Цифровая трансформация / под общей редакцией Хохлова А.Л., Пятигорской Н.В. — Москва : Издательство ОКИ, 2025. — 312 с. : цв. ил. 37. ISBN 978-5-4465-4468-4. Режим доступа: https://izdat-oki.ru/farmacevticheskaya-otrasl-4-0-cifrovaya-transformaciya.
2. Карпов О.Э., Храмов А.Е. Информационные технологии, вычислительные системы и искусственный интеллект в медицине. – М.: ДПК Пресс; 2022. – 480 с. ISBN 978-5-91976-232-4.
3. Поройков В.В. Компьютерное конструирование лекарств: от поиска новых фармакологических веществ до системной фармакологии. Биомедицинская химия. 2020;66(1):30-41.
4. Zhang K, Meng X, Yan X, et al. Revolutionizing Health Care: The Transformative Impact of Large Language Models in Medicine. J Med Internet Res. 2025 Jan 7;27:e59069. doi: 10.2196/59069.
5. Malheiro V, Santos B, Figueiras A, Mascarenhas-Melo F. The Potential of Artificial Intelligence in Pharmaceutical Innovation: From Drug Discovery to Clinical Trials. Pharmaceuticals (Basel). 2025 May 25;18(6):788. doi: 10.3390/ph18060788.
6. Указ Президента Российской Федерации № 490 от 10 октября 2019 г. (ред. от 15.02.2024) «О развитии искусственного интеллекта в Российской Федерации». Доступно по: https://www.consultant.ru. Дата обращения: 02.08.2025.
7. European Parliament. EU AI Act: first regulation on artificial intelligence. – 2024. European Parliament.
8. The White House. Executive Order on the Safe, Secure, and Trustworthy Development and Use of Artificial Intelligence. – 2023.
9. Office of the National Coordinator for Health Information Technology, Department of Health and Human Services. Health Data, Technology, and Interoperability: Certification Program Updates, Algorithm Transparency, and Information Sharing. 45 CFR §170, 171. – 2024.
10. Koshechkin KA, Lebedev GS, Fartushnyi EN, Orlov YL. Holistic Approach for Artificial Intelligence Implementation in Pharmaceutical Products Lifecycle: A Meta-Analysis. Applied Sciences. 2022; 12(16):8373. https://doi.org/10.3390/app12168373.
11. Свечкарева И.Р., Гусев А.В., Колбин А.С. Перспективы искусственного интеллекта в доклинических и клинических исследованиях. Клиническая фармакология и фармакотерапия. 2025;34(1):14-19. DOI 10.32756/0869- 5490-2025 1-14-19.
12. Ahmed MI, Spooner B, Isherwood J, et al. A Systematic Review of the Barriers to the Implementation of Artificial Intelligence in Healthcare. Cureus. 2023 Oct 4;15(10):e46454. doi: 10.7759/cureus.46454.
13. Lu SC, Swisher CL, Chung C, et al. On the importance of interpretable machine learning predictions to inform clinical decision making in oncology. Front Oncol. 2023 Feb 28;13:1129380. doi: 10.3389/fonc.2023.1129380.
14. Chin MH, Afsar-Manesh N, Bierman AS, et al. Guiding Principles to Address the Impact of Algorithm Bias on Racial and Ethnic Disparities in Health and Health Care. JAMA Netw Open. 2023 Dec 1;6(12):e2345050. doi: 10.1001/jamanetworkopen.2023.45050.
15. Ueda D, Kakinuma T, Fujita S, et al. Fairness of artificial intelligence in healthcare: review and recommendations. Jpn J Radiol. 2024 Jan;42(1): 3-15. doi: 10.1007/s11604-023-01474-3.
16. Warraich HJ, Tazbaz T, Califf RM. FDA Perspective on the Regulation of Artificial Intelligence in Health Care and Biomedicine. JAMA. 2025 Jan 21;333(3):241-247. doi: 10.1001/jama.2024.21451.
17. Pavuluri S, Sangal R, Sather J, Taylor RA. Balancing act: the complex role of artificial intelligence in addressing burnout and healthcare workforce dynamics. BMJ Health Care Inform. 2024 Aug 24;31(1):e101120. doi: 10.1136/bmjhci-2024-101120.
18. Mumtaz H, Riaz MH, Wajid H, et al. Current challenges and potential solutions to the use of digital health technologies in evidence generation: a narrative review. Front Digit Health. 2023 Sep 28;5:1203945. doi: 10.3389/fdgth.2023.1203945.
19. Esmaeilzadeh P. Challenges and strategies for wide-scale artificial intelligence (AI) deployment in healthcare practices: A perspective for healthcare organizations. Artif Intell Med. 2024 May;151:102861. doi: 10.1016/j.artmed.2024.102861.
20. Управление клиническими исследованиями / под общ. ред. Белоусова Д. Ю., Зырянова С. К., Колбина А. С. — 1-е изд. — М. : Буки Веди : Издательство ОКИ, 2017. — 676 с. : ил. ISBN 978-5-4465-1602-5. ISBN 978-5-4465-1602-5. Режим доступа: https://izdat-oki.ru/upravlenie_klinicheskimi_issledovaniyami.
21. You JG, Hernandez-Boussard T, Pfeffer MA, et al. Clinical trials informed framework for real world clinical implementation and deployment of artificial intelligence applications. NPJ Digit Med. 2025 Feb 17;8(1):107. doi: 10.1038/s41746-025-01506-4.
22. Topol EJ. High-performance medicine: the convergence of human and artificial intelligence. Nat Med. 2019 Jan;25(1):44-56. doi: 10.1038/s41591-018-0300-7.
23. Akinrinmade AO, Adebile TM, Ezuma-Ebong C, et al. Artificial Intelligence in Healthcare: Perception and Reality. Cureus. 2023 Sep 20;15(9):e45594. doi: 10.7759/cureus.45594.
24. Costello J, Kaur M, Reformat MZ, Bolduc FV. Leveraging Knowledge Graphs and Natural Language Processing for Automated Web Resource Labeling and Knowledge Mobilization in Neurodevelopmental Disorders: Development and Usability Study. J Med Internet Res. 2023 Apr 17;25:e45268. doi: 10.2196/45268.
25. Chen Z, Liang N, Zhang H, et al. Harnessing the power of clinical decision support systems: challenges and opportunities. Open Heart. 2023 Nov 28;10(2):e002432. doi: 10.1136/openhrt-2023-002432.
26. Reason T, Langham J, Gimblett A. Automated Mass Extraction of Over 680,000 PICOs from Clinical Study Abstracts Using Generative AI: A Proof-of-Concept Study. Pharmaceut Med. 2024 Sep;38(5):365-372. doi: 10.1007/s40290-024-00539-6.
27. Cheng AC, Banasiewicz MK, Johnson JD, et al. Evaluating automated electronic case report form data entry from electronic health records. J Clin Transl Sci. 2022 Dec 14;7(1):e29. doi: 10.1017/cts.2022.514.
28. Harrer S, Shah P, Antony B, Hu J. Artificial Intelligence for Clinical Trial Design. Trends Pharmacol Sci. 2019 Aug;40(8):577-591. doi: 10.1016/j.tips.2019.05.005.
29. Kudrin R, Bushmakin I, Novitskaia O, et al. Multimodal AI engine for clinical trials outcome prediction: prospective case study H2 2023. 2023. doi: 10.13140/RG.2.2.10165.24809.
30. Denniston AK, Liu X. Responsible and evidence-based AI: 5 years on. Lancet Digit Health. 2024 May;6(5):e305-e307. doi: 10.1016/S2589-7500(24)00071-2.
31. Agboola OE, Agboola SS, Odeghe OB, et al. Computational Genome Engineering Through AI-CRISPR-Precision Medicine Integration in Modern Therapeutics. Ann Pharm Fr. 2025 Aug 7:S0003- 4509(25)00117-8. doi: 10.1016/j.pharma.2025.08.001.
32. Norori N, Hu Q, Aellen FM, et al. Addressing bias in big data and AI for health care: A call for open science. Patterns (N Y). 2021 Oct 8;2(10):100347. doi: 10.1016/j.patter.2021.100347.
33. Saint James Aquino Y. Making decisions: Bias in artificial intelligence and data driven diagnostic tools. Aust J Gen Pract. 2023 Jul;52(7):439- 442. doi: 10.31128/AJGP-12-22-6630.
34. Gross CP, Mallory R, Heiat A, Krumholz HM. Reporting the recruitment process in clinical trials: who are these patients and how did they get there? Ann Intern Med. 2002 Jul 2;137(1):10-6. doi: 10.7326/0003-4819-137-1-200207020-00007.
35. Nashwan AJ, Hani SB. Transforming cancer clinical trials: The integral role of artificial intelligence in electronic health records for efficient patient recruitment. Contemp Clin Trials Commun. 2023 Nov 7;36:101223. doi: 10.1016/j.conctc.2023.101223.
36. Miyasato G, Kasivajjala VC, Misra M, et al. AI-driven real-time patient identification for randomized controlled trials. J Clin Oncol. 2023;41(16_ suppl):e13565. doi: 10.1200/JCO.2023.41.16_suppl.e13565.
37. Ismail A, Al-Zoubi T, El Naqa I, Saeed H. The role of artificial intelligence in hastening time to recruitment in clinical trials. BJR Open. 2023 May 16;5(1):20220023. doi: 10.1259/bjro.20220023.
38. Allam A, Feuerriegel S, Rebhan M, Krauthammer M. Analyzing Patient Trajectories With Artificial Intelligence. J Med Internet Res. 2021 Dec 3;23(12):e29812. doi: 10.2196/29812.
39. Terranova N, Venkatakrishnan K. Machine Learning in Modeling Disease Trajectory and Treatment Outcomes: An Emerging Enabler for Model-Informed Precision Medicine. Clin Pharmacol Ther. 2024 Apr;115(4):720-726. doi: 10.1002/cpt.3153.
40. Birkenbihl C, de Jong J, Yalchyk I, Fröhlich H. Deep learning-based patient stratification for prognostic enrichment of clinical dementia trials. Brain Commun. 2024 Dec 16;6(6):fcae445. doi: 10.1093/braincomms/fcae445.
41. Qiu J, Hu Y, Li L, et al. Deep representation learning for clustering longitudinal survival data from electronic health records. Nat Commun. 2025 Mar 14;16(1):2534. doi: 10.1038/s41467-025-56625-z.
42. Шогенова З., Крымшокалова Д.А., Джамихова Ф.Х. Информационные системы цифровых двойников пациентов для комплексного представления и обработки медицинских данных. Вестник Адыгейского государственного университета. Серия: Естественно-математические и технические науки. 2025;1:47–54. doi: 10.53598/2410-3225-2025-1-356-47-54.
43. Bordukova M, Makarov N, Rodriguez-Esteban R, et al. Generative artificial intelligence empowers digital twins in drug discovery and clinical trials. Expert Opin Drug Discov. 2024 Jan-Jun;19(1):33-42. doi: 10.1080/17460441.2023.2273839.
44. Vishnu Priya N. EMA qualifies Unlearn’s AI-driven approach for smaller trials, 2022. Clinical Trials Arena. URL: https://www.clinicaltrialsarena.com/news/ema-qualifies-unlearn-approach/?cf-view. Дата обращения: 15.08.2025.
45. Zhang B, Zhang L, Chen Q, et al. Harnessing artificial intelligence to improve clinical trial design. Commun Med (Lond). 2023 Dec 21;3(1):191. doi: 10.1038/s43856-023-00425-3.
46. Walsh J. Reducing Placebo Burden: TwinRCTs and Their Impact on Clinical Trials. Unlearn.ai Blog. – 2023. [Walsh J. Reducing Placebo Burden: TwinRCTs and Their Impact on Clinical Trials. Unlearn.ai Blog. 2023. Available from: https://www.unlearn.ai/blog/reducing-placebo-burden-twinrcts-and-their-impact-on-clinical-trials. Accessed 2025 Aug 15].
47. Unlearn. European Medicines Agency qualifies Unlearn’s AI-powered method for running smaller, faster clinical trials. // BioSpace. – 2022. [Unlearn. European Medicines Agency qualifies Unlearn’s AI-powered method for running smaller, faster clinical trials. BioSpace. 2022. Available from: https://www.biospace.com/european-medicines-agency-qualifies-unlearn-s-ai-powered-method-for-running-smaller-faster-clinical-trials. Accessed 2025 Aug 15].
48. Luigi Rullo, Paths of Digital twins in the public sector. A systematic review of the social sciences literature. Rivista di Digital Politics. 2024:3;631-53, doi: 10.53227/116592.
49. Chang HC, Gitau AM, Kothapalli S, et al. Understanding the need for digital twins' data in patient advocacy and forecasting oncology. Front Artif Intell. 2023 Nov 10;6:1260361. doi: 10.3389/frai.2023.1260361.
50. Weinberger N, Hery D, Mahr D, et al. Beyond the gender data gap: co-creating equitable digital patient twins. Front Digit Health. 2025 Apr 30;7:1584415. doi: 10.3389/fdgth.2025.1584415.
51. Gelis L, Stoeckert I, Podhaisky HP. Digital Tools-Regulatory Considerations for Application in Clinical Trials. Ther Innov Regul Sci. 2023 Jul;57(4):769-782. doi: 10.1007/s43441-023-00535-z.
52. Sel K, Hawkins-Daarud A, Chaudhuri A, et al. Survey and perspective on verification, validation, and uncertainty quantification of digital twins for precision medicine. NPJ Digit Med. 2025 Jan 17;8(1):40. doi: 10.1038/s41746-025-01447-y.
53. Allen B. The Promise of Explainable AI in Digital Health for Precision Medicine: A Systematic Review. J Pers Med. 2024 Mar 1;14(3):277. doi: 10.3390/jpm14030277.
54. Lampreia F, Madeira C, Dores H. Digital health technologies and artificial intelligence in cardiovascular clinical trials: A landscape of the European space. Digit Health. 2024 Sep 5;10:20552076241277703. doi: 10.1177/20552076241277703.
55. Moglia V, Johnson O, Cook G, et al. Artificial intelligence methods applied to longitudinal data from electronic health records for prediction of cancer: a scoping review. BMC Med Res Methodol. 2025 Jan 28;25(1):24. doi: 10.1186/s12874-025-02473-w.
56. Teodoro D, Naderi N, Yazdani A, et al. A scoping review of artificial intelligence applications in clinical trial risk assessment. NPJ Digit Med. 2025 Jul 30;8(1):486. doi: 10.1038/s41746-025-01886-7.
57. Tong L, Shi W, Isgut M, et al. Integrating Multi-Omics Data With EHR for Precision Medicine Using Advanced Artificial Intelligence. IEEE Rev Biomed Eng. 2024;17:80-97. doi: 10.1109/RBME.2023.3324264.
58. Lipkova J, Chen RJ, Chen B, et al. Artificial intelligence for multimodal data integration in oncology. Cancer Cell. 2022 Oct 10;40(10):1095- 1110. doi: 10.1016/j.ccell.2022.09.012.
59. Azenkot T, Rivera DR, Stewart MD, Patel SP. Artificial Intelligence and Machine Learning Innovations to Improve Design and Representativeness in Oncology Clinical Trials. Am Soc Clin Oncol Educ Book. 2025 Jun;45(3):e473590. doi: 10.1200/EDBK-25-473590.
60. Shoda K, Kawaguchi Y, Maruyama S, Ichikawa D. Essential Updates 2023/2024: Recent Advances of Multimodal Approach in Patients for Gastric Cancer. Ann Gastroenterol Surg. 2025;0:1-9. doi:10.1002/ags3.70041.
61. Goh B, Bhaskar SMM. The role of artificial intelligence in optimizing management of atrial fibrillation in acute ischemic stroke. Ann N Y Acad Sci. 2024 Nov;1541(1):24-36. doi: 10.1111/nyas.15231.
62. Lifebit. AI Driven Drug Discovery: 5 Powerful Breakthroughs in 2025. // Lifebit Blog. – 2025. [Lifebit. AI Driven Drug Discovery: 5 Powerful Breakthroughs in 2025. Lifebit Blog. 2025. Available from: https://lifebit. ai/blog/ai-driven-drug-discovery. Accessed 2025 Aug 17].
63. Cascini F, Beccia F, Causio FA, et al. Scoping review of the current landscape of AI-based applications in clinical trials. Front Public Health. 2022 Aug 12;10:949377. doi: 10.3389/fpubh.2022.949377.
64. Sedano R, Solitano V, Vuyyuru SK, et al. Artificial intelligence to revolutionize IBD clinical trials: a comprehensive review. Therap Adv Gastroenterol. 2025 Feb 23;18:17562848251321915. doi: 10.1177/17562848251321915.
65. Bhask ar SMM. Medicine Meets Science: The Imperative of Scientific Research and Publishing for Physician-Scientists. Indian J Radiol Imaging. 2025 Jan 9;35(Suppl 1):S9-S17. doi: 10.1055/s-0044-1800803.
66. Кобякова О.С., Ерёмченко О.А., Канев А.А., Куракова Н.Г. Квантовые технологии в здравоохранении: анализ кейсов и перспектив. Врач и информационные технологии. 2025;(1):6-21. https://doi.org/10.25881/18110193_2025_1_6
67. Ezeogu FL, Franca MA, Opara J, Palama V, et al. Integrating AI-Based Therapeutic Design and Cloud Cybersecurity for Rare Genetic Diseases: A Systematic Review. Asian J Res Comput Sci. 2025;18(8):43-57. doi:10.9734/ajrcos/2025/v18i8739.
68. Королева Ю.И., Хохлов А.Л., Артемова О.Р., Костина Е.В., Зарубина Т.В. Кодекс этики применения искусственного интеллекта в сфере охраны здоровья в Российской Федерации. Врач и информационные технологии. 2025;(2):98-106. https://doi.org/10.25881/18110193_2025_2_98
69. Хохлов А.Л., Зарубина Т.В., Котловский М.Ю., Павлов А.В., Потапов М.П., Солдатова О.Н. и др. Механизмы внедрения технологий искусственного интеллекта в здравоохранение: новые этические вызовы. Медицинская этика. 2024;(3):4–10. DOI: 10.24075/medet.2024.018.
70. Кошечкин К.А., Хохлов А.Л. Этические проблемы внедрения искусственного интеллекта в здравоохранении. Медицинская этика. 2024;(1):12–9. DOI: 10.24075/medet.2024.006
71. Васильев Ю.А., Гусев А.В., Михайлова А.А., Шарова Д.Е., Арзамасов К.М., Владзимирский А.В. Этические принципы разработки систем искусственного интеллекта для здравоохранения. Врач и информационные технологии. 2023;(4):36-41. https://doi.org/10.25881/18110193_2023_4_36
72. Кодекс этики применения искусственного интеллекта в сфере охраны здоровья. // Портал оперативного взаимодействия участников ЕГИСЗ. – Март 2025. Доступно по: https://portal.egisz.rosminzdrav.ru/news/1001. Ссылка активна на 23.08.2025.
73. Кодекс этики применения искусственного интеллекта в сфере охраны здоровья. Версия 2.1 (утв. Межведомственной рабочей группой при Минздраве России по вопросам создания, развития и внедрения в клиническую практику медицинских изделий и сервисов с использованием технологий искусственного интеллекта, протокол от 14 февраля 2025 г. N 90/18-0/117). – 21 августа 2025. Доступно по: https://www.garant.ru/products/ipo/prime/doc/411615533/. Ссылка активна на 21.08.2025.
74. Rosenzweig M, Belcher SM, Braithwaite LE, et al. Research Priorities of the Oncology Nursing Society: 2024-2027. Oncol Nurs Forum. 2024 Oct 17;51(6):502-515. doi: 10.1188/24.ONF.502-515.
Об авторах
С. К. ЗыряновРоссия
Зырянов Сергей Кенсаринович — д. м. н., профессор, зав. кафедрой общей и клинической фармакологии
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
М. А. Паршенков
Россия
Паршенков Михаил Алексеевич — младший научный сотрудник кафедры токсикологической и фармацевтической химии им. А. П. Арзамасцева Института фармации им. А. П. Нелюбина
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
А. Н. Яворский
Россия
Яворский Александр Николаевич — д. м. н., профессор, советник генерального директора
Москва
Конфликт интересов:
Авторы заявляют об отсутствии конфликта интересов
Рецензия
Для цитирования:
Зырянов С.К., Паршенков М.А., Яворский А.Н. Цифровизация клинических исследований: новые возможности применения искусственного интеллекта. Качественная клиническая практика. 2025;(3):62-72. https://doi.org/10.37489/2588-0519-2025-3-62-72. EDN: FAVBZS
For citation:
Zyryanov S.K., Parshenkov M.A., Yavorskiy A.N. Clinical trial digitalization: new opportunities for the use of artificial intelligence. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2025;(3):62-72. (In Russ.) https://doi.org/10.37489/2588-0519-2025-3-62-72. EDN: FAVBZS
JATS XML

















































