Перейти к:
Исследования безопасности лекарственных препаратов при беременности на основе данных из нормативных источников информации: систематический обзор
https://doi.org/10.37489/2588-0519-2025-2-46-65
EDN: URCNGY
Аннотация
Актуальность. Пренатальное воздействие лекарственных препаратов с тератогенным риском и профилактика такого воздействия являются важной клинической проблемой и проблемой общественного здравоохранения. Первоочередной задачей безопасного использования лекарственных препаратов женщинами репродуктивного возраста, в том числе во время беременности, является знание тератогенного риска и включение его в первичный источник информации.
Цель. Провести систематический обзор литературы с целью выявления и сравнения результатов исследований безопасности лекарственных препаратов, в которых имелись указания на использование данных из официально признанных информационных документов, при беременности.
Материал и методы. Поиск литературы проводился в электронных базах данных MEDLINE/PubMed с 1 января 2000 г. по 30 июня 2024 г. с использованием специальных ключевых слов и терминов MeSH (Medical Subject Headings) в сочетании с логическими операторами «AND» и «OR». Для ручного отбора публикаций также использовалась поисковая система Google Scholar.
Результаты. В результате поиска было обнаружено 24 публикации, которые имели отношение к изучаемой теме и были включены в анализ. Исследования нормативных документов по оценке полноты, применимости и безопасности информации о применении лекарственных препаратов при беременности (n = 3; 12,5 %) выявили отсутствие достаточных данных о людях. Сравнительные исследования несоответствий между различными источниками информации (n = 10;
41,7 %) показали расхождения между странами в содержании информации о лекарственных препаратах, выпускаемых одними и теми же фармацевтическими компаниями, а также различия между разными источниками утверждённой информации. Ряд исследований (n = 5; 20,8 %) касались современных систем классификации рисков при беременности, эффективности информации для предупреждения о тератогенности лекарственных препаратов и адаптации её содержания к уровню восприятия риска. В США информация о назначении препарата разделена на специальные подразделы, содержание которых регулируется недавно опубликованным Правилом маркировки при беременности и лактации (PLLR), которое стало предметом особого интереса в нескольких исследованиях (n = 6; 25,0 %).
Заключение. Растущее использование во время беременности лекарственных препаратов во всём мире и ежегодная регистрация новых препаратов, большинство из которых содержат ограниченную информацию о безопасности при беременности или не содержат её вовсе, подтверждают актуальность данного систематического обзора.
Ключевые слова
Для цитирования:
Решетько О.В., Луцевич К.А., Луцевич Т.С. Исследования безопасности лекарственных препаратов при беременности на основе данных из нормативных источников информации: систематический обзор. Качественная клиническая практика. 2025;(2):46-65. https://doi.org/10.37489/2588-0519-2025-2-46-65. EDN: URCNGY
For citation:
Reshetko O.V., Lutsevich K.A., Lutsevich T.S. Drug safety studies in pregnancy based on data from regulatory information sources: a systematic review. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2025;(2):46-65. (In Russ.) https://doi.org/10.37489/2588-0519-2025-2-46-65. EDN: URCNGY
Введение / Introduction
При разработке и регистрации нового лекарственного препарата (ЛП) решающее значение имеет сбор данных и обобщение обширных знаний, поскольку нормативная информация о препарате играет важную роль как в регуляторной, так и в клинической практике. Решение регуляторов о том, что ЛП безопасен, не означает отсутствия терапевтических рисков, а скорее свидетельствует, что клинические преимущества препарата перевешивают его известные и потенциальные риски. Все ЛП несут в себе риски, снижение базового уровня которых считается обязательным. При этом ключевым компонентом выступает информация о продукте/маркировка, которая предоставляет знание о рисках и указывает на рутинные меры по их минимизации [1]. Хотя эти стандартные меры широко известны, важно осознавать их роль в комплексной стратегии минимизации рисков и понимать их существенные региональные различия.
Подготовленная производителем и утверждённая регуляторным органом «письменная информация о лекарственном препарате» (Written Medicine Information; WMI) представляет информационно-коммуникационный документ, призванный улучшить понимание пациентами и медицинскими работниками терапевтической природы рецептурного препарата, в частности, его безопасности, эффективности и применения [2][3]. Однако WMI не обеспечивает оптимального назначения и отпуска ЛП [4]. Основными вариантами являются WMI, предназначенные для медицинских работников. В различных регионах или странах с разной юрисдикцией они известны как «информация о назначении» (Prescribing Information; USPI) в Соединённых Штатах Америки (США), «краткое изложение характеристик продукта» (Summaries of Product Characteristics; SmPC) в Европейском союзе (ЕС) или «информация о продукте» (Product Information; PI) в Австралии [2]. Чтобы получить более полную информацию о безопасности фармакотерапии для принятия решений пациентами и медицинскими работниками и свести к минимуму неопределённость в отношении потенциальных рисков, необходимо гармонизировать нормативную информацию о ЛП по всему миру [5].
Обоснование исследования / Justification of the study
Трагедия с талидомидом в начале 1960-х гг. стала отправной точкой для изменения регуляторного процесса утверждения новых ЛП и ключевым фактором в современной эволюции правил доказательства их безопасности [6]. Поскольку WMI утверждается уполномоченным органом, этот документ носит официальный характер. Общие требования к его содержанию и оформлению требуют детальной проработки как на законодательном, так и на научном уровне. В то же время рекомендации по фармакотерапии при беременности и в период грудного вскармливания считаются достаточно сложной проблемой, требующей специального информационного сопровождения [7]. В этой связи данные о применении ЛП во время беременности входят в информационное наполнение документа WMI, подготовленного производителем и одобренного регуляторными органами [8].
Важным аспектом фармакологической безопасности при беременности является защита развивающегося потомства от потенциальных неблагоприятных последствий внутриутробного воздействия, принимаемых матерью ЛП, среди которых тератогенность считается одним из наиболее серьёзных рисков [9][10]. Тщательная оценка риска онтогенетической токсичности должна включать не только структурные пороки развития, но и функциональные дефекты, изменения роста плода, выкидыши, мертворождения, неонатальную смертность и послеродовые осложнения [11]. Необходимо учитывать сложность анализа соотношения риска и пользы при выборе фармакотерапии, как у беременных, так и у женщин репродуктивного возраста. В то же время документы WMI являются одной из мер по безопасному использованию ЛП женщинами репродуктивного возраста. Их модификация в отношении предупреждения беременности может быть полезна в контексте общей политики по минимизации риска специфических тератогенов [12]. В настоящее время спектр регуляторных подходов к управлению известным или потенциальным тератогенным риском ЛП распространяется от правил сбора доклинической информации до требований по разработке стратегии оценки и минимизации риска. Между тем в существующей системе здравоохранения сбор данных о пренатальном воздействии ЛП направлен в первую очередь на характеристику тератогенного риска, а не на оценку эффективности стратегий управления рисками [12].
Цель / Objective
Провести систематический обзор литературы с целью выявления и сравнения результатов исследований безопасности лекарственных препаратов, в которых имелись указания на использование данных из официально признанных информационных документов, при беременности.
Методы / Methods
При написании данной статьи руководствовались заявлением PRISMA (Предпочтительные элементы отчётности для систематических обзоров и метаанализов) [13].
Стратегия поиска / Search strategy
Поиск литературы проводился в электронных базах данных MEDLINE/PubMed с 1 января 2000 года по 30 июня 2024 года. Статьи были представлены только на английском языке, не ограничивая поиск по стране исследования. Опубликованные постеры конференций и тезисы докладов не подлежали включению. Соответствующие медицинские предметные рубрики (MeSH) и конкретные ключевые слова объединялись с использованием логических операторов в поисковых терминах и руководствовались критериями, приведёнными в таблице 1.
Для обеспечения максимальной чувствительности использовались поисковые термины, которые объединялись после удаления дублирующих статей. Кроме того, публикации отбирались вручную через поисковую систему Google Scholar.
Таблица 1
Стратегия поиска для MEDLINE/PubMed: концепты и примеры используемых фраз
Table 1
Search strategy for MEDLINE/PubMed: concepts and examples of phrases used
Концепты / Concepts | Примеры используемых фраз / Examples of phrases used |
Популяция | “pregnancy”, “pregnant women” or “pregnan*” |
Письменная информация о лекарственном препарате | “drug labeling”, “drug information”, “prescribing information”, “product information”, “summary of product characteristics” |
Безопасность лекарственных препаратов | “pregnancy risk category”, “drug safety”, “fetal risk”, “teratogen*” |
Критерии приемлемости / Acceptance criteria
Критерии приемлемости исследований, включённых в обзор, были следующими: публикации, оценивающие разделы/подразделы применения при беременности и/или грудном вскармливании в официально признанной информации по применению любого лекарственного препарата с точки зрения надёжности, полноты содержания, применимости, специфического или потенциального тератогенного риска и не только, с сообщениями о любом результате (качественном или количественном). В связи с неоднородностью исследований было принято предварительное решение о том, что результаты будут обобщены в описательной форме.
Процесс сбора данных, элементы данных и риск предвзятости в отдельных исследованиях / Data collection process, data elements, and risk of bias in individual studies
Два исследователя независимо друг от друга оценивали приемлемость оригинальных англоязычных источников в три этапа: просмотр названий, аннотаций и полнотекстовых статей на основе установленных критериев. Разногласия обсуждались до достижения консенсуса и перекрёстной проверки третьим исследователем.
Статьи для обзора отбирались на основании их соответствия теме, а их библиографические ссылки использовались для дальнейшего поиска («снежный ком») потенциально релевантных публикаций, отвечающих критериям приемлемости. Из каждой отобранной статьи были извлечены и сведены в таблицу следующие типы данных: автор и год публикации, географическое местоположение, источники данных и методология исследования (дизайн), итоговый показатель, результаты и выводы. В целях категоризации включённых переменных и обобщения исследования были отнесены к одной из следующих взаимоисключающих групп по дизайну и аналитическому подходу: перекрёстное единичное исследование или другой тип исследования. Аналитические подходы были разделены на описательный анализ (с проверкой или без проверки статистической значимости) и другие методы. В описательных исследованиях для категориальных переменных данные чаще всего выражались в цифрах и процентах. Качество исследований оценивалось с помощью стандартизированного подхода критической оценки, при этом формальная оценка систематической ошибки (смещения) не проводилась для всех публикаций.
Результаты / Results
Выбор исследования / Research choice
В результате поиска было найдено 1647 потенциально релевантных статей. После удаления дубликатов было рассмотрено 1558 рефератов, которые были проверены на соответствие критериям включения. На основании критериев включения 159 статей были отобраны для дальнейшей оценки. В общей сложности 24 исследования были признаны приемлемыми для включения в обзор [14–37]. Полный процесс поиска литературы и выбора исследований представлен на рисунке 1.
Научные статьи были получены из следующих регионов и стран: Северная Америка — 11 статей (десять из США и одна из Канады), Европа — 8 (по две из Италии и Норвегии, по одной из Дании, Португалии, Швейцарии и Швеции), Азия — 3 (две из Южной Кореи и одна из Турции), Австралия — 2 (табл. 2). Результаты десяти исследований (41,7 %) были опубликованы за последние пять лет (2018–2022 гг.).
Собиралась информация о применении ЛП при беременности и в период кормления грудью (n=10; 41,7 %) [16][20–22][24][27][31][34–36], только при беременности (n=12; 50,0 %) [14][15][17–19][23][26][28][29][32][33][37] или только в период кормления грудью (n=2; 8,3 %) [25][30]. В ряде исследований рассматривались препараты из определённой терапевтической группы [21][23][25][35] или из разных групп [20][27][30][31][33][34]. Лишь в нескольких исследованиях использовалась система анатомо-терапевтической химической классификации (АТХ) Всемирной организации здравоохранения (ВОЗ) для определения терапевтического класса препарата [17][23][35] или отмечалась категоризация потенциального риска для плода при использовании препарата [20][35].
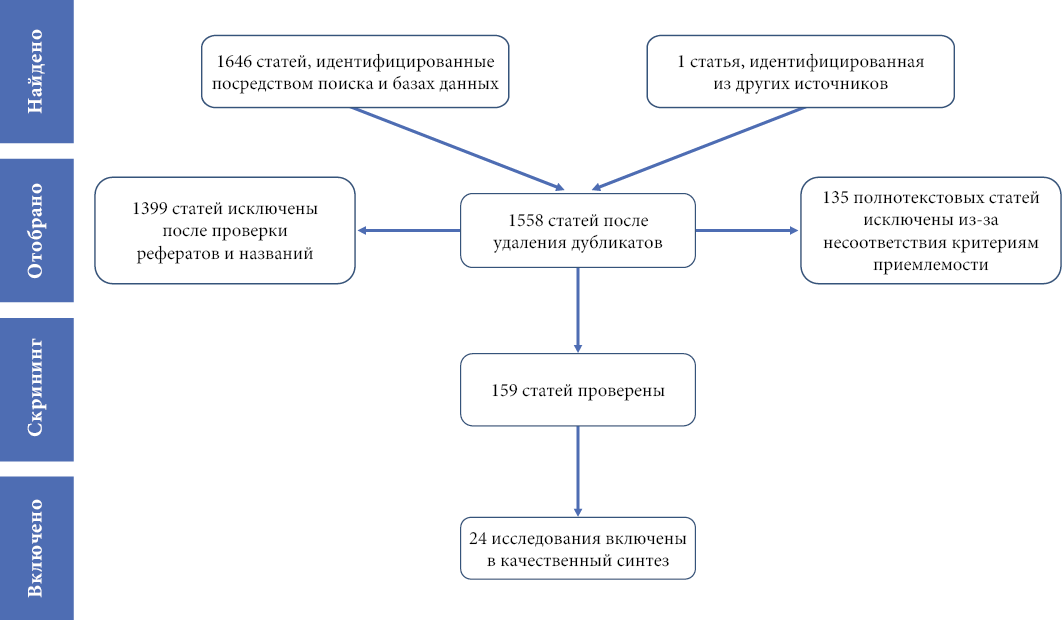
Рис. 1. Схема отбора исследований
Fig. 1. Flow diagram of selection of studies
Примечания: Причины исключения статей (исследований) из обзора: 86 — ошибочная тема, 18 — не связаны с беременными, 12 — реферат конференции или полный текст недоступен, 13 — не оригинальное исследование, 6 — комментарии и статьи, анализирующие влияние других вмешательств.
Notes: Reasons for excluding articles (studies) from the review: 86 — erroneous topic, 18 — not related to pregnant women, 12 — conference abstract or full-text unavailable, 13 — not original research, 6 — commentaries and articles analyzing the impact of other interventions.
Таблица 2
Основные характеристики исследований, включённых в систематический обзор (n=24)
Table 2
The main characteristics of the studies included in the systematic review (n=24)
Автор (дата публикации) / Author (Publication Date) | Страна / Country | Источники данных и методология исследования (дизайн) / Data sources and research methodology (design) | Показатель результата / Outcome measure | Результаты и выводы / Results and conclusions |
Addis A, et al. (2000) [14] | Италия | Для ЛП, классифицированных как тератогенные, данные о тератогенности и нежелательных реакциях при беременности были получены путём поиска в MEDLINE (с 1966 по 1998 гг.). | Согласованность и критерии классификации риска ЛП при беременности в трёх широко используемых международных системах классификации риска. | Только 61 (26 %) из 236 препаратов, общих для всех трёх систем классификации (FDA, ADEC и FASS), были отнесены к одной и той же категории факторов риска. Вариативность в распределении категорий обусловлена не только различными определениями категорий, но и зависит от того, как обрабатывается имеющаяся научная литература, ограничивая полезность и надёжность систем классификации. |
Pole M, et al. (2000) [15] | Канада | Беременных и их партнёров, а также медицинских работников (n=240) попросили выбрать из четырёх препаратов, описывая их безопасность, «самый безопасный». Хотя текст для всех препаратов был схожим, название и описание были изменены путём использования таких терминов, как пороки развития и аномалии, чтобы сделать их более или менее «успокаивающими». | Восприятие тератогенного риска беременными и их партнёрами, а также медицинскими работниками. | Было установлено, что восприятие тератогенного риска, даже для безопасных препаратов, является высоким и его трудно изменить, в том числе имея информацию, основанную на фактических данных. |
Boothby L, Doering P (2001) [16] | США | Данные о безопасности ЛП при беременности и кормлении грудью были получены с веб-сайта FDA и из различных источников информации, в частности, из Настольного справочника врача (PDR). | Текущая система классификации рисков для ЛП и оценка недавно предложенной FDA системы маркировки при беременности. | В настоящее время только 40 % препаратов в PDR имеют категории беременности. Предлагаемая система маркировки при беременности направлена на то, чтобы быть более клинически полезной, полагаясь на данные из регистров беременности. |
Frost Widnes SK, Schjott J (2008) [17] | Норвегия | Предоставленные в 2003 и 2005 гг. Центрами фармацевтической информации (RELIS) рекомендации по лекарственной безопасности при беременности сравнивались с таковыми по соответствующим препаратам в справочнике Felleskatalogen (FK). Сравнение основывалось на отнесении рекомендаций к одной из четырёх категорий. | Сравнение двух информационных ресурсов по безопасности ЛП при беременности. | Всего было категоризировано 443 рекомендации по применению ЛП при беременности. Семь из десяти препаратов, о которых часто поступал запрос, были действующими на нервную систему (согласно системе АТХ группа N). Для 208 (47 %) препаратов рекомендации между RELIS и FK отличались, будучи в FK существенно (p <0,01) более строгими, чем заявленные RELIS. |
You WB et al. (2011) [18] | США | Вторичный анализ трёхсторонней перекрёстной оценки данных опроса ЖРВ (n=132), которым были назначены ЛП с текущим предупреждением о тератогенном риске в USPI с упрощённым текстом или с упрощённым текстом и иконкой. | Эффективность стратегии USPI для улучшения понимания предупреждения о тератогенности. | Понимание USPI препарата было выше в случае наличия иконки (94 %), чем для стандартной и улучшенной текстовой информации (76 % и 79 %), соответственно (p <0,05). Поправка на возраст, расу/этничность, образование, грамотность и количество принимаемых препаратов показала, что информация с улучшенным текстом и иконкой обеспечивает лучшее понимание (соотношение рисков по сравнению со стандартом 1,26; 95 % ДИ: 1,04–1,53; по сравнению только с улучшенным текстом 1,22; 95 % ДИ: 1,02–1,46). |
Widnes SF et al. (2013) [19] | Норвегия | Опрос беременных (n=171), посещающих ультразвуковое сканирование на сроке 17–19 недель беременности, и их врачей общей практики (n=74), составивших 98 пар. Анкета содержала аутентичный текст, связанный с беременностью, из PIL шести препаратов с различными показаниями к применению. | Восприятие тератогенного риска и показатель уверенности при использовании ЛП в парах беременных и их врачей общей практики. | Беременные в сравнении с врачами общей практики имели более высокое восприятие тератогенного риска и более низкие показатели уверенности в использовании ЛП. Формулировка информации о препарате может влиять на восприятие тератогенного риска и, следовательно, на назначение и приверженность медикаментозному лечению. |
Mazer-Amirshahi M et al. (2014) [20] | США | В USPI 213 новых препаратов, зарегистрированных в 2003–2012 гг., были оценены данные в отношении тератогенного риска, источника данных о беременности и грудном вскармливании (на животных и людях), о родах и родоразрешении, наличия регистра беременности, «предупреждения в рамке» и использования нового формата USPI PLR, принятого в 2006 г. | Разделы USPI ЛП при беременности и в период грудного вскармливания на момент регистрации и последующие изменения. | Наиболее часто для ЛП при беременности FDA одобрялась категория риска С (51,6 %). Для 92,9 % препаратов данные о беременности были получены в исследованиях на животных, а в случае 5,2 % — на людях. Что касается грудного вскармливания, данные отсутствовали в 47,9 % источников. В 85,9 % источников отсутствовали данные о родах и родоразрешении. Только 2,8 % препаратов содержали данные о людях, а остальные — данные о животных. Для 85 % препаратов отсутствовали регистры беременности. Семь препаратов имели связанное с тератогенным риском «предупреждение в рамке». Новый формат PLR использовался для 4,7 % препаратов, главным образом одобренных в 2012 г. |
Warrer P et al. (2014) [21] | Дания | Исследованы источники информации о препаратах для лечения синдрома дефицита внимания и гиперактивности во время беременности и в период грудного вскармливания, продаваемые одними и теми же фармацевтическими компаниями в Австралии, США, Дании и Великобритании. | Межстрановые расхождения источников информации о применении ЛП при беременности и в период грудного вскармливания. | Были обнаружены несоответствия между странами в отношении источников представленных данных о животных и людях, типов рисков, перечисленных в отношении воздействия при беременности и в период грудного вскармливания, информации о выделении препарата в грудное молоко и рекомендаций по применению. Было обнаружено соответствие между источниками информации для препаратов, продаваемых в ЕС. |
Brown E et al. (2014) [22] | Австралия | С помощью полуструктурированной анкеты изучали мнение и опыт врачей-акушеров и больничных фармацевтов (n=41) относительно рекомендаций в разных источниках информации применения ЛП при беременности и в период грудного вскармливания. | Восприятие медицинскими работниками разных источников информации относительно применения ЛП при беременности и в период грудного вскармливания. | Установлено, что польза утверждённой PI может иметь негативные последствия, так как рекомендации могут быть чрезмерно консервативными, устаревшими и не отражающими клиническую практику в этой области. |
Lee SH et al. (2014) [23] | Южная Корея | Исследование включало информацию о применении 50 сердечно-сосудистых препаратов, выбранных по коду АТХ (группы C01-C09), продаваемых во всех четырёх странах. Уровень доказательств риска для плода был разделён на пять категорий, а уровень рекомендаций по применению — на четыре категории. Для оценки соответствия каждой категории рассчитывался коэффициент каппа (k) с 95 % ДИ. | Соответствие между Южной Кореей, США, Великобританией и Японией информации о применении при беременности сердечно-сосудистых препаратов. | Что касается уровня доказательств риска для плода, наибольшее количество препаратов в категории «неклассифицированные» было обнаружено в Южной Корее, за которой следуют Япония и Великобритания (58, 54 и 46 % соответственно, p <0,05). Что касается уровня рекомендаций, большинство препаратов во всех четырёх странах были классифицированы как «противопоказанные» или «применять с осторожностью». В Японии имели самую высокую долю уровня «противопоказанные» (62 %), за ней следуют Южная Корея и Великобритания (58 и 44 %, p <0,05). Только в США 10,0 % препаратов были «совместимыми», тогда как в Южной Корее, Великобритании и Японии их не было (p <0,01). Южная Корея и Япония продемонстрировали существенное согласие по уровню доказательств и рекомендаций (k=0,69, 0,67). Информация о применении сердечно-сосудистых препаратов при беременности сильно различалась. Надёжная информация о безопасности при беременности должна предоставляться посредством регулярных обновлений. |
Arguello B et al. (2015) [24] | Португалия | Были извлечены и классифицированы SmPC 582 ЛП, доступных на сайте EMA в апреле 2011 г. Подраздел 4.6 «Фертильность, беременность и лактация» был извлечён из включённых SmPC, и информация о применении препарата при беременности и в период кормления грудью была проанализирована с помощью специально разработанной формы. | Полнота и применимость информации о применении ЛП при беременности и в период кормления грудью, содержащейся в европейских SmPC. | Из 534 SmPC 89,3 % не упомянули, проникает ли препарат через плаценту, 67,6 % заявили об отсутствии клинического опыта при беременности, а 61,4 % не знали, выделяется ли препарат в грудное молоко. Рекомендации по применению ЛП при беременности и кормления грудью были неясны в 57,0 и 16,5 % SmPC, соответственно. Более чем в 90 % SmPC применение препаратов было ограничено как при беременности, так и в период кормления грудью, хотя никакой информации, подтверждающей эти ограничения, представлено не было. Информация об использовании у ЖРВ не была предоставлена в 70,6 % SmPC. Время, прошедшее с момента первого одобрения SmPC, не было связано с повышением качества информации. |
Colaceci S et al. (2015) [25] | Италия | Была проанализирована информация о применении 11 антигипертензивных препаратов в период грудного вскармливания. Источниками официальной информации служили онлайн-базы данных EMA и FDA (SmPC, PL), а также научные источники. | Уровень согласия между различными источниками информации относительно использования ЛП в период грудного вскармливания. | В официальных источниках информации PL и SmPC сообщается о более высоком профиле риска, чем тот, который указан в научных источниках, и часто предлагается прерывание грудного вскармливания даже при приёме совместимых препаратов. |
Tassinari MS et al. (2015) [26] | США | Для обеспечения более точной оценки возможного тератогенного риска препарата в USPI необходимы данные о людях. В связи с этим сбор и анализ данных о безопасности препарата при беременности обычно проводится в пострегистрационном периоде. | Важность в USPI данных, полученных у людей при беременности для препаратов с потенциальным тератогенным риском. | Новое Правило 2015 г. PLLR устанавливает в USPI улучшенные стандарты для включения информации об использовании рецептурных препаратов при беременности. В США Национальное исследование профилактики врождённых дефектов (NBDPS) предоставляет данные о взаимосвязи между употреблением препаратов при беременности и врождёнными дефектами. |
Brown E et al. (2016) [27] | Австралия | В источниках информации о продукте для специалистов (PI) и для потребителей (CMI) был проведён тщательный анализ информации о беременности и грудном вскармливании. Рекомендации в этих официально признанных источниках были сопоставлены с принятыми клиническими информационными ресурсами по ряду препаратов (n=245) из 10 терапевтических групп. | Оценка рекомендаций по приёму ряда ЛП при беременности и в период грудного вскармливания в официальной медицинской документации по сравнению с другими источниками информации. | Противоречивые рекомендации были очевидны как для беременности, так и в отношении грудного вскармливания, с разногласиями в 75,9 % (186/245) и 87,3 % (214/245) препаратов, соответственно. PI оказался самым консервативным ресурсом, при этом 44,5 % рассмотренных рекомендаций по беременности и 69 % рассмотренных рекомендаций по грудному вскармливанию были более консервативными, чем в других ресурсах. |
Barrow P (2018) [28] | Швейцария | Для всех ЛП, одобренных FDA в 2016–2017 гг., из подраздела 8.1 «Беременность» в USPI собрана подробная информация о доклинических данных по эмбрионально-фетальному развитию (ЭФР). | Влияние нового формата PLLR на предоставление в USPI доклинических данных для недавно зарегистрированных ЛП. | Четверть протестированных неонкологических малых молекул и все онкологические малые молекулы были тератогенными, по крайней мере, у одного вида животных. PLLR внёс согласованность в представление данных по ЭФР в USPI. |
Noh Y et al. (2018) [29] | Южная Корея | Исследование маркировки включало препараты (n=81), одобренные в период с 2008 по 2016 гг. и продаваемые в США, Великобритании, Японии и Южной Корее. Уровень доказательств риска для плода был разделён на пять категорий, а уровень | Уровни доказательств риска для плода и рекомендаций по применению в маркировке новых ЛП при беременности в четырёх странах. | Что касается уровня доказательств, категория «неклассифицированный» была самой высокой в Японии (33,3 %), намного ниже в США (2,5 %), Великобритании (6,2 %) и Южной Корее (6,2 %; p <0,01). Что касается уровня рекомендаций, категория «противопоказанный» была самой низкой в США (9,9 %), но высокой в Великобритании (50,6 %), |
Noh Y et al. (2018) [29] | Южная Корея | рекомендаций по применению — на четыре категории. Коэффициент Каппа (k) с 95 % ДИ был рассчитан для оценки соответствия для каждой категории. | Японии (50,6 %) и Южной Корее (42,0 %; p <0,01). Пара Южная Корея — Великобритания продемонстрировали существенное согласие как по доказательствам риска (k=0,80, 95 % ДИ: 0,67–0,94), так и по уровню рекомендаций (k=0,64, 95 % ДИ: 0,46–0,82), тогда как пары Южная Корея — Япония и Южная Корея — США продемонстрировали удовлетворительное или умеренное согласие. | |
Holmes AP et al. (2019) [30] | США | В 10 информационных ресурсах были проанализированы рекомендации по 19 широко используемым препаратам для кормления грудью. Был проведён обзор каждого препарата в каждом ресурсе, и дана оценка опубликованным рекомендациям. | Оценка рекомендаций по грудному вскармливанию для отдельных ЛП в различных источниках информации на основе степени совместимости и безопасности | В справочниках Medications and Mothers' Milk 18th Edition и LactMed было указано наибольшее количество препаратов, совместимых с грудным вскармливанием, за ними следуют Lexicomp Online, Drugs in Pregnancy and Lactation Online и Epocrates. LactMed выделяется из этой группы: в среднем на один препарат приходится 15,1 ссылок, а количество ссылок варьируется от 0 до 58. Между ресурсами сохраняются различия в рекомендациях по безопасности препаратов в период грудного вскармливания. |
Byrne JJ et al. (2020) [31] | США | В поперечном исследовании 290 ЛП, относящихся к 19 терапевтическим категориям и одобренных FDA в период с 2010 по 2019 гг., из USPI была извлечена информация и рассмотрены любые последующие её обновления. Данные были оценены в отношении беременности и грудного вскармливания (у людей и животных), регистров беременности, «предупреждений в рамке» и принятого в 2015 г. формата PLLR, | Определение ЛП, соответствующих формату PLLR, оценка того, сколько новых ЛП имеют данные о применении у людей и животных, специфичные для беременности и грудного вскармливания | Подчёркивание сохраняющейся необходимости включения беременности, грудного вскармливания и репродукции в клинические испытания. «Предупреждения в рамке» имелись для 89 препаратов (30,7 %; 95 % ДИ: 25,4–36,3 %), из которых 3 (3,4 %; 95 % ДИ: 0,7–9,5 %) касались беременности. За 10 лет анализа данных значительно больше было в формате PLLR (p для тренда <0,001). Большинство одобренных ЛП имеют данные при беременности, полученные из исследований на животных (260 продуктов; 89,7 %; 95 % ДИ: 85,6–92,9 %), но только 31 (10,7 %; 95 % ДИ: 7,4–14,8 %) имеют данные, полученные из исследований на людях. Только 148 препаратов (51,0 %; 95 % ДИ: 45,1–56,9 %) имели данные о грудном вскармливании, 143 (49,3 %; 95 % ДИ: 43,4–55,2 %) из исследований на животных и 8 (2,8 %; 95 % ДИ: 1,2–5,4 %) из исследований на людях. |
Namazy J et al. (2020) [32] | США | В январе 2018 г. случайной выборке американских членов Американской академии аллергии, астмы и иммунологии был разослан онлайн-опрос, разработанный FDA в сотрудничестве с Американской академией аллергии, астмы и иммунологии. | Осведомлённость и использование PLLR лицами, назначающими ЛП, а также ценность и понимание формата PLLR на примере подраздела 8.1 «Беременность» USPI. | Из 1500 человек, получивших анкету, 184 (12 %) заполнили её. Средний возраст респондентов составил 56 лет, и в среднем они лечили по 2 беременные женщины в месяц. Менее половины (46 %) респондентов знали, что буквенная система категорий риска при беременности была заменена на описательную. После прочтения примера большинство респондентов (68 %) не сочли описательную часть краткой. Однако 71 % респондентов сочли полезной информацию о фоновом риске и риске, связанном с заболеванием. Большинство респондентов (95 %) продолжают использовать буквенные категории риска при беременности для принятия решений о назначении препаратов. |
Harris JB et al. (2021) [33] | США | В 9 информационных ресурсах по ЛП были проанализированы рекомендации для 23 препаратов при беременности. Определялось количество ссылок на монографию препарата и год публикации последней ссылки. Вторичный анализ включал оценку ссылок и включение рейтингов категории беременности. | Оценка того, предоставляют ли широко используемые информационные ресурсы о ЛП информацию при беременности, аналогичную требованиям PLLR. | LexiComp® Online Pregnancy & Lactation, In-Depth копирует новую структуру PLLR и постоянно имеет наибольшее количество и самые последние ссылки, когда включаются препараты. Drugs in Pregnancy and Lactation был следующим поблизости к PLLR с точки зрения содержания и вторым по количеству ссылок на монографию; однако, самая последняя ссылка была годом публикации учебника. Несколько информационных ресурсов о препаратах включали рейтинги категорий беременности, которые должны быть удалены из маркировки препаратов в соответствии с PLLR. |
Nörby U et al. (2021) [34] | Швеция | Были проанализированы такие препараты, как ибупрофен, ондансетрон, оланзапин, финголимод, метилфенидат и адалимумаб. Рекомендации были отнесены к различным категориям источников данных, для пациентов и для медицинских работников, и сравнены между категориями источников данных для каждого препарата и языка. | Расхождения в информации о применении ЛП при беременности и в период грудного вскармливания между онлайн-ресурсами для пациентов и медицинских работников на четырёх европейских языках. | Для пациентов во всех источниках совпадали 11/24 (46 %) и 4/24 (17 %) рекомендаций при беременности и кормлении грудью, соответственно. Соответствующие показатели источников для медицинских работников составили 13/24 (54 %) и 5/24 (21 %). Нормативные источники, как правило, содержали более ограничительные рекомендации. Рекомендации TIS по применению ЛП при беременности и кормлению грудью совпадали в 25/27 (93 %) и 15/22 (68 %) случаях, соответственно. Необходима дальнейшая работа по гармонизации информации внутри стран и между ними, чтобы избежать противоречивых сообщений. |
Aydın V et al. (2021) [35] | Турция | В описательном исследовании была изучена информация, содержащаяся в действующих SmPC/PIL, относительно применения при беременности и в период грудного вскармливания в общей сложности 118 ЛП с показаниями к тошноте/рвоте, из которых 21 препарат был оригинальным и относился к 12 группам системы АТХ. | Согласованность в SmPC/ PIL информации, относящейся к применению при беременности и в период грудного вскармливания ЛП для лечения тошноты/рвоты. | Во всех SmPC/PIL отсутствовали показания о применении препарата при беременности или соответствующая информация о дозировке. Согласно классификации FDA, категории тератогенного риска препаратов были B (83,1 %), C (15,2 %) и D (1,7 %). Беременность была противопоказана для всех препаратов трописетрона; беременность — в 38,5 %, грудное вскармливание — в 46,2 % препаратов метоклопрамида и грудное вскармливание — в 66,7 % препаратов дименгидрината. Сообщалось, что препарат выводится через молоко и плаценту в 60,2 % и 35,6 % SmPC, соответственно. Присутствие слов «беременность» и «грудное вскармливание» в разделе «меры предосторожности при применении» в PIL показало внутрилекарственные различия для ряда препаратов. За исключением апрепитанта, между SmPC/PIL оригинальных и воспроизведённых препаратов было обнаружено как минимум одно существенное различие. Наиболее часто (15,0 %) существенные различия встречались в разделе PIL, предназначенном грудному вскармливанию. Полученные данные свидетельствуют о том, что при разработке содержания SmPC/PIL необходимы новые подходы как с точки зрения стандартизации, так и полезности в клинической практике. |
Alem G et al. (2022) [36] | США | Было проведено поперечное исследование для оценки знаний и отношения медицинских работников к новому PLLR. Основным результатом этого исследования было знание формата PLLR. Описательный статистический анализ был выполнен для всех переменных исследования, а линейный регрессионный анализ был выполнен для оценки прогностических факторов знания PLLR. | Знание и отношение к формату PLLR среди фармацевтов и врачей. | В поперечном исследовании, в котором приняли участие 167 медицинских работников, большинство из них были фармацевтами (78,4 %). Общий балл знаний был низким, среднее количество правильно отвеченных пунктов составило 3,03 из 7. Из всех изученных предикторов только пол (p <0,01) и балл знаний по буквенной категории риска при беременности (p <0,05) были значимыми предикторами знаний о PLLR с поправкой на другие факторы. |
Robinson A et al. (2022) [37] | США | В рандомизированном исследовании, основанном на опросе, в случайном порядке были розданы две версии анкет. Респондентов просили оценить вероятность назначения препарата. Первая версия содержала клиническую виньетку с указанием на рассматриваемый препарат, подробную информацию о препарате и буквенную категорию риска при беременности (A, B, C или D). Вторая версия содержала идентичную информацию, но без буквенной категории риска при беременности. Была построена смешанная линейная модель с вероятностью назначения препарата в качестве зависимой переменной, обработанной как интервальная шкала. | Оценить, в какой степени исключение из маркировки FDA буквенной категорий риска при беременности ЛП влияет на вероятность того, что врачи будут выписывать эти препараты. | Из 169 розданных анкет было возвращено 162 (96 %). Анализ простых эффектов показал, что наличие буквенной категории риска при беременности существенно влияет на решение о назначении препаратов категории B (p <0,001) и C (p=0,008), но не A или D. Участники значительно реже назначали препараты класса B и C, когда буквенные категории риска не были доступны для просмотра. Эти результаты оставались значимыми даже при контроле ковариаций (p=0,001). |
Примечания: АТХ — Анатомическая, Терапевтическая и Химическая классификационная система; ДИ — доверительный интервал; ЕС — Европейский союз; ЖРВ — женщины репродуктивного возраста; ЛП — лекарственный препарат; США — Соединенные Штаты Америки; ADEC (от Australian Drug Evaluation Committee — Австралийский комитет по оценке лекарственных препаратов); CMI (от Consumer Medicines Information — информация о лекарствах для потребителей); EMA (от European Medicines Agency — Европейское агентство лекарственных препаратов); FASS (от Swedish Catalogue of Approved Drugs — Шведский каталог разрешенных препаратов); FDA (от US Food and Drug Administration — Управления по санитарному надзору за качеством пищевых продуктов и лекарственных препаратов США); PI (от Product Information — информация о продукте); PIL (от Patient Information Leaflet — информационный листок для пациентов); PL (от Patient Leaflet — листок для пациентов); PLLR (от Pregnancy and Lactation Labeling Rule — Правило маркировки рецептурных препаратов при беременности и в период грудного вскармливания); PLR (от Physician Labeling Rule — Правило врачебной маркировки рецептурных препаратов); SmPC (от Summaries of Product Characteristics — краткое описание характеристик продукта); TIS (от Teratology Information Services — информационные службы по тератологии); USPI (от US Prescribing Information — информация о назначении).
Notes: ADEC — Australian Drug Evaluation Committee; CMI–Consumer Medicines Information; EMA — European Medicines Agency; FASS — Swedish Catalogue of Approved Drugs; FDA — The US Food and Drug Administration; PI — Product Information; PIL — Patient Information Leaflet; PL — Patient Leaflet; PLLR — Pregnancy and Lactation Labeling Rule; PLR — Physician Labeling Rule; SmPC — Summaries of Product Characteristics; TIS — Teratology Information Services; USPI — US Prescribing Information; АТХ — Anatomical Therapeutic Chemical Classification System; ДИ — confidence interval; ЖРВ — women of reproductive age; ЕС — EU — European Union; ЛП — drug, medicinal products; США — USA — United States of America.
Характеристики исследований / Research characteristics
Почти половина данных была взята из информационных документов о препарате, размещённых на сайтах национальных регуляторных органов (n=10; 41,7 %) [20][21][23–25][27–29][31][35]. В ряде исследований (n=7; 29,15 %) данные были получены путём опроса медицинских работников, беременных и небеременных женщин с помощью традиционных интервью [15][18][22], анкет [19][37] и онлайн-опросов [32, 36]. Остальные данные были получены из различных электронных источников информации, печатных каталогов и справочников, рекомендаций фармацевтических и медицинских информационных организаций, тератологических информационных центров (n=7; 29,15 %) [14][16][17][26][30][33][34].
Дизайн исследования, включая методологические аспекты, был подробно описан не во всех статьях. Исследования были перекрёстными (n=3; 12,5 %) [20, 24, 31], опросными/анкетными (n=7; 29,15 %) [15][18][19][22][32][36][37], описательными сравнительными (n=11; 45,85 %) [14][17][21][23][25][27][29][30][33–35] или другими (n=3; 12,5 %) [16][26][28].
Использовались различные аналитические подходы, включая: простой описательный анализ (n=14; 58,4 %) [14–16][20–22][25][27][30][32–35][37], описательный анализ с проверкой значимости (n=8; 33,3 %) [17–19][23][24][29][31][36] или другие (n=2; 8,3 %) [26][28].
Следует отметить сложность разграничения аддитивных эффектов, условных связей и множественных причинно-следственных связей между включёнными переменными. Попарно сопоставленные категориальные данные сравнивались с категоризированными рекомендациями из двух источников информации о ЛП, которые могли быть описаны в разных терминах, что позволило провести статистический анализ с использованием теста Макнемара [17] и теста хи-квадрат (χ2) [23][29][31] или, при необходимости, оценки Мантеля-Хензеля [31] для определения тенденции. Соответствие между показателями также оценивалось путём расчёта коэффициента каппа (k) без поправки на распространённость [17][23][29] или с поправкой [24]. Кроме того, для определения нормальности распределения выборки использовался тест Колмогорова-Смирнова, а непараметрические тесты использовались для изучения взаимосвязи между временем, прошедшим с момента последнего обновления информации о ЛП для использования, и двухуровневыми категориальными переменными (тест Манна-Уитни) [24]. Для оценки отношения рисков (ОР) и соответствующих 95 % доверительных интервалов (ДИ) правильной интерпретации предупреждений для ковариат в модели по сравнению с каждым исходным состоянием использовалась обобщённая линейная модель с распределением Пуассона и функцией логарифмической связи [18]. Для изучения влияния личностных особенностей на параметры использовались множественный линейный и логистический регрессионный анализы [19][36]. Однако для изучения различий между парами беременных женщин и их врачей общей практики данные были проанализированы с использованием смешанной линейной модели для оценки тератогенного риска и обобщённых балльных уравнений для уверенности в использовании ЛП и понимания текста [19]. Простой и множественный линейный регрессионный анализ был проведён для определения факторов, предсказывающих знание врачами нового формата раздела о беременности в документе WMI [36]. Описательная статистика была рассчитана для всех переменных исследования, включая средние значения для непрерывных переменных и процентные доли для категориальных переменных.
Риск предвзятости в исследованиях / The risk of bias in research
Важно помнить о возможных видах предвзятости, связанных с каждым источником данных. Например, переоценка расхождений в материале, когда противопоказания в справочной литературе были причиной обращения за советом в центр информации о ЛП, где большинство рекомендаций было классифицировано при участии только одного фармацевта [17]. Следует иметь в виду, что оценки тератогенного риска и уверенности в использовании препарата могут быть основаны на описании гипотетических случаев с условиями или показаниями, которые заменяют клиническую ситуацию [20][23][24]. Опросы женщин репродуктивного возраста и беременных могут быть подвержены ошибкам отбора, что означает, что результаты нельзя обобщать в зависимости от уровня образования или использования самолечения [23][24]. В одном из исследований не изучалась медицинская документация, поэтому не было информации о состоянии здоровья пациенток и, в частности, о том, был ли у них реальный опыт применения препарата [23]. Однако, если возникнет ситуация, когда потребуется медикаментозная терапия при беременности, различия в восприятии риска в паре врач-пациент могут сыграть важную роль в процессе принятия решения [24]. Что касается опроса врачей-специалистов, то, поскольку респонденты практиковали в небольшом географическом районе и невозможно было определить, отличались ли нереспонденты от респондентов, это могло внести погрешность в отбор и ограничить обобщаемость данных [36]. Следует отметить, что по многим из рассмотренных препаратов не было данных о применении при беременности, а между появлением новых данных и их включением в документ WMI часто проходит значительный промежуток времени [20]. Однако это не должно оправдывать тот факт, что данные о безопасности или рекомендации, основанные на данных тех же исследований на животных или отчётов о случаях на людях, зависят от страны, в которой ЛП продаётся [21]. Другой пример: ряд существующих ограничений не позволил получить рекомендации в каждой категории источников данных по каждому препарату, что привело к потенциальной погрешности анализа при сравнении всех источников данных по всем исследуемым препаратам [34]. В то же время различия в документах WMI могут быть вызваны разными специфическими выражениями и фразами, которые составители используют при подготовке контента WMI для одного и того же ЛП [23][29][35].
Результаты отдельных исследований / The results of individual studies
Особого внимания заслуживают комплексные исследования по оценке полноты, применимости и безопасности информации в документах WMI о применении препарата при беременности и в период грудного вскармливания (n=3; 12,5 %), проведённые в США [20][31] и ЕС [24]. Эти исследования выявили недостаток важной информации в документе, особенно отсутствие данных о людях, что может ограничить своевременный доступ к эффективной фармакотерапии для этих групп населения.
Одним из наиболее значимых направлений стали описательные сравнительные исследования частоты и характера расхождений между различными источниками информации (n=10; 41,7 %) [17][21–23][25][27][29][30][34][35]. Существуют межстрановые несоответствия в содержании документов WMI для ЛП, продаваемых одними и теми же фармацевтическими компаниями [21][23][29], а также различия в документированной информации между разными источниками информации [17][22][27][30][34]. Существует несогласованность между различными официально признанными источниками информации как для медицинских работников и пациентов [25], так и для оригинальных и воспроизведённых препаратов [35]. Несоответствие информации о безопасности применения препарата при беременности и в период грудного вскармливания может привести к неоптимальному лечению беременных и кормящих женщин, риску для плода или младенца, а также к непреднамеренному прекращению грудного вскармливания.
На решение назначить или не назначить ЛП при беременности, могут повлиять знания и восприятие тератогенного риска, формулировки и различия в рекомендациях между разными источниками информации, а также доступность информации о препарате для отдельных пациентов и медицинских работников. В ряде исследований (n=5; 20,8 %) были определены современные системы градации риска при беременности, основанные на данных, полученных на людях и животных [14][16]. Также была продемонстрирована эффективность документов WMI в предупреждении о тератогенности ЛП [18] и необходимость адаптации их содержания к уровню восприятия риска и желанию беременной женщины получить эту информацию [15][19]. Однако классификационные системы, разработанные ранее для помощи врачам в интерпретации тератогенного риска, связанного с назначением ЛП, могут вызвать значительную путаницу среди пользователей этих систем из-за различий в распределении категорий риска для одного и того же препарата, что ограничивает их полезность и надежность.
В США информация о назначении ЛП разделена на конкретные подразделы, содержание которых регулируется недавно опубликованным Правилом маркировки при беременности и лактации (Pregnancy and Lactation Labelling Rule; PLLR), которое было предметом особого интереса в нескольких исследованиях (n=6; 25,0 %) [26][28][32][33][36][37]. Поскольку данные о животных предоставляют важные ранние сигналы о потенциальном риске для плода любого пренатального воздействия ЛП, это правило внесло последовательность в представление данных о токсичности для развития эмбриона и плода в USPI [28]. Однако использование этой информации не является строгим подходом к пониманию риска для человека, поэтому для более точной оценки потенциального тератогенного риска необходимы данные о людях, которые чаще всего получают в ходе постмаркетинговых исследований, а не клинических испытаний. В одной из статей отмечается, что в США Национальное исследование по предотвращению врождённых дефектов (NBDPS), наряду с другими крупными исследованиями по наблюдению за беременностью, играет решающую роль в предоставлении необходимой информации о воздействии ЛП на плод и лучшем понимании риска врождённых дефектов [26]. Кроме того, были выявлены пробелы в знаниях медицинских работников о вышеупомянутом новом нормативном акте (PLLR), что указывает на необходимость согласованных усилий по внедрению непрерывного медицинского и фармацевтического образования для улучшения знаний в этой области [32][36][37]. Наконец, при оценке информационных источников, широко используемых в практике, на предмет их сходства с требованиями нового нормативного формата, только два из девяти источников по применению ЛП при беременности предоставляли информацию в формате, наиболее близком к формату, требуемому регулятором [33].
Подробная информация о результатах исследований представлена в таблице 2.
Обсуждение результатов / Discussion of the results
Резюме доказательств и ограничения / Summary of evidence and limitations
В процессе регистрации ЛП национальные органы регулирования устанавливают различные правила формирования первичных источников информации, которые подлежат контролю в рамках существующей в каждой стране системы фармаконадзора [2][3]. Согласно рекомендациям авторитетных регуляторных органов по всему миру, таких как Управление по контролю за пищевыми продуктами и лекарственными препаратами США (FDA) и Европейское агентство по лекарственным препаратам (EMA), стандартная информация о препарате включает данные о рисках и пользе, показаниях к применению, профилях побочных реакций, предупреждениях для здоровья населения, клинической фармакологии, результатах клинических испытаний и консультировании пациентов. Несмотря на важность USPI, 91,2 % из 468 препаратов, одобренных в США в период с 1980 по 2000 год, не содержали достаточной информации о применении при беременности [38]. В исследовании 172 новых препаратов, утверждённых в США в период с 2000 по 2010 год, 126 (73,3 %) препаратов не имели данных о безопасности при беременности, а тератогенный риск при беременности у человека был неопределённым для 168 (97,7 %) новых препаратов. Исследование также показало, что среднее время перехода одобренного препарата из категории неопределённого в категорию определённого риска при беременности составило 27 лет [39]. При этом эффективность источника информации о ЛП, как инструмента управления рисками, оспаривается, поскольку некоторые исследования показали отсутствие его влияния на поведение при назначении препарата или понимание пациентами инструкции по применению [4][12].
Согласно документам WMI, использование у женщин репродуктивного возраста потенциально тератогенных препаратов должно быть максимально безопасным. Во многих случаях их применение неизбежно из-за отсутствия столь же эффективного альтернативного лечения [40]. Важно помнить, что ежегодно в мире беременеют более 200 миллионов женщин [41], и большинство из них принимают хотя бы один препарат во время беременности [42]. Врождённые дефекты встречаются примерно у 1–3 % населения в целом, а основные врождённые аномалии — примерно у 2–4 % всех беременностей, из которых 20–25 % имеют генетическое происхождение, а около 10 % — экзогенную и потенциально предотвратимую причину (например, приём лекарств, материнский диабет, злоупотребление алкоголем) [43][44]. Хотя тератогенное действие ЛП, по оценкам, вызывает около 1 % врождённых пороков развития, многие врачи и пациенты склонны переоценивать их распространённость [43]. Существует большое количество препаратов с неизвестной тератогенностью или фетотоксичностью [38][44], хотя список препаратов, являющихся специфическими тератогенами, невелик и стабилен.
Исследования фармакологической безопасности при беременности на основе данных из документов WMI / Pharmacological safety studies during pregnancy based on data from the WMI documents
В 1990-е и 2000-е гг. широкое распространение получили исследования лекарственной безопасности, ориентированные на официально утверждённую информацию о препаратах из различных источников [45–47]. Хотя утверждённая информация важна для принятия решений о назначении ЛП и является важным источником информации о безопасности, в разных странах, этот документ часто является взаимоисключающим и может содержать недостоверную информацию [5][48][49]. Для беременных несоответствия в официальной информации о ЛП были выявлены в ходе уже ранних европейских исследований [50][51]. Французское исследование показало несоответствия в использовании ЛП при беременности как в рамках одного SmPC, так и между SmPC для воспроизведённых эквивалентов [51]. Другие исследователи обнаружили несоответствия между информацией в листовках-вкладышах для пациентов различных брендов идентичных по составу препаратов при их использовании во время беременности [50].
Лишь в нескольких исследованиях, включённых в наш обзор, непосредственно анализировалось использование ЛП с точки зрения полноты и достоверности информации на момент регистрации и последующих изменений [20][24][31]. Рассмотрены рекомендации по безопасности [14][17][25–28][30][33] и различия между странами в уровне доказательств риска для плода и уровне рекомендаций по применению [21][23][29][34]. Гораздо реже изучалась воспринимаемая клиническая полезность официальной информации для принятия решений [16][22], понимание предупреждения о риске [18], уровень восприятия риска [15][19], согласованность информации для врачей и пациентов [35] или осведомлённость и использование нового формата маркировки врачами [32][36][37]. Формулировка информации о препарате может влиять на восприятие тератогенного риска и, следовательно, на назначение и приверженность [15][19].
Отсутствие доказательств, подтверждающих конкретные рекомендации по применению ЛП при беременности, признано серьёзной проблемой для здоровья женщин. Медицинские работники полагаются на имеющиеся данные о рисках при принятии решений и ежедневно сталкиваются с трудностями при оценке рисков и пользы ЛП [52]. В Европе впервые было проведено исследование, в котором специально сравнивались информационные документы препаратов для лечения синдрома дефицита внимания с гиперактивностью при беременности и в период грудного вскармливания, выпускаемых одними и теми же фармацевтическими компаниями в нескольких странах [21]. Исследование выявило расхождения между странами в данных, полученных на животных и людях, о типах рисков для плода или младенца, находящегося на грудном вскармливании, связанных с материнским воздействием, выделением препарата с грудным молоком и рекомендациями по применению [21]. Модификация данных доклинических, клинических и эпидемиологических исследований в оценку рисков остаётся сложным процессом, как и в случае с рекомендациями по применению ЛП при беременности и в период кормления грудью. Более того, вполне вероятно, что отсутствие последовательной официальной информации о применении ЛП в этих группах населения является одной из основных причин чрезмерной осторожности, основанной на предположениях, а не на доказательствах риска. Поэтому повышение доступности данных в рекомендациях для беременных является необходимым шагом для того, чтобы выбор их пациентами основывался на доказательствах, а не на предположениях [53].
Два исследования, проведённые в США, включали предупреждение о риске тератогенности и подсчитали, что в среднем только 5–10 % имеющихся препаратов имеют адекватный мониторинг, тестирование и информацию о назначении для обеспечения их безопасности при беременности [20][31]. Также чрезвычайно важно, чтобы женщины репродуктивного возраста получали последовательную и научно обоснованную информацию о ЛП для обеспечения здоровья матери, плода и ребёнка, находящегося на грудном вскармливании [24]. Кроме того, исследования [15][19] показывают, что формулировка информации в листовке-вкладыше играет важную роль в увеличении или уменьшении беспокойства по поводу тератогенности. Беременные, как правило, менее уверены в безопасном применении препарата, чем их лечащие врачи. Это подтверждает их высокое восприятие тератогенного риска. Между тем информация о препарате рассматривается медицинскими работниками как очень консервативный ресурс, и доверие к ней может иметь далеко идущие негативные последствия для женщины, плода и младенца, находящегося на грудном вскармливании [22]. Помимо общего отсутствия данных о безопасности большинства ЛП [24][38], при использовании препарата в перинатальном периоде часто встречается неточная информация и несоответствия между онлайн-источниками и информационными брошюрами для пациентов [27][34]. Чтобы принять обоснованное решение, женщинам и медицинским работникам необходимо получить достоверную информацию о безопасности ЛП при беременности и в период грудного вскармливания.
Заключение / Conclusion
Всё более широкое использование ЛП во время беременности во всём мире и ежегодная регистрация новых препаратов, большинство из которых содержат ограниченную информацию о безопасности при беременности или не содержат её вовсе, подтверждают актуальность данного систематического обзора. Ограничением обзора является неоднородный характер литературы, что не позволило провести метаанализ. В обзоре отмечаются существенные пробелы в знаниях о безопасности ЛП при беременности, а также мировая озабоченность их потенциальным тератогенным действием. Адекватность оценки тератогенного риска ЛП оценивается на основе анализа официально признанных источников информации. Повышение доступности данных при беременности — необходимый шаг для выработки научно обоснованных рекомендаций по лечению, чтобы решения основывались на доказательствах, а не на предположениях. Оптимизация материнского здоровья требует приоритета благополучия и автономии матери в принятии решений. Несмотря на то что в литературе существует единое мнение о сложности понимания тератогенного риска из-за научной неопределенности, его реалистичное восприятие необходимо для того, чтобы женщины репродуктивного возраста придерживались оптимизации своей фармакотерапии. Будущие исследования также должны быть направлены на понимание того, как концептуализируется тератогенный риск, и причин тенденции к его преувеличению.
Список литературы
1. Mayall SJ, Banerjee AK. Therapeutic risk management of medicines, 1<sup>st</sup> ed. Woodhead Publishing; 2014. EBook ISBN: 9781908818270.
2. Yuan HT, Raynor DK, Aslani P. Comparison of International Regulations for Written Medicine Information (WMI) on Prescription Medicines. Ther Innov Regul Sci. 2019 Mar;53(2):215-226. doi: 10.1177/2168479018776949.
3. Nualdaisri P, Corlett SA, Krska J. Provision and need for medicine information in Asia and Africa : a scoping review of the literature. Drug Saf. 2021;44(4):421-37. doi: 10.1007/s40264-020-01038-8.
4. Davis TC, Wolf MS, Bass PF 3<sup>rd</sup> , et al. Literacy and misunderstanding prescription drug labels. Ann Intern Med. 2006;145(12):887-94. doi: 10.7326/0003-4819-145-12-200612190-00144.
5. Kesselheim AS, Franklin JM, Avorn J, Duke JD. Speaking the same language? International variations in the safety information accompanying top-selling prescription drugs. BMJ Qual Saf. 2013;22(9):727-34. doi: 10.1136/bmjqs-2012-001704.
6. Eichler HG, Abadie E, Baker M, Rasi G. Fifty years after thalidomide; what role for drug regulators? Br J Clin Pharmacol. 2012;74(5):731-3. doi: 10.1111/j.1365-2125.2012.04255.x.
7. Аляутдин Р.Н., Романов Б.К. Формирование системы профессиональной информации о лекарственных препаратах: quo vadis? Российский медицинский журнал. 2016;22(3):162-165. doi: 10.18821/0869-2106-2016-22-3-162-165.
8. Koren G, Sakaguchi S, Klieger C, et al. Toward improved pregnancy labeling. J Popul Ther Clin Pharmacol. 2010;17(3):e349-e357.
9. Луцевич К.А., Решетько О.В. Фармакологическая безопасность при беременности: современные знания, практика и фармакоэпидемиологические подходы к изучению и признанию лекарственных средств с тератогенным риском. Педиатрическая фармакология. 2019;16(1):19-29. doi: 10.15690/pf.v16i1.2000.
10. Wesley BD, Sewell CA, Chang CY, et al. Prescription medications for use in pregnancy - perspective from the US Food and Drug Administration. Am J Obstet Gynecol. 2021;225(1):21-32. doi: 10.1016/j.ajog.2021.02.032.
11. Wilmer E, Chai S, Kroumpouzos G. Drug safety: pregnancy rating classifications and controversies. Clin Dermatol. 2016;34(3):401-9. doi: 10.1016/j.clindermatol.2016.02.013.
12. Freeman J, Bwire R, Houn F, et al. Teratogenic drugs and risk management: an implementation assessment. Ther Innov Regul Sci. 2014;48(4):420-7. doi: 10.1177/2168479013516776.
13. Liberati A, Altman DG, Tetzlaff J, et al. The PRISMA statement for reporting systematic reviews and meta-analyses of studies that evaluate health care interventions: explanation and elaboration. PLoS Med. 2009;6(7):e1000100. doi: 10.1371/journal.pmed.1000100.
14. Addis A, Sharabi S, Bonati M. Risk classification systems for drug use during pregnancy: are they a reliable source of information? Drug Saf. 2000;23(3):245-53. doi: 10.2165/00002018-200023030-00006.
15. Pole M, Einarson A, Pairaudeau N, Einarson T, Koren G. Drug labeling and risk perceptions of teratogenicity: a survey of pregnant Canadian women and their health professionals. J Clin Pharmacol. 2000;40(6):573-7.
16. Boothby L, Doering P. FDA labeling system for drugs in pregnancy. Ann Pharmacother. 2001;35(11):1485-9. doi: 10.1345/aph.1A034.
17. Frost Widnes SK, Schjott J. Advice on drug safety in pregnancy: are there differences between commonly used sources of information? Drug Saf. 2008;31(9):799-806. doi: 10.2165/00002018-200831090-00008.
18. You WB, Grobman W, Davis T, et al. Improving pregnancy drug warnings to promote patient comprehension. Am J Obstet Gynecol. 2011 Apr;204(4):318.e1-5. doi: 10.1016/j.ajog.2010.12.040.
19. Widnes SF, Schjott J, Eide GE, Granas AG. Teratogenic risk perception and confidence in use of medicines in pairs of pregnant women and general practitioners based on patient information leaflets. Drug Saf. 2013;36(6):481-9. doi: 10.1007/s40264-013-0035-9.
20. Mazer-Amirshahi M, Samiee-Zafarghandy S, Gray G, van den Anker JN. Trends in pregnancy labeling and data quality for US-approved pharmaceuticals. Am J Obstet Gynecol. 2014 Dec;211(6):690.e1-11. doi: 10.1016/j.ajog.2014.06.013.
21. Warrer P, Aagaard L, Hansen EH. Comparison of pregnancy and lactation labeling for attention-deficit hyperactivity disorder drugs marketed in Australia, the USA, Denmark, and the UK. Drug Saf. 2014;37(10):805-13. doi: 10.1007/ s40264-014-0215-2.
22. Brown E, Hotham E, Hotham N. Views of obstetric practitioners and hospital pharmacists on Therapeutic Goods Administration approved product information for pregnancy and lactation. Aust N Z J Obstet Gynaecol. 2014;54(2):184-8. doi: 10.1111/ajo.12197.
23. Lee SH, Shin JY, Park MJ, Park BJ. Agreement of label information of cardiovascular drugs in pregnancy among Korea, the USA, the UK, and Japan. Regul Toxicol Pharmacol. 2014;68(3):363-9. doi: 10.1016/j.yrtph.2014.01.013.
24. Arguello B, Salgado TM, Fernandez-Llimos F. Assessing the information in the summaries of product characteristics for the use of medicines in pregnancy and lactation. Br J Clin Pharmacol. 2015;79(3):537-44. doi: 10.1111/bcp.12515.
25. Colaceci S, Giusti A, Chapin EM, et al. The difficulties in antihypertensive drug prescription during lactation: is the information consistent? Breastfeed Med. 2015;10(10):468-73. doi: 10.1089/bfm.2015.0086.
26. Tassinari MS, Sahin L, Yao LP. Assessing congenital malformation risk from medications used in pregnancy: the contribution of NBDPS in pregnancy labeling of prescription drug products. Birth Defects Res A Clin Mol Teratol. 2015;103(8):718-20. doi: 10.1002/bdra.23403.
27. Brown E, Hotham E, Hotham N. Pregnancy and lactation advice: how does Australian Product Information compare with established information resources? Obstet Med. 2016;9(3):130-4. doi: 10.1177/1753495X16637750.
28. Barrow P. Review of embryo-fetal developmental toxicity studies performed for pharmaceuticals approved by FDA in 2016 and 2017. Reprod Toxicol. 2018;80:117-125. doi: 10.1016/j.reprotox.2018.04.008.
29. Noh Y, Yoon D, Song I, et al. Discrepancies in the evidence and recommendation levels of pregnancy information in prescription drug labeling in the United States, United Kingdom, Japan, and Korea. J Womens Health (Larchmt). 2018;27(9):1086-1092. doi: 10.1089/jwh.2017.6792.
30. Holmes AP, Harris JB, Ware S. Evaluation of lactation compatibility reference recommendations. Ann Pharmacother. 2019;53(9):899-904. doi: 10.1177/1060028019839389.
31. Byrne JJ, Saucedo AM, Spong CY. Evaluation of Drug Labels Following the 2015 Pregnancy and Lactation Labeling Rule. JAMA Netw Open. 2020 Aug 3;3(8):e2015094. doi: 10.1001/jamanetworkopen.2020.15094.
32. Namazy J, Chambers C, Sahin L, et al. Clinicians' perspective of the new Pregnancy and Lactation Labeling Rule (PLLR): results from an AAAAI/FDA survey. J Allergy Clin Immunol Pract. 2020;8(6):1947-52. doi: 10.1016/j.jaip.2020.01.056.
33. Harris JB, Holmes AP, Eiland LS. The Influence of the Food and Drug Administration Pregnancy and Lactation Labeling Rule on Drug Information Resources. Ann Pharmacother. 2021 Apr;55(4):459-465. doi: 10.1177/1060028020956658.
34. Nörby U, Noël-Cuppers B, Hristoskova S, et al. Online information discrepancies regarding safety of medicine use during pregnancy and lactation: an IMI ConcePTION study. Expert Opin Drug Saf. 2021 Sep;20(9):1117-1124. doi: 10.1080/14740338.2021.1935865.
35. Aydın V, Bahar A, Bayram D, et al. Analysis of pregnancy and lactation-related expressions in the summary of product characteristics and patient information leaflets of the drugs used for the treatment of nausea and vomiting. J Acad Res Med. 2021;11(1):107-116. doi: 10.4274/jarem.galenos.2021.35744.
36. Alem G, Awuonda M, Haastrup D, et al. Evaluation of knowledge of the new Pregnancy and Lactation Labeling Rule among pharmacists and physicians. J Am Pharm Assoc (2003). 2022;62(2):427-431. doi: 10.1016/j.japh.2021.10.012.
37. Robinson A, Futterman ID, Atallah F, et al. Removal of pregnancy categories and likelihood of prescribing: a randomized trial. J Perinat Med. 2022 Nov 24;51(4):546-549. doi: 10.1515/jpm-2022-0308.
38. Lo WY, Friedman JM. Teratogenicity of recently introduced medications in human pregnancy. Obstet Gynecol. 2002 Sep;100(3):465-73. doi: 10.1016/s0029-7844(02)02122-1.
39. Adam MP, Polifka JE, Friedman JM. Evolving knowledge of the teratogenicity of medications in human pregnancy. Am J Med Genet C Semin Med Genet. 2011 Aug 15;157C(3):175-82. doi: 10.1002/ajmg.c.30313.
40. Honein MA, Moore CA, Erickson JD. Can we ensure the safe use of known human teratogens? Introduction of generic isotretinoin in the US as an example. Drug Saf. 2004;27(14):1069-80. doi: 10.2165/00002018-200427140-00001.
41. Sedgh G, Singh S, Hussain R. Intended and unintended pregnancies worldwide in 2012 and recent trends. Stud Fam Plann. 2014 Sep;45(3):301-14. doi: 10.1111/j.1728-4465.2014.00393.x.
42. Lupattelli A, Spigset O, Twigg MJ, et al. Medication use in pregnancy: a cross-sectional, multinational web-based study. BMJ Open. 2014 Feb 17;4(2):e004365. doi: 10.1136/bmjopen-2013-004365.
43. Webster WS, Freeman JA. Prescription drugs and pregnancy. Expert Opin Pharmacother. 2003 Jun;4(6):949-61. doi: 10.1517/14656566.4.6.949.
44. Koren G. Fetal risks of maternal pharmacotherapy: identifying signals. Handb Exp Pharmacol. 2011;205:285-94. doi: 10.1007/978-3-642-20195-0_14.
45. Reggi V, Balocco-Mattavelli R, Bonati M, et al; International Comparative Study on Drug Information Collaborative Group. Prescribing information in 26 countries: a comparative study. Eur J Clin Pharmacol. 2003 Aug;59(4):263-70. doi: 10.1007/s00228-003-0607-1.
46. Arguello B, Fernandez-Llimos F. Clinical pharmacology information in summaries of product characteristics and package inserts. Clin Pharmacol Ther. 2007;82(5):566-71. doi: 10.1038/sj.clpt.6100198.
47. Garbe E, Andersohn F. Contraindication labelling changes in the United States and Germany. Eur J Clin Pharmacol. 2007;63(1):87-93. doi: 10.1007/s00228-006-0229-5.
48. Shimazawa R, Ikeda M. Safety information in drug labeling: a comparison of the USA, the UK, and Japan. Pharmacoepidemiol Drug Saf. 2013;22(3):306-18. doi: 10.1002/pds.3408.
49. Pfistermeister B, Saß A, Criegee-Rieck M, et al. Inconsistencies and misleading information in officially approved prescribing information from three major drug markets. Clin Pharmacol Ther. 2014;96(5):616-24. doi: 10.1038/clpt.2014.156.
50. Bjerrum L, Foged A. Patient information leaflets--helpful guidance or a source of confusion? Pharmacoepidemiol Drug Saf. 2003 Jan-Feb;12(1):55-9. doi: 10.1002/pds.795.
51. Fusier I, Tollier C, Husson MC. Infovigilance: reporting errors in official drug information sources. Pharm World Sci. 2005;27(3):166-9. doi: 10.1007/s11096-004-1733-2.
52. Sinclair M, Lagan BM, Dolk H, McCullough JEM. An assessment of pregnant women's knowledge and use of the Internet for medication safety information and purchase. J Adv Nurs. 2018;74(1):137-147. doi: 10.1111/jan.13387.
53. Gray KJ. Providing Data to Empower Pregnant Patients to Make Evidence-Based Choices. JAMA Netw Open. 2021 Apr 1;4(4):e215359. doi: 10.1001/jamanetworkopen.2021.5359.
Об авторах
О. В. РешетькоРоссия
Ольга Вилоровна Решетько, д. м. н., профессор, зав. кафедрой
кафедра фармакологии
Саратов
К. А. Луцевич
Россия
Константин Александрович Луцевич, к. м. н., доцент
Саратов
Т. С. Луцевич
Россия
Татьяна Сергеевна Луцевич, врач-клинический фармаколог
Саратов
Рецензия
Для цитирования:
Решетько О.В., Луцевич К.А., Луцевич Т.С. Исследования безопасности лекарственных препаратов при беременности на основе данных из нормативных источников информации: систематический обзор. Качественная клиническая практика. 2025;(2):46-65. https://doi.org/10.37489/2588-0519-2025-2-46-65. EDN: URCNGY
For citation:
Reshetko O.V., Lutsevich K.A., Lutsevich T.S. Drug safety studies in pregnancy based on data from regulatory information sources: a systematic review. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2025;(2):46-65. (In Russ.) https://doi.org/10.37489/2588-0519-2025-2-46-65. EDN: URCNGY
















































