Перейти к:
Метилирование генов SHOX-2, DAPK1, RAR-beta и Mir-375 при гидротораксе у пациентов с нефротическим синдромом
https://doi.org/10.37489/2588-0519-2024-3-68-72
EDN: ZKDXZM
Аннотация
Нефротический синдром характеризуется клиническими проявлениями, включающими протеинурию, гипоальбуминемию, гиперлипидемию и отёки. Гидроторакс, редкое, но серьёзное осложнение, обусловленное усиленной экссудацией жидкости вследствие гипоальбуминемии и изменений в капиллярной пермеабельности. В данном исследовании оценивалось метилирование генов SHOX-2, DAPK1, RAR-beta и Mir-375 у 35 пациентов с нефротическим синдромом и гидротораксом с экстракцией ДНК из плевральной жидкости и мочи. Метилирование определялось методом ПЦР в режиме реального времени. Результаты ПЦР показали отсутствие метилирования генов SHOX-2, RAR-beta, DAPK1 и Mir-375. Кривые амплификации демонстрировали экспоненциальный рост сигнала и стабильное плато, указывая на успешную амплификацию ДНК. Отсутствие метилирования подтверждало высокую специфичность метода для обнаружения неметилированных последовательностей. Эти результаты подчёркивают необходимость дальнейших исследований для понимания эпигенетических механизмов и разработки новых терапевтических подходов, направленных на модуляцию метилирования ДНК и восстановление нормальной регуляции генов.
Ключевые слова
Для цитирования:
Покровский В.Е., Федосеев А.Н., Смирнов В.В. Метилирование генов SHOX-2, DAPK1, RAR-beta и Mir-375 при гидротораксе у пациентов с нефротическим синдромом. Качественная клиническая практика. 2024;(3):68-72. https://doi.org/10.37489/2588-0519-2024-3-68-72. EDN: ZKDXZM
For citation:
Pokrovskiy V.E., Fedoseev A.N., Smirnov V.V. Methylation of SHOX-2, DAPK1, RAR-beta, and Mir-375 genes in hydrothorax in patients with nephrotic syndrome. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2024;(3):68-72. (In Russ.) https://doi.org/10.37489/2588-0519-2024-3-68-72. EDN: ZKDXZM
Введение / Introduction
Нефротический синдром (далее НС) является комплексом клинических проявлений, характеризующимся протеинурией (потерей белка в моче), гипоальбуминемией (снижением уровня альбумина в крови), гиперлипидемией (высоким уровнем липидов в крови) и отёками. Он может возникать вследствие различных заболеваний почек, таких как болезнь минимальных изменений, фокально-сегментарный гломерулосклероз, мембранопролиферативный гломерулонефрит и другие [1]. Основные механизмы развития НС связаны с повреждением гломерулярного фильтра почек, что приводит к увеличению проницаемости гломерулярной базальной мембраны для белков и возникновению протеинурии. Эти изменения обусловлены различными факторами, включая иммунные механизмы, метаболические нарушения и генетическую предрасположенность [2]. У больных НС отмечаются значительные отёки, чаще всего начинающиеся с лицевой части и распространяющиеся по всему телу. Отёки обусловлены гипоальбуминемией и ретенцией натрия, что приводит к задержке жидкости в тканях [3]. Гидроторакс, характеризующийся накоплением значительного количества жидкости в плевральной полости, является редким, но серьёзным осложнением НС [4]. Основные механизмы развития гидроторакса при НС включают усиленную экссудацию жидкости из капилляров плевры вследствие гипоальбуминемии и изменений в капиллярной пермеабельности. Низкий уровень альбумина в крови снижает онкотическое давление плазмы, что способствует выходу жидкости в плевральную полость. Помимо этого, гиперлипидемия, характерная для нефротического синдрома, может усиливать воспалительные процессы в плевре, способствуя образованию экссудата [5].
Метилирование генов SHOX-2, DAPK1, RAR-beta и Mir-375 играет важную роль в диагностике пациентов с НС при гидротораксе, что подчёркивает значимость эпигенетических изменений в патогенезе данного состояния.
Ген SHOX-2 (short stature homeobox 2) кодирует транскрипционный фактор, участвующий в развитии различных тканей и органов, включая почки. Метилирование промотора этого гена может привести к его пониженной экспрессии, что, в свою очередь, связано с нарушением функций почек и развитием НС. Исследование Zhang Y et al. показало, что гиперметилирование SHOX-2 связано с прогрессированием хронических заболеваний почек и может служить диагностическим маркером для оценки тяжести нефропатий [6].
Ген DAPK1 (death-associated protein kinase 1) участвует в регуляции апоптоза и играет ключевую роль в ответе клеток на стрессовые воздействия. Гиперметилирование DAPK1 ведёт к его инактивации, что способствует снижению апоптотической активности и увеличивает риск развития гидроторакса у пациентов с нефротическим синдромом. В исследовании Kim J et al. было установлено, что метилирование DAPK1 коррелирует с тяжестью клинических проявлений у пациентов с почечными заболеваниями [7].
Ген RAR-beta (retinoic acid receptor beta) участвует в регулировании клеточного роста и дифференцировки под действием ретиноидов. Метилирование промоторной области RAR-beta приводит к снижению его экспрессии, что способствует нарушению клеточных процессов и усугублению НС. Исследование Wang X et al. показало, что гиперметилирование RAR-beta может служить диагностическим маркером для выявления пациентов с высоким риском развития осложнений при нефротическом синдроме [8].
МикроРНК Mir-375 регулирует экспрессию множества генов, участвующих в воспалительных и иммунных реакциях. Метилирование регуляторных областей mir-37 может изменять её уровень и, таким образом, влиять на развитие воспалительных процессов при НС. В исследовании Lee S et al. было продемонстрировано, что метилирование mir-37 связано с повышенной восприимчивостью к воспалительным осложнениям у пациентов с хроническими заболеваниями почек [9].
Таким образом, метилирование генов SHOX-2, DAPK1, RAR-beta и Mir-375 представляет собой перспективное направление для диагностики и прогнозирования течения НС при гидротораксе. Использование эпигенетических маркеров может значительно улучшить точность диагностики и способствовать разработке индивидуализированных терапевтических стратегий для пациентов с данным состоянием.
Цель исследования: оценка уровня метилирования исследуемых генов SHOX-2, DAPK1, RAR-beta и Mir-375 у пациентов с гидротораксом, связанным с нефротическим синдромом, с целью выявления наличия, отсутствия или минимального уровня метилирования.
Материалы и методы / Materials and methods
Проведено проспективное исследование 35 пациентов с нефротическим синдромом при гидротораксе в условиях Федерального научно-клинического центра специализированных видов медицинской помощи и медицинских технологий ФМБА (г. Москва).
Критерии включения: условно здоровые люди в количестве 35 человек, возрастом 35–86 лет, из них мужчин — 21, женщин — 14. Подтверждённый диагноз нефротического синдрома, подтверждённый биопсией почки. Наличие одностороннего или двустороннего гидроторакса, подтверждённого рентгенологически или ультразвуковым исследованием. Отсутствие клинических признаков или лабораторных данных, указывающих на другие этиологии плеврального выпота, такие как туберкулёз, бактериальные инфекции или злокачественные новообразования. Информированное согласие на участие в исследовании.
Критерии невключения: беременность или период грудного вскармливания. Пациенты, получающие иммуносупрессивную терапию, включая высокие дозы кортикостероидов или цитостатиков, в течение последних трёх месяцев. Недавние (в течение последних шести месяцев) хирургические вмешательства на грудной клетке или брюшной полости. Наличие злокачественных новообразований в анамнезе, тяжёлые инфекционные заболевания, включая активный туберкулёз, сердечная недостаточность III–IV функционального класса по NYHA.
Средний возраст пациентов 60,7 ± 17,3 лет, женщин 29 (82,6 % от общего числа), мужчин 6 (17,1 % от общего числа). Длительность заболевания 8,4 ± 5,3 месяца. Оценка степени тяжести проведена при помощи шкалы АРАСН-II и составляет степень II для 24 пациентов (68,6 %) и степень III для 11 пациентов (31,4 %).
Материал исследования: образцы ДНК плевральной жидкости и мочи. Плевральная жидкость была собрана методов плевральной биопсии. Мочу для ДНК получали утренним сбором.
Метод экстракции материала исследования: выделение ДНК осуществлялись с помощью коммерческого набора Qiagen QIAamp DNA Mini Kit (производитель Qiagen GmbH).
Для определения метилирования изучаемых генов SHOX2, RAR-beta, DAPK1, и miR-375 использовался метод ПЦР в режиме реального времени (qPCR) с применением специфических протоколов, направленных на амплификацию участков ДНК, содержащих метилированные или неметилированные сайты. Определяется специфичность метода — насколько точно он идентифицирует присутствие метилирования тех генов, которые действительно метилированы. Высокая специфичность означает, что метод правильно идентифицирует отсутствие метилирования там, где его нет, и минимизирует ложноположительные результаты. Результаты применения метода ПЦР обрабатывались в программе QuantStudio™ Real-Time PCR Software.
Результаты и обсуждение / Results and discussion
Кривые амплификации, полученные в результате полимеразной цепной реакции (ПЦР) в режиме реального времени, отражают динамику амплификации ДНК в зависимости от числа циклов реакции. Результаты нашего исследования ПЦР показали отсутствие метилирования на исследуемых участках генов SHOX-2, RAR-beta, DAPK1 и Mir-375. Это подтверждается экспоненциальным ростом сигнала в начале кривых амплификации, который затем стабилизируется на плато, указывая на успешную амплификацию ДНК. Отсутствие метилирования не оказывает негативного влияния на процесс ПЦР, что подчёркивается отсутствием добавления шума в экспоненциальную фазу амплификации. Каждая кривая амплификации характеризуется чётким экспоненциальным убыванием, отражая ситуацию, когда метилирование отсутствует в рассматриваемых генах (см. рисунок).
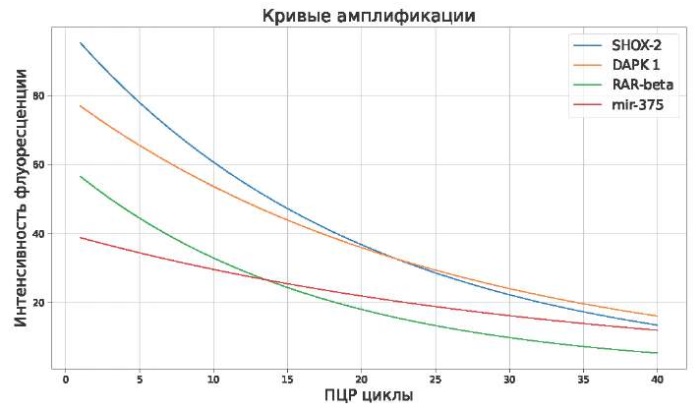
Рис. Кривые амплификации, отражающие результат ПЦР
Fig. Amplification curves reflecting the result of PCR
График показывает изменение интенсивности флуоресценции в зависимости от количества циклов ПЦР для четырёх генов: SHOX-2, DAPK1, RAR-beta и mir-375.
Данный результат свидетельствует о высокой специфичности ПЦР в режиме реального времени для обнаружения неметилированных последовательностей. Метилирование обычно предотвращает связывание праймеров и последующую амплификацию, что приводит к снижению или отсутствию сигнала. В нашем случае отсутствие метилирования позволяет праймерам эффективно связываться с ДНК, обеспечивая надёжную и повторяемую амплификацию. Это также демонстрирует, что выбранные нами праймеры и условия реакции ПЦР оптимально подходят для обнаружения неметилированных генов.
Ранее нами было проведено исследование по дифференциальной диагностике плеврального выпота при скрининге генов SHOX2, RAR-beta, DAPK1, miR-375 у больных с онкологической патологией. Исследование отображено в статье «Дифференциальная диагностика плеврального выпота при молекулярном скрининге генов SHOX2, RAR-beta, DAPK1, miR-375» в № 1 журнала «Медицинский вестник» ГВКГ им. Н. Н. Бурденко. Отмечено, что развитие онкологического процесса, особенно лёгочной системы, сопровождается генетическим полиморфизмом группы исследуемых генов. Согласно полученным данным, можно прогнозировать развитие онкологической патологии с помощью генетического исследования этой группы генов.
Выводы / Conclusions
В контексте нефротического синдрома, особенно при наличии гидроторакса, изучение метилирования генов представляет значительный интерес для понимания патогенеза и потенциальных терапевтических мишеней. В данном исследовании мы обнаружили полное отсутствие метилирования генов SHOX-2, RAR-beta, DAPK1 и Mir-375 у пациентов с нефротическим синдромом при гидротораксе. Полное отсутствие метилирования гена SHOX-2 указывает на активное состояние гена, что может быть защитным механизмом, предотвращающим развитие определённых патологий. У гена RAR-beta предполагает его активную роль в клеточных процессах, возможно, способствующую нормальной дифференцировке и предотвращению неопластических процессов. А у гена DAPK1 может указывать на сохранение его проапоптотической функции, что является важным для удаления повреждённых клеток и предотвращения их накопления. Полное отсутствие метилирования Mir-375 свидетельствует о сохранении его регуляторной функции, что может быть важным для поддержания гомеостаза клеток и тканей у пациентов с нефротическим синдромом. Эти результаты подчёркивают необходимость дальнейших исследований для понимания эпигенетических механизмов в нефротическом синдроме и разработки новых терапевтических подходов, направленных на модуляцию метилирования ДНК и восстановление нормальной регуляции генов.
|
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
ADDITIONAL INFORMATION |
|
|
Конфликт интересов Авторы заявляют об отсутствии конфликта интересов. |
Conflict of interests The authors declare no conflict of interest. |
|
|
Участие авторов Все авторы сделали эквивалентный вклад в подготовку публикации. |
Authors’ participation All authors have made an equivalent contribution to the preparation of the publication. |
|
|
Финансирование Работа выполнена без спонсорской поддержки. |
Funding The work was done without sponsorship. |
Список литературы
1. Lehtonen S, Lewko B. Editorial: Podocyte Pathology and Nephropathy-An Update. Front Endocrinol (Lausanne). 2019;10:528. doi: 10.3389/fendo.2019.00528.
2. Chelladurai P, Seeger W, Pullamsetti SS. Epigenetic mechanisms in pulmonary arterial hypertension: the need for global perspectives. Eur Respir Rev. 2016;25(140):135-40. doi: 10.1183/16000617.0036-2016.
3. Schnuelle P. Renal Biopsy for Diagnosis in Kidney Disease: Indication, Technique, and Safety. J Clin Med. 2023;12(19):6424. doi: 10.3390/jcm12196424.
4. Frățilă VG, Lupușoru G, Sorohan BM, et al. Nephrotic Syndrome: From Pathophysiology to Novel Therapeutic Approaches. Biomedicines. 2024 Mar 3;12(3):569. doi: 10.3390/biomedicines12030569.
5. Gonnelli F, Hassan W, Bonifazi M, et al. Malignant pleural effusion: current understanding and therapeutic approach. Respir Res. 2024;25(1):47. doi: 10.1186/s12931-024-02684-7.
6. Ding H, Zhang L, Yang Q, et al. Epigenetics in kidney diseases. Adv Clin Chem. 2021;104:233-297. doi: 10.1016/bs.acc.2020.09.005.
7. You MH. Mechanism of DAPK1 for Regulating Cancer Stem Cells in Thyroid Cancer. Curr Issues Mol Biol. 2024;46(7):7086-7096. doi: 10.3390/cimb46070422.
8. Luan J, Kopp JB, Zhou H. N6-methyladenine RNA Methylation Epigenetic Modification and Kidney Diseases. Kidney Int Rep. 2022;8(1):36-50. doi: 10.1016/j.ekir.2022.10.009.
9. Ingrosso D, Perna AF. DNA Methylation Dysfunction in Chronic Kidney Disease. Genes (Basel). 2020;11(7):811. doi: 10.3390/genes11070811.
Об авторах
В. Е. ПокровскийРоссия
Покровский Василий Евгеньевич — аспирант кафедры внутренних болезней
Москва
А. Н. Федосеев
Россия
Федосеев Анатолий Николаевич — д. м. н., профессор кафедры внутренних болезней Федерального научно-клинического центра специализированных видов медицинской помощи и медицинских технологий
Москва
В. В. Смирнов
Россия
Смирнов Владимир Вячеславович — д. м. н., профессор, зав. кафедрой внутренних болезней Академия постдипломного образования
Москва
Рецензия
Для цитирования:
Покровский В.Е., Федосеев А.Н., Смирнов В.В. Метилирование генов SHOX-2, DAPK1, RAR-beta и Mir-375 при гидротораксе у пациентов с нефротическим синдромом. Качественная клиническая практика. 2024;(3):68-72. https://doi.org/10.37489/2588-0519-2024-3-68-72. EDN: ZKDXZM
For citation:
Pokrovskiy V.E., Fedoseev A.N., Smirnov V.V. Methylation of SHOX-2, DAPK1, RAR-beta, and Mir-375 genes in hydrothorax in patients with nephrotic syndrome. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2024;(3):68-72. (In Russ.) https://doi.org/10.37489/2588-0519-2024-3-68-72. EDN: ZKDXZM

















































