Перейти к:
Разработка модели дифференциальной диагностики внебольничной бактериальной пневмонии и вирусного поражения лёгких у госпитализированных взрослых пациентов
https://doi.org/10.37489/2588-0519-2023-4-78-85
Аннотация
Актуальность. С развитием пандемии COVID-19 среди возбудителей лёгочных инфекций у взрослых вирусы приобретают большее значение, а значит и разграничение вирусного поражения лёгких и внебольничной бактериальной пневмонии становится всё более актуально. Цель. Разработка модели дифференциации внебольничной бактериальной пневмонии и вирусного поражения лёгких, включая COVID-19. Методы. В ретроспективное исследование случай-контроль включено 300 взрослых пациентов с вирусным поражением лёгких и 100 — с внебольничной бактериальной пневмонией. Проанализированы клинико-лабораторные, инструментальные данные, отобраны значимые факторы, по которым различались выборки, и методом логистической регрессии разработана модель для разграничения внебольничной бактериальной пневмонии и вирусного поражения лёгких, включая COVID-19. Результаты. В разработанную модель вошли следующие параметры: уровень общего белка, индекс нейтрофилы/лимфоциты, ЧСС, наличие одностороннего поражения лёгких по данным КТ или рентгенографии ОГК, назначение вазопрессоров в первые 24 ч госпитализации, снижение уровня сознания, наличие озноба и общей слабости. Модель имела следующие характеристики: AUC = 0,94 (0,92–0,96), AUC_PR = 0,84 (от 0,76 до 0,92), точность прогноза — 90 %, чувствительность — 76 %, специфичность — 95 %, положительная прогностическая ценность — 83 %. Заключение. Использование разработанной модели может облегчить дифференциальную диагностику внебольничной бактериальной пневмонии и вирусного поражения лёгких, включая COVID-19, у взрослых на уровне терапевтических и реанимационных отделений.
Для цитирования:
Купрюшина О.А., Стрелкова Д.А., Яснева А.С., Рачина С.А., Авдеев С.Н., Власенко А.Е., Федина Л.В., Иванова О.В., Каледина И.В., Ананичева Н.А. Разработка модели дифференциальной диагностики внебольничной бактериальной пневмонии и вирусного поражения лёгких у госпитализированных взрослых пациентов. Качественная клиническая практика. 2023;(4):78-85. https://doi.org/10.37489/2588-0519-2023-4-78-85
For citation:
Kupriushina O.A., Strelkova D.A., Yasneva A.S., Rachina S.A., Avdeev S.N., Vlasenko A.E., Fedina L.V., Ivanova O.V., Kaledina I.V., Ananicheva N.A. Development of a model for the differential diagnosis of community-acquired bacterial pneumonia and viral lung injury in hospitalized adult patients. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2023;(4):78-85. (In Russ.) https://doi.org/10.37489/2588-0519-2023-4-78-85
Введение / Introduction
Пандемия COVID-19 привела к росту актуальности вирусного поражения лёгких в популяции взрослых пациентов, сохраняющемуся даже после её завершения. В сложившейся после пандемии ситуации, когда, с одной стороны, с завершением карантинных мер отмечается рост заболеваемости внебольничной бактериальной пневмонией (ВБП), а с другой стороны, сохраняется определённый порог заболеваемости COVID-19 и другими вирусными инфекциями, протекающими с поражением лёгких, важной проблемой является ранняя дифференциальная диагностика данных состояний в связи с разными подходами к оказанию медицинской помощи [1][2].
Цель исследования / Aim: разработать модель дифференциации ВБП и вирусного поражения лёгких, включая COVID-19.
Материалы и методы / Materials and Methods
Проведено ретроспективное исследование случай-контроль, в которое включались взрослые госпитализированные пациенты с ВБП или вирусным поражением лёгких, включая COVID-19 в период с 2014 по 2023 гг. Пациенты были подобраны в соотношении 1:3 (ВБП: вирусное поражение лёгких) на основании возраста, пола, отделения госпитализации (терапевтическое/пульмонологическое или ОРИТ) и индекса коморбидности.
Верификация бактериальных возбудителей проводилась рутинными методами — бактериоскопия и культуральное исследование респираторных образцов из нижних дыхательных путей (мокрота, трахеальный аспират и др.), гемокультура и определения антигенов Streptococcus (S.) pneumoniae и Legionella pneumophila в моче, а также выявления ДНК Mycoplasma pneumoniae и Сhlamydia pneumoniae в респираторных образцах с помощью ПЦР в реальном времени. РНК/ДНК вирусных возбудителей выявлялись методом ПЦР в реальном времени в респираторных образцах из нижних дыхательных путей или при исследовании комбинированного респираторного мазка.
По результатам оценки данных, доступных в медицинских картах пациентов в анализ включены следующие параметры: демографические данные, симптомы заболевания, спектр сопутствующих заболеваний, показатели клинического, биохимического анализов крови, коагулограммы, исследования газов артериальной крови и общего анализа мочи в день поступления, данные инструментального обследования (рентгенография или компьютерная томография ОГК, электрокардиограмма), а также некоторые лечебные мероприятия, проводившиеся в первые 24 ч госпитализации (инвазивная вентиляция лёгких, назначение вазопрессоров и инфузионной терапии).
Описательная статистика количественных признаков представлена медианой и интерквартильным размахом, а также абсолютными числами и долями. Пропущенные данные заменены медианой. В качестве метода моделирования выбрана логистическая регрессия (метод принудительного включения признаков). Качество классификации оценивалось с помощью кросс-валидации на 5 подвыборках — весь исходный набор данных делился на 5 частей, на 4 из них проводилось построение модели, а на 5-ой проводилась проверка, далее процесс повторялся до тех пор, пока проверка не была проведена на всех 5 подвыборках. В качестве оцениваемых метрик качества рассматривались следующие показателя: площадь под ROC кривой (AUC), площадь под PR кривой (англ. precision-recall curve; AUC-PR), точность классификации, чувствительность, специфичность, положительная прогностическая ценность. Расчёты и графические построения производились в python с использованием пакетов sklearn (v.1.4.0), statsmodels (v.0.14.0) и simpleNomo (v.1.0.0).
Результаты / Results
Популяцию исследования составили 400 взрослых пациентов, из них 100 вошли в группу ВБП, а 300 — в группу вирусного поражения лёгких. Из возбудителей в группе ВБП наиболее часто встречались S. pneumoniae, Klebsiella pneumoniae и Staphylococcus aureus, в группе вирусного поражения лёгких подавляющее большинство приходилось на SARS-CoV-2. Медианный возраст пациентов составил 51 (39; 67) год, доля мужчин — 51,5 %, две трети пациентов были госпитализированы в ОРИТ, медиана индекса коморбидности Чарльсона — 2 (0; 4) балла.
Подробное описание выборки исследования и процесс выявления параметров, наиболее характерных для ВБП в сравнении с вирусным поражением лёгких, представлены в предыдущей публикации Стрелковой Д.А. и соавт. [3]. На первом этапе анализа выявлено, что вероятность развития ВБП по сравнению с вирусным поражением лёгких ассоциирована с рядом факторов: снижение общего белка, односторонняя инфильтрация по данным КТ или рентгенографии ОГК, повышенная ЧСС, снижение уровня сознания, повышенный индекс нейтрофилы/лимфоциты, потребность в назначении вазопрессоров в первые 24 ч госпитализации, повышенный уровень мочевины и меньшая встречаемость протеинурии, большая частота озноба и меньшая частота общей слабости. Описательная статистика рассматриваемых факторов приведена в табл. 1.
Таблица 1
Описательная статистика входных переменных для разработки модели
дифференциации ВБП и вирусного поражения лёгких у взрослых
Показатели | Всего | Вирусное поражение легких | Внебольничная бактериальная пневмония | |||
N* | Значение | N* | Значение | N* | Значение | |
Общий белок в крови | 351 | 68 (61,3; 73,5) | 272 | 69,8 (63,7; 74,5) | 79 | 63,0 (56,5; 68,0) |
Инфильтрация односторонняя | 400 | 16 % (n=62) | 300 | 4 % (n=13) | 100 | 49 % (n=49) |
ЧСС | 399 | 89 (80; 100) | 300 | 87,0 (80,0; 98,0) | 99 | 100,0 (85,0; 115,0) |
Снижение уровня сознания | 400 | 9 % (n=37) | 300 | 5 % (n=15) | 100 | 22 % (n=22) |
Индекс нейтрофилы/ лимфоциты | 346 | 4,2 (2,5-9,2) | 277 | 3,9 (2,4; 7,7) | 69 | 6,6 (3,5;14,8) |
Вазопрессоры в первые 24 ч госпитализации | 400 | 4 % (n=17) | 300 | 1% (n=4) | 100 | 13 % (n=13) |
Озноб | 400 | 11 % (n=44) | 300 | 2 % (n=6) | 100 | 38 % (n=38) |
Общая слабость | 400 | 52 % (n=207) | 300 | 65 % (n=194) | 100 | 13 % (n=13) |
Примечание: N* — число пациентов, у которых определялся показатель
Note: N* — the number of patients for whom the indicator was determined
В качестве метода моделирования была выбрана логистическая регрессия (метод принудительного включения признаков), уравнение которой имеет вид, представленный ниже:
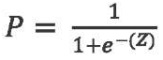
P — вероятность того, что пневмония имеет бактериальную этиологию;
Z — регрессионный коэффициент, отражающий степень влияния всех входных факторов.
Далее с использованием упомянутых выше факторов был рассчитан регрессионный коэффициент:
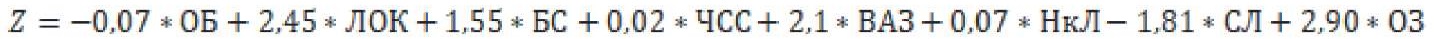
Z — коэффициент уравнения логистической регрессии, рассчитанный на выборке с замещением пропусков медианами;
ОБ — концентрация общего белка в крови;
ЛОК — локализация (1 — односторонняя инфильтрация, 0 — двусторонняя инфильтрация);
БС — снижение уровня сознания (1 — да, 0 — нет);
ЧСС — частота сердечных сокращений;
ВАЗ — приём вазопрессоров в первые сутки госпитализации (1 — да, 0 — нет);
СЛ — слабость (1 — есть, 0 — нет);
ОЗ — озноб (1 — есть, 0 — нет).
При этом модель имела следующие характеристики качества суммарно по 5 исследуемым выборкам: AUC = 0,94 (0,92–0,96), AUC_PR = 0,84 (от 0,76 до 0,92), точность прогноза — 90 %, чувствительность — 76 %, специфичность — 95 %, положительная прогностическая ценность — 83 %.
Для использования созданной модели разработана номограмма (см. рисунок). На номограмме каждому фактору риска соответствует свой балл, который определяется по шкале «Баллы»: от указанного фактора откладывается перпендикуляр вверх, до пересечения со шкалой «Баллы», точка пересечения — балл, соответствующий данному фактору риска. Найденные баллы по всем факторам суммируются. Вероятность наличия ВБП (в долях от 1), соответствующая полученной сумме баллов, определяется следующим образом: на шкале «Сумма баллов» находится точка, соответствующая полученной сумме баллов, вниз от неё откладывается перпендикуляр до пересечения с осью «Риск», данная точка пересечения и есть прогнозируемая вероятность.
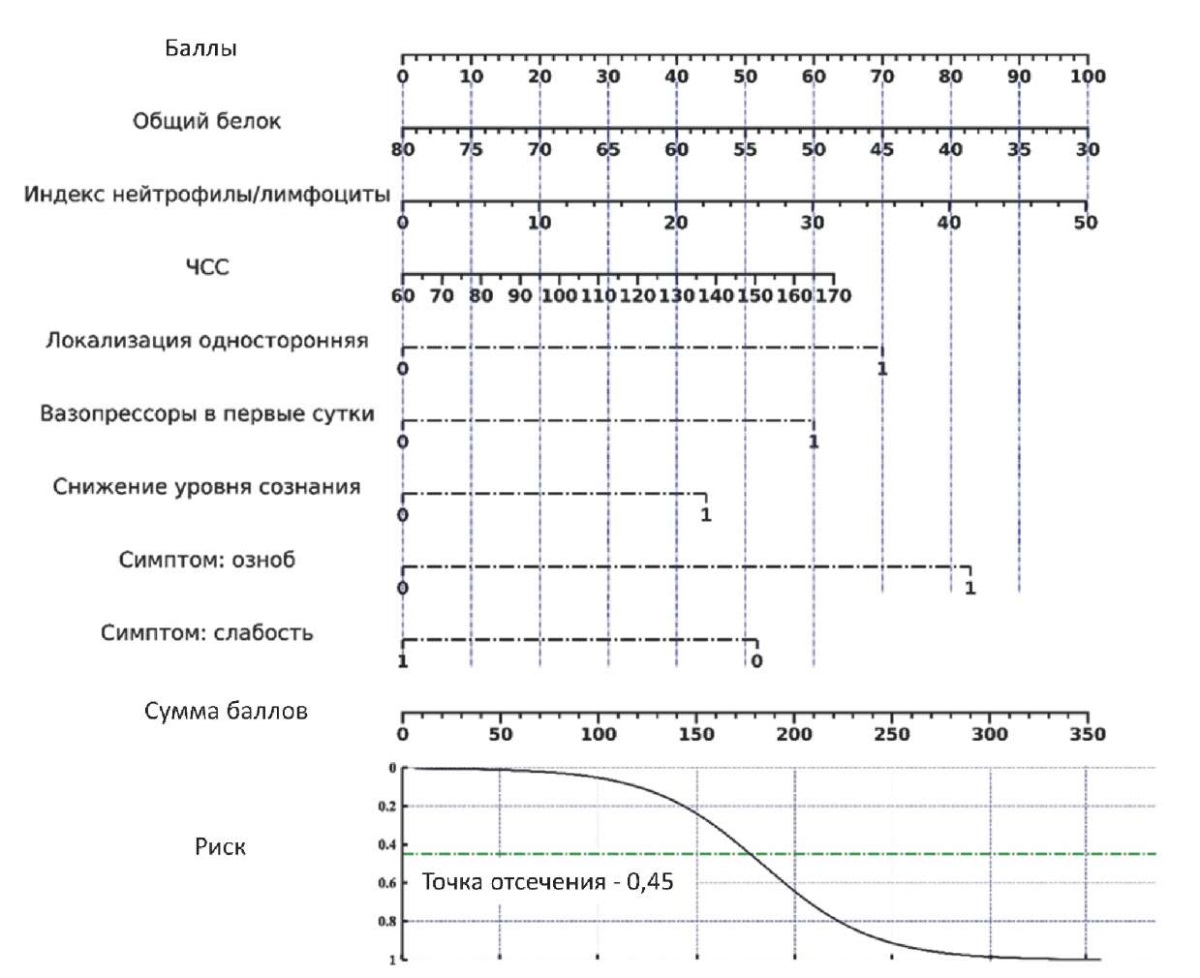
Рис. Номограмма вероятности наличия у пациента с внебольничной пневмонией vs вирусное поражение лёгких
Fig. Nomogram of the probability of presence in a patient with community-acquired pneumonia vs viral lung damage
Пример использования номограммы: предположим, что общий белок у пациента составил 65 г/л (30 баллов), индекс нейтрофилы/лимфоциты — 10 (20 баллов), ЧСС — 130 ударов в минуту (40 баллов), инфильтрация односторонней локализации (70 баллов), вазопрессоров пациент не получал (0 баллов), снижения уровня сознания не наблюдалось (0 баллов), он отмечает озноб (82 балла) и отсутствие общей слабости (52 балла). Суммарно пациент набирает 294 балла, что превосходит точку отсечения и соответствует высокой вероятности ВБП.
Обсуждение / Discussion
Проблема разграничения ВБП и вирусного поражения лёгких стала более интенсивно изучаться во взрослой популяции с началом пандемии COVID-19. Наибольшее число немногочисленных более ранних работ было посвящено использованию одного из признанных маркеров тяжёлой бактериальной инфекции и сепсиса — прокальцитонина. Так, в метаанализе Kamat IS, et al. чувствительность и специфичность данного маркера для дифференциальной диагностики ВБП и вирусного поражения лёгких составили 55 и 76 %, соответственно [4]. Ono A, et al. проведено исследование по сравнению КТ «находок» у пациентов с гриппом и пневмококковой пневмонией: в первом случае чаще выявлялись «матовое стекло» и «булыжная мостовая», а во втором чаще встречались консолидации, закупорка бронхов слизью, центри-лобулярные узелки и плевральный выпот [5].
В нашей работе ключевыми клиническими признаками, отличающими ВБП от вирусного поражения лёгких были наличие озноба и снижения уровня сознания, а также отсутствие общей слабости. Эти симптомы выявлялись и по данным других исследований [6][7]. Помимо этого, для бактериальной пневмонии были характерны наличие мокроты и боли в грудной клетке [6–9]. Односторонний характер инфильтрации, как признак ВБП, также описан другими исследователями [6][10][11].
Среди лабораторных параметров, использование которых может помочь разграничить ВБП и вирусное поражение лёгких, включая COVID-19, в разработанную модель вошли общий белок и соотношение нейтрофилы/лимфоциты. Роль лейкоцитов, нейтрофилов и лимфоцитов и возможность их использования в дифференциальной диагностике бактериальной пневмонии и вирусного поражения лёгких описывали многие исследователи [6][8][12][13].
Wang J, et al. также отмечают склонность к более низкому общему белку у пациентов с ВБП по сравнению с COVID-19; в разработанную данной группой авторов модель дифференциальной диагностики вошли эозинофилы, общий белок, преальбумин, калий, липопротеиды высокой плотности и липопротеиды низкой плотности [14]. На сколько нам известно, это единственная описанная в литературе модель дифференциальной диагностики ВБП и вирусного поражения лёгких во взрослой популяции. При этом в неё включались только лабораторные показатели, ряд из которых не выполняется рутинно при обследовании пациента с подозрением на пневмонию.
Исследование дифференциальной диагностики ВБП и вирусного поражения лёгких, включая COVID-19, особенно актуально в связи с отмечавшимся избыточным назначением антибиотиков (АБ) в ходе пандемии COVID-19. В наибольшей степени эта проблема выявлялась в течение первого года пандемии, когда, по данным метаанализа, частота использования данного класса лекарственных средств у госпитализированных больных составила 74,6 % [15]. В более позднем метаанализе исследователи отмечают сокращение частоты назначения АБ при COVID-19 в странах с высоким уровнем дохода на душу населения [16].
Данные о значимом росте антибиотикорезистентности после пандемии COVID-19 пока остаются немногочисленными и противоречивыми ввиду недавнего её завершения. Так, в работе Langford BJ, et al было показано нестатистически значимое увеличение частоты выявления резистентных грамотрицательных бактерий, в том числе энтеробактерий, продуцирующих β-лактамазы расширенного спектра действия, изолятов энтеробактерий, Pseudomonas aeruginosa и Acinetobacter baumannii, устойчивых к карбапенемам [17]. Отдельные исследователи указывают на рост числа инфекций, вызванных Clostridioides difficile при COVID-19 по сравнению с допандемическим периодом [18].
Ограничения исследования / Study limitation
К ограничениям исследования можно отнести его ретроспективный характер и отсутствие отдельной выборки для валидации результатов, наличие небольшого количества пропусков в базе данных, которые для расчётов были заменены медианой, а также превалирование в группе вирусного поражения COVID-19, что может влиять на характеристики модели при высокой доле вирусного поражения лёгких другой этиологии, например гриппа.
Заключение / Conclusion
В разработанную модель дифференциальной диагностики ВБП и вирусного поражения лёгких у взрослых вошли параметры, доступные в рутинной практике большинства лечебных учреждений Российской Федерации: уровень общего белка, индекс нейтрофилы/лимфоциты, ЧСС, одностороннее поражение по данным визуализирующих исследований, назначение вазопрессоров в первые 24 ч госпитализации, снижение уровня сознания, наличие озноба и слабости. Использование разработанной модели возможно на уровне терапевтических и реанимационных отделений стационаров России до этиологической диагностики инфекционного поражения лёгких и может быть полезно как для маршрутизации больных, так и с целью принятия решения о назначении антибактериальных препаратов.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Конфликт интересов. Авторы декларируют отсутствие конфликта интересов.
Участие авторов. Купрюшина О. А. — разработка концепции исследования, создание базы данных, заполнение базы данных, написание текста, редактирование, финальное утверждение рукописи; Стрелкова Д. А. — разработка концепции исследования, создание базы данных, заполнение базы данных, написание текста, редактирование, финальное утверждение рукописи; Яснева А. С. — заполнение базы данных, написание текста, финальное утверждение рукописи; Рачина С. А. — разработка концепции исследования, создание базы данных, написание текста, редактирование, финальное утверждение рукописи; Авдеев С. Н. — разработка концепции исследования, редактирование, финальное утверждение рукописи; Власенко А. Е. — разработка концепции исследования, создание базы данных, статистический анализ, финальное утверждение рукописи; Федина Л. В., Иванова О. В., Каледина И. В., Ананичева Н. А. — заполнение базы данных, финальное утверждение рукописи.
Финансирование. Исследование поддержано грантом Российского научного фонда № 23-25-00422.
ADDITIONAL INFORMATION
Conflict of interests. The authors declare no conflict of interest.
Participation of authors. Kupriushina OA — concept development, creation of a database, filling out the database, writing the text, editing, final approval of the manuscript; Strelkova DA — concept development, creation of a database, filling out the database, writing the text, editing, final approval of the manuscript; Yasneva AS — filling out the database, writing the text, final approval of the manuscript; Rachina SA — concept development, creation of a database, writing the text, editing, final approval of the manuscript; Avdeev SN — concept development, editing, final approval of the manuscript; Vlasenko AE — concept development, creation of a database, statistical analysis, final approval of the manuscript; Fedina LV, Ivanova OV, Kaledina IV, Ananicheva NA — filling out the database, final approval of the manuscript.
Financing. The study was supported by the grant № 23-25-00422 of Russian Science Foundation.
Список литературы
1. Ankert J, Hagel S, Schwarz C, et al. Streptococcus pneumoniae re-emerges as a cause of community-acquired pneumonia, including frequent co-infection with SARS-CoV-2, in Germany, 2021. ERJ Open Res. 2023 May 30;9(3):00703-2022. doi: 10.1183/23120541.00703-2022.
2. Yan Y, Tomooka K, Naito T, Tanigawa T. Decreased number of inpatients with community-acquired pneumonia during the COVID-19 pandemic: A large multicenter study in Japan. J Infect Chemother. 2022;28(5):709-713. doi: 10.1016/j.jiac.2022.01.013.
3. Стрелкова Д.А., Купрюшина О.А., Яснева А.С. и др. Дифференциальная диагностика внебольничной бактериальной пневмонии и вирусного поражения легких у взрослых в стационаре. Клиническая микробиология и антимикробная химиотерапия. 2023 (принято к публикации).
4. Kamat IS, Ramachandran V, Eswaran H, et al. Procalcitonin to Distinguish Viral From Bacterial Pneumonia: A Systematic Review and Meta-analysis. Clin Infect Dis. 2020 Jan 16;70(3):538-542. doi: 10.1093/cid/ciz545.
5. Ono A, Okada F, Takata S, et al. A comparative study of thin-section CT findings between seasonal influenza virus pneumonia and Streptococcus pneumoniae pneumonia. Br J Radiol. 2014 Jul;87(1039):20140051. doi: 10.1259/bjr.20140051.
6. Tian J, Xu Q, Liu S, et al. Comparison of clinical characteristics between coronavirus disease 2019 pneumonia and community-acquired pneumonia. Curr Med Res Opin. 2020 Nov;36(11):1747-1752. doi: 10.1080/03007995.2020.1830050.
7. Serrano Fernandez L, Ruiz Iturriaga LA, Espana Yandiola PP, et al. Bacteraemic pneumococcal pneumonia and SARS-CoV-2 pneumonia: differences and similarities. Int J Infect Dis. 2022 Feb;115:39-47. doi: 10.1016/j.ijid.2021.11.023.
8. Zhou Y, Guo S, He Y, et al. COVID-19 Is Distinct From SARS-CoV-2-Negative Community-Acquired Pneumonia. Front Cell Infect Microbiol. 2020 Jun 16;10:322. doi: 10.3389/fcimb.2020.00322.
9. Miyashita N, Nakamori Y, Ogata M, et al. Clinical Differences between Community-Acquired Mycoplasma pneumoniae Pneumonia and COVID-19 Pneumonia. J Clin Med. 2022 Feb 12;11(4):964. doi: 10.3390/jcm11040964.
10. Liu KC, Xu P, Lv WF, et al. Differential diagnosis of coronavirus disease 2019 from community-acquired-pneumonia by computed tomography scan and follow-up. Infect Dis Poverty. 2020 Aug 26;9(1):118. doi: 10.1186/s40249-020-00737-9.
11. Zhou J, Liao X, Cao J, et al. Differential diagnosis between the coronavirus disease 2019 and Streptococcus pneumoniae pneumonia by thinslice CT features. Clin Imaging. 2021 Jan;69:318-323. doi: 10.1016/j.clinimag.2020.09.012.
12. Mason CY, Kanitkar T, Richardson CJ, et al. Exclusion of bacterial co-infection in COVID-19 using baseline inflammatory markers and their response to antibiotics. J Antimicrob Chemother. 2021 Apr 13;76(5):1323-1331. doi: 10.1093/jac/dkaa563.
13. Song L, Liang EY, Wang HM, et al. Differential diagnosis and prospective grading of COVID-19 at the early stage with simple hematological and biochemical variables. Diagn Microbiol Infect Dis. 2021 Feb;99(2):115169. doi: 10.1016/j.diagmicrobio.2020.115169.
14. Wang J, Zheng Y, Chen Y, et al. Laboratory indicators in COVID-19 and other pneumonias: Analysis for differential diagnosis and comparison of dynamic changes during 400-day follow-up. Comput Struct Biotechnol J. 2021;19:2497-2507. doi: 10.1016/j.csbj.2021.04.063.
15. Langford BJ, So M, Raybardhan S, et al. Antibiotic prescribing in patients with COVID-19: rapid review and meta-analysis. Clin Microbiol Infect. 2021 Apr;27(4):520-531. doi: 10.1016/j.cmi.2020.12.018.
16. Khan S, Hasan SS, Bond SE, et al. Antimicrobial consumption in patients with COVID-19: a systematic review and meta-analysis. Expert Rev Anti Infect Ther. 2022 May;20(5):749-772. doi: 10.1080/14787210.2022.2011719.
17. Langford BJ, Soucy JR, Leung V, et al. Antibiotic resistance associated with the COVID-19 pandemic: a systematic review and meta-analysis. Clin Microbiol Infect. 2023 Mar;29(3):302-309. doi: 10.1016/j.cmi.2022.12.006.
18. Lewandowski K, Rosołowski M, Kaniewska M, et al. Clostridioides difficile infection in coronavirus disease 2019 (COVID-19): an underestimated problem? Pol Arch Intern Med. 2021 Feb 26;131(2):121-127. doi: 10.20452/pamw.15715.
Об авторах
О. А. КупрюшинаРоссия
Купрюшина Ольга Александровна, Старший лаборант кафедры госпитальной терапии № 2 Института клинической медицины им. Н.В. Склифосовского
Москва
Д. А. Стрелкова
Россия
Стрелкова Дарья Александровна, Ассистент кафедры госпитальной терапии №2 Института клинической медицины им. Н.В. Склифосовского
Москва
А. С. Яснева
Россия
Яснева Анастасия Станиславовна, Студент
Москва
С. А. Рачина
Россия
Рачина Светлана Александровна, д. м. н., профессор РАН, зав. кафедрой госпитальной терапии №2 Института клинической медицины им. Н.В. Склифосовского
Москва
С. Н. Авдеев
Россия
Авдеев Сергей Николаевич, д. м. н., академик РАН, зав. кафедрой пульмонологии Института клинической медицины им. Н.В. Склифосовского
Москва
А. Е. Власенко
Россия
Власенко Анна Егоровна, к. т. н., ведущий специалист центра доказательной медицины и биостатистики
Самара
Л. В. Федина
Россия
Федина Людмила Владимировна, Клинический фармаколог отделения клинической фармакологии; аспирант кафедры клинической фармакологии и терапии
Москва
О. В. Иванова
Россия
Иванова Ольга Владимировна, Врач пульмонологического отделения
Смоленск
И. В. Каледина
Россия
Каледина Инна Викторовна, Заведующий центром анестезиологии и реаниматологии
Москва
Н. А. Ананичева
Россия
Ананичева Наталия Александровна, Руководитель Регионального сосудистого центра
Москва
Рецензия
Для цитирования:
Купрюшина О.А., Стрелкова Д.А., Яснева А.С., Рачина С.А., Авдеев С.Н., Власенко А.Е., Федина Л.В., Иванова О.В., Каледина И.В., Ананичева Н.А. Разработка модели дифференциальной диагностики внебольничной бактериальной пневмонии и вирусного поражения лёгких у госпитализированных взрослых пациентов. Качественная клиническая практика. 2023;(4):78-85. https://doi.org/10.37489/2588-0519-2023-4-78-85
For citation:
Kupriushina O.A., Strelkova D.A., Yasneva A.S., Rachina S.A., Avdeev S.N., Vlasenko A.E., Fedina L.V., Ivanova O.V., Kaledina I.V., Ananicheva N.A. Development of a model for the differential diagnosis of community-acquired bacterial pneumonia and viral lung injury in hospitalized adult patients. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2023;(4):78-85. (In Russ.) https://doi.org/10.37489/2588-0519-2023-4-78-85

















































