Перейти к:
Анализ структуры и показателей антибиотикорезистентности возбудителей инфекций у пациентов в отделениях интенсивной терапии многопрофильного стационара
https://doi.org/10.37489/2588-0519-2023-4-4-14
Аннотация
Актуальность. Нозокомиальные инфекции являются распространённым осложнением, возникающим у пациентов, проходящих лечение в условиях отделения реанимации и интенсивной терапии (ОРИТ). Микроорганизмы, характеризующимися множественной лекарственной устойчивостью, являются одним из значимых факторов риска летального исхода у данной категории больных. Цель. Изучение структуры возбудителей инфекций у пациентов в ОРИТ и параметров их антибиотикорезистентности. Материалы и методы. Ретроспективное фармакоэпидемиологическое исследование медицинской документации взрослых пациентов с диагностированной в ОРИТ инфекцией, проходивших лечение в ГКБ № 24 ДЗМ в период 20.08.2022 — 31.07.2023 (199 историй болезни, ИБ). В анализ (пол, возраст пациентов, локализация инфекционного процесса, данные о структуре возбудителей и чувствительности к антибактериальным препаратам) включали ИБ с данными о бактериальном посеве (n=141). Результаты. В структуре возбудителей инфекций у пациентов в ОРИТ преобладает грамотрицательная микрофлора (54 %). Среди возбудителей с клинически значимым ростом основными являлись K. pneumoniae (22 %), Candida spp. (20 %) и Staphylococcus spp. (19 %). K. pneumoniae характеризовалась резистентностью к бета-лактамам, аминогликозидам, левофлоксацину, наибольшая чувствительность отмечалась к колистину, 88,9 %. Кандиды были в абсолютном большинстве чувствительными ко всем использованным препаратам. Среди стафилококков чаще всего встречался S. aureus (70 % резистентность к ампициллину и цефокситину). Заключение. В структуре возбудителей инфекций у пациентов в ОРИТ было выявлено доминирование таких представителей ESKAPE (наиболее прогностически важных микроорганизмов: Enterococcus faecium, Staphylococcus aureus , Klebsiella pneumoniae , Acinetobacter baumannii , Pseudomonas aeruginosa , Enterobacter spp.), как K. pneumoniae , S. aureus , A. baumannii, P. aeruginosa. Для всех указанных микроорганизмов за исключением стафилококков был продемонстрирован высокий уровень антибиотикорезистентности.
Ключевые слова
Для цитирования:
Бутранова О.И., Зырянов С.К., Горбачева А.А., Пуцман Г.А. Анализ структуры и показателей антибиотикорезистентности возбудителей инфекций у пациентов в отделениях интенсивной терапии многопрофильного стационара. Качественная клиническая практика. 2023;(4):4-14. https://doi.org/10.37489/2588-0519-2023-4-4-14
For citation:
Butranova O.I., Zyryanov S.K., Gorbacheva A.A., Putsman G.A. Analysis of the infectious agent’s structure and antibiotic resistance parameters in patients in intensive care units of a multidisciplinary hospital. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2023;(4):4-14. (In Russ.) https://doi.org/10.37489/2588-0519-2023-4-4-14
Введение / Introduction
Пациенты, находящиеся в ОРИТ, характеризуются высоким риском развития инфекций нижних отделов дыхательных путей (ИНДП), мочевыводящих путей (ИМВП) и катетер-ассоциированных инфекций (КАИ), что связано с широким использованием инвазивных процедур у данного контингента больных. Распространённость инфекций в ОРИТ в РФ по данным исследования ЭРГИНИ 2013 составила 26,28 % [1]. Уже через двое суток пребывания в ОРИТ (отчёт Европейского центра профилактики и контроля заболеваний за 2018 год) минимум одна внутрибольничная инфекция выявляется у 7,4 % пациентов [2]. Результаты клинических исследований, посвящённых изучению инфекций в ОРИТ, свидетельствуют о высокой актуальности данной проблемы для мирового здравоохранения. Доля пациентов с подтверждёнными инфекциями в ОРИТ может составлять от 27,9 % (анализ практики одного госпиталя в Северной Индии) [3] до 56 % (данные 1150 клинических центров 88 стран, исследование EPIC III) [4]. По данным Vincent JL et al. (2020 г.) наибольшая распространённость инфекций в ОРИТ характерна для стран азиатского региона и Ближнего Востока — 60 % [4]. Общая частота инфекций в ОРИТ согласно данным национального ретроспективного исследования в Иране составила 96,61 на 1000 пациентов или 16,82 на 1000 пациенто-дней [5].
Инфекции значительно увеличивают длительность госпитализации в целом и пребывания в ОРИТ в частности, потребность в дополнительных инвазивных процедурах и большем объёме фармакотерапии. По данным регистра респираторной терапии у пациентов с острыми нарушениями мозгового кровообращения (RETAS) инфекционные осложнения при искусственной вентиляции лёгких (ИВЛ) ассоциировались со статистически значимым увеличением длительности ИВЛ и длительности пребывания в ОРИТ и более высокой летальностью (p<0,001) [6]. По данным E Silva LGA et al. (2023 г.) отношение шансов (ОШ) летального исхода при наличии инфекции составило для пациентов в ОРИТ 4,305 (95 % доверительный интервал, ДИ: 3,195–5,912, р<0,001) [7]. Анализ 210 исследований (с 1985 по 2021 год) обнаружил тенденцию роста среднего показателя смертности среди пациентов ОРИТ, находившихся на ИВЛ, при этом данные большинства исследований демонстрировали значение летальности, находящееся в пределах от 15 до 30 % [8].
Значимый вклад в рост показателей смертности вносит рост удельной доли резистентных микроорганизмов в структуре возбудителей инфекций в ОРИТ [3].
Изучение микробного профиля пациентов в ОРИТ и показателей антибиотикорезистентности возбудителей является актуальной задачей, направленной на оптимизацию фармакотерапии данного контингента пациентов и улучшение исходов.
Цель исследования / The purpose of research: изучение структуры возбудителей инфекций у пациентов в ОРИТ и параметров их антибиотикорезистентности.
Материалы и методы / Materials and methods
Дизайн — ретроспективное фармакоэпидемиологическое исследование медицинской документации взрослых пациентов с диагностированной в ОРИТ инфекцией, проходивших лечение в ГКБ № 24 ДЗМ в период 20.08.2022–31.07.2023. Критерии включения: наличие диагноза, подтверждающего инфекционное заболевание, установленного во время пребывания пациента в ОРИТ. Критерии невключения: установление диагноза инфекционного заболевания до момента госпитализации в ОРИТ. Методом случайных чисел было выбрано 199 историй болезни (ИБ), среди которых в анализ были включены те, где присутствовали данные о бактериальном посеве (n=141). Анализировали характеристики пациентов (пол, возраст, локализация инфекционного процесса), а также данные о структуре возбудителей и чувствительности к антибактериальным препаратам (АБП), присутствовавшие в медицинской документации. Исходная идентификация микроорганизмов в лаборатории осуществлялась метолом MALDI-TOF масс-спектрометрии (матрично-активированная лазерная десорбция/ионизация). Чувствительность к АБП определялась автоматизированным диско-диффузионным методом. Клинически значимый рост микроорганизмов устанавливался в следующих случаях:
- >10⁵КОЕ/мл для образцов мокроты;
- >10⁵КОЕ/мл для образцов мочи;
- >10⁵КОЕ/мл для образцов смывов с поверхности кожи и ран;
- >10⁴КОЕ/мл для образцов аспирата из бронхов, бронхоальвеолярного лаважа;
Любое значения для образцов крови и смывов с внутренней поверхности сосудистых катетеров.
Статистический анализ включал методы описательной статистики (среднее значение, стандартное отклонение (SD), min, max).
Результаты / Results
Общая выборка включала 199 ИБ (пациенты с диагностированными инфекциями в ОРИТ). Средний возраст пациентов составил 67,0±14,5 (min — 21, max — 100) лет, доля женщин — 51,2 % (n=102).
Данные о бактериальных посевах были отмечены в 70,89 % (n=141) ИБ, из них рост был обнаружен в 70,92 % (n=100). Средний возраст пациентов, в посевах которых отмечался рост микроорганизмов, составил 64,7 ± 13,3 (min — 24, max — 99) года, доля женщин — 53 % (n=53). Средняя продолжительность госпитализации составила 20,1 ± 9,9 (min — 2, max — 56) дней. В анализ были включены 113 посевов с клинически значимым ростом, полученных от 100 пациентов. Исследуемые материалы были преимущественно представлены мокротой (n=67) и мочой (n=28), посевы крови выполнялись в 12, прочих материалов — в 6 случаях.
В структуре инфекций пациентов с обнаруженным ростом в бактериальном посеве (n=100) лидировали ИНДП (67 %, n=67) и ИМВП (28 %, n=28). КАИ отмечались в 3 % (n=3), в 2 % (n=2) у пациентов был диагностирован криптогенный сепсис.
Анализ числа микроорганизмов, одновременно идентифицированных в бактериальных посевах, обнаружил, что в 31 % (n=35) оно составляло 2 и более, максимальное число было равно 6 (3,5 %, n=4), рис. 1.
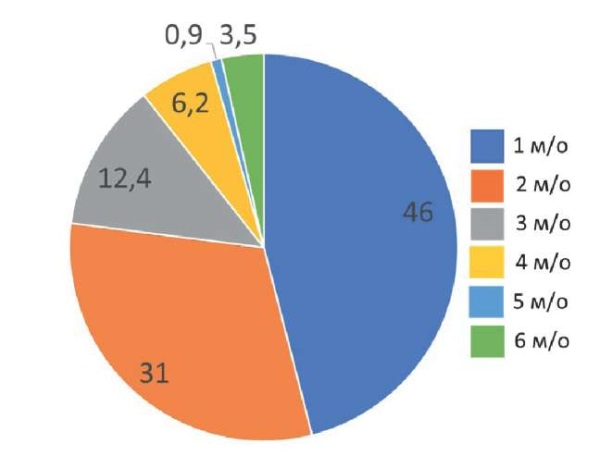
Рис. 1. Структура посевов
по числу одновременно идентифицируемых микроорганизмов (м/о), %
Fig. 1. Structure of crops by the number of simultaneously identifiable microorganisms (m/o), %
Наибольшее число идентифицированных ассоциаций микроорганизмов было выявлено в посевах мокроты, где 2 и более возбудителей присутствовали в 53,7 % (36/67) случаях. В посевах мочи 2 и более микроорганизма были определены в 28,6 (8/28), в посевах крови — в 33,3 % (n=4) в прочих посевах — в 16,87 % (n=1).
Анализ структуры возбудителей обнаружил, что в 28,3 % (n=32) посевов присутствовали только грамотрицательные бактерии, в 17,7 % (n=20) — только грамположительные, комбинация грамотрицательных и грамположительных бактерий была отмечена в 21,2 % (n=24), исключительно анаэробы были идентифицированы в 2-х случаях (1,8 %). Сочетание бактерий и грибов было выявлено в 23,9 % (n=27). Грибы в качестве единственных возбудителей были обнаружены в 8 посевах (7,1 %).
В посевах мокроты (n=67) в структуре возбудителей лидирующая роль принадлежала кандидам, Candida spp., — 22 % (n=26). Подробная структура микроорганизмов, идентифицированных в мокроте, представлена в табл. 1.
Таблица 1
Структура возбудителей, идентифицированных в образцах мокроты
Table 1
Structure of pathogens identified in sputum samples
Возбудители | n (118) | % |
Candida spp. | 26 | 22,0 |
Staphylococcus spp. | 19 | 16,1 |
Klebsiella pneumoniae | 18 | 15,2 |
Neisseria spp. | 15 | 12,7 |
Acinetobacter baumannii | 14 | 11,9 |
Streptococcus viridans | 9 | 7,6 |
E. coli | 4 | 3,4 |
Enterococcus spp. | 4 | 3,4 |
Pseudomonas aeruginosa | 3 | 2,5 |
Stenotrophomonas maltophilia | 2 | 1,7 |
Corynebacterium spp. | 2 | 1,7 |
Rothia mucilaginosa | 1 | 0,9 |
Proteus mirabilis | 1 | 0,9 |
В посевах мочи (n=28) наибольшая частота была характерна для E. coli 32,2 % (n=10), структура возбудителей, идентифицированных в моче, представлена в табл. 2.
Таблица 2
Структура возбудителей, идентифицированных в образцах мочи
Table 2
Structure of pathogens identified in urine samples
Возбудители | n (31) | % |
E. coli | 10 | 32,2 |
Candida spp. | 7 | 22,6 |
Enterococcus spp. | 7 | 22,6 |
Klebsiella pneumoniae | 3 | 9,7 |
Citrobacter koseri | 2 | 6,5 |
Acinetobacter baumannii | 1 | 3,2 |
Pseudomonas aeruginosa | 1 | 3,2 |
Среди возбудителей, обнаруженных в посевах крови (n=12), основными являлись стафилококки — 56,3 % (n=9). Структура микроорганизмов, идентифицированных в образцах крови, представлена в табл. 3.
Таблица 3
Структура возбудителей, идентифицированных в образцах крови
Table 3
Structure of pathogens identified in blood samples
Возбудители | n (16) | % |
Staphylococcus spp. | 9 | 56,3 |
Candida albicans | 3 | 18,7 |
Klebsiella pneumoniae | 2 | 12,5 |
E. coli | 2 | 12,5 |
Анализ прочих посевов выявил 7 возбудителей, детальные данные приведены в табл. 4.
Таблица 4
Структура возбудителей,
идентифицированных в посевах прочих биологических образцов
Table 4
Structure of pathogens identified in crops of other biological samples
Возбудители | n (7) | % | Анализируемый материал |
Staphylococcus aureus | 2 | 28,57 | Аспират из бронхов (n=1), смыв с внутренней поверхности сосудистого катетера (n=1) |
Candida spp. | 2 | 28,57 | Смыв с внутренней поверхности сосудистого катетера (n=1) |
Acinetobacter baumannii | 2 | 28,57 | Смыв с внутренней поверхности сосудистого катетера (n=1), бронхоальвеолярный лаваж (n=1) |
E. coli | 1 | 14,29 | Смыв с раневой поверхности (n=1) |
Следующий этап исследования — идентификация среди вышеперечисленных микроорганизмов тех, у кого был отмечен клинически значимый рост. Число посевов с клиническим значимым ростом составило 59,3 % (n=67), общее число микроорганизмов — 105.
Среди посевов мокроты клинически значимый рост был отмечен в 34. Число возбудителей с клинически значимым ростом — 61. Основные включали K. pneumoniae (29,5 %, n=18), Candida spp. (18 %, n=11) и A. baumannii (18 %, n=11), рис. 2.

Рис. 2. Структура возбудителей (мокрота),
чей рост в среде характеризовался как клинически значимый
Fig. 2. Structure of pathogens (sputum),
whose growth in the medium was characterized as clinically significant
В посевах мочи клинический значимый рост микроорганизмов отмечался в 17 случаях, общее число возбудителей составило 21. Наиболее часто встречалась Klebsiella pneumoniae (28,5 %, n=6) и Candida spp. (23,8 %, n=5), рис. 3.

Рис. 3. Структура возбудителей (моча),
чей рост в среде характеризовался как клинически значимый
Fig. 3. Structure of pathogens (urine),
whose growth in the medium was characterized as clinically significant
В 12 посевах крови был выявлен клинический значимый рост 16 микроорганизмов, среди которых наиболее распространёнными являлись стафилококки, рис. 4.
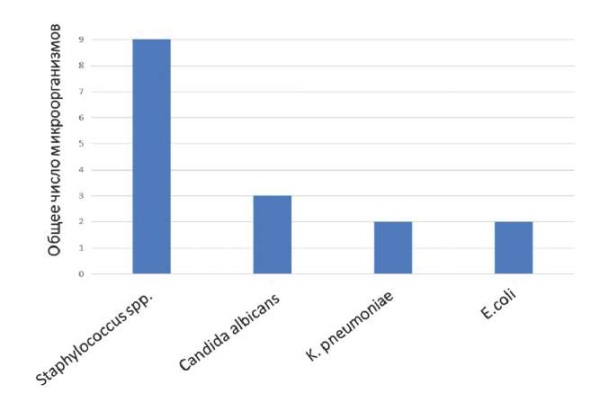
Рис. 4. Структура возбудителей (кровь),
чей рост в среде характеризовался как клинически значимый
Fig. 4. Structure of pathogens (blood),
whose growth in the medium was characterized as clinically significant
Посевы прочих биообразцов продемонстрировали клинически значимый рост во всех случаях, в структуре возбудителей доминировал золотистый стафилококк (табл. 4).
В целом, среди всех возбудителей с клинически значимым ростом на долю грамотрицательных бактерий приходилось 54 %. Среди всех возбудителей наибольшая лидирующая роль принадлежала Klebsiella pneumoniae (22 %, 23/105), кандидам (20 %, 21/105) и стафилококкам (19 %, 20/105), рис. 5.

Рис. 5. Общая структура возбудителей с клинически значимым ростом, %
Fig. 5. General structure of pathogens with clinically significant growth, %
Среди выявленных кандид наиболее часто встречалась Candida albicans (90,5 %, 19/21). Прочие включали Candida tropicalis (1/21) и Сandida parapsilosis (1/21). Среди стафилококков лидером по частоте выявления был S. aureus (50 %, 10/20), прочие были представлены S. epidermidis (40 %, 8/20), S. hominis (5 %, 1/20) и S. haemolyticus (5 %, 1/20). Анализ чувствительности к АБП проводился среди возбудителей, продемонстрировавших клинически значимый рост. K. pneumoniae, A. baumannii и P. aeruginosa обнаружили чувствительность исключительно к колистину; E. coli была преимущественно резистентна к нитроксолину, ампициллину, цефазолину и цефепиму; S. maltophilia характеризовалась резистентностью абсолютно ко всем АБП, использованным в тестах, табл. 5.
Таблица 5
Показатели антибиотикорезистентности основных грамотрицательных бактерий
(% чувствительных (S) и резистентных (R))
Table 5
Indicators of antibiotic resistance of the main gram-negative bacteria
(% sensitive (S) and resistant (R))
Антибактериальные препараты | R/S | K. pneumoniae (n=18) | А. baumannii (n=14) | E. coli (n=12) | P. aeruginosa (n=4) | S. maltophilia (n=2) |
Амикацин | R, % (n) | 72,2 (13) | 92,9 (13) | - | 100 (4) | 100 (2) |
S, % (n) | 27,8 (5) | 7,1 (1) | - | 0 | 0 | |
Азтреонам | R, % (n) | 94,4 (17) | 92,9 (13) | - | 100 (4) | 100 (2) |
S, % (n) | 5,6 (1) | 7,1 (1) | - | 0 | 0 | |
Гентамицин | R, % (n) | 55,6 (10) | 92,9 (13) | - | 75 (3) | 100 (2) |
S, % (n) | 44,4 (8) | 7,1 (1) | - | 25 (1) | 0 | |
Дорипенем | R, % (n) | 94,4 (17) | 92,9 (13) | - | 100 (4) | 100 (2) |
S, % (n) | 5,6 (1) | 7,1 (1) | - | 0 | 0 | |
Имипенем | R, % (n) | 94,4 (17) | 92,9 (13) | - | 100 (4) | 100 (2) |
S, % (n) | 5,6 (1) | 7,1 (1) | - | 0 | 0 | |
Колистин | R, % (n) | 11,1 (2) | 14,3 (2) | 0 | 0 | 100 (2) |
S, % (n) | 88,9 (16) | 85,7 (12) | 100 (11) | 100 (4) | 0 | |
Левофлоксацин | R, % (n) | 94,4 (17) | 92,9 (13) | - | 100 (4) | 100 (2) |
S, % (n) | 5,6 (1) | 7,1 (1) | - | 0 | 0 | |
Меропенем | R, % (n) | 94,4 (17) | 92,9 (13) | 8,3 (1) | 100 (4) | 100 (2) |
S, % (n) | 5,6 (1) | 7,1 (1) | 91,7 (11) | 0 | 0 | |
Пиперациллин тазобактам | R, % (n) | 94,4 (17) | 92,9 (13) | - | - | 100 (2) |
S, % (n) | 5,6 (1) | 7,1 (1) | - | - | 0 | |
Тикарциллин клавуланат | R, % (n) | 94,4 (17) | 92,9 (13) | - | - | 100 (2) |
S, % (n) | 5,6 (1) | 7,1 (1) | - | - | 0 | |
Тобрамицин | R, % (n) | 94,4 (17) | 92,9 (13) | - | 100 (4) | 100 (2) |
S, % (n) | 5,6 (1) | 7,1 (1) | - | 0 | 0 | |
Цефепим | R, % (n) | 94,4 (17) | 92,9 (13) | 83,3 (10) | 100 (4) | 100 (2) |
S, % (n) | 5,6 (1) | 7,1 (1) | 16,7 (2) | 0 | 0 | |
Цефтазидим | R, % (n) | 94,4 (17) | 92,9 (13) | - | 100 (4) | 100 (2) |
S, % (n) | 5,6 (1) | 7,1 (1) | - | 0 | 0 | |
Сульфаметоксазол/триметоприм | R, % (n) | 66,7 (12) | 85,7 (12) | - | - | - |
S, % (n) | 33,3 (6) | 14,3 (2) | - | - | - | |
Ампициллин | R, % (n) | - | - | 83,3 (10) | - | - |
S, % (n) | - | - | 16,7 (2) | - | - | |
Цефазолин | R, % (n) | - | - | 83,3 (10) | - | - |
S, % (n) | - | - | 16,7 (2) | - | - | |
Нитроксолин | R, % (n) | - | - | 83,3 (10) | - | - |
S, % (n) | - | - | 16,7 (2) | - | - |
Примечание: «-» определение чувствительности к данному антибактериальному препарату
лабораторией не проводилось.
Note: "-" sensitivity to this antibacterial drug has not been determined by the laboratory.
Параметры антибиотикорезистентности основных грамположительных бактерий (стафилококков и энтерококков) представлены в табл. 6. S. aureus и S. еpidermidis продемонстрировали абсолютную чувствительность к левофлоксацину, гентамицину, ванкомицину, линезолиду и тигециклину, табл. 6. Как E. faecalis так и E. faecium обнаружили схожий профиль чувствительности (100 % резистентность обнаружена только к ампициллину), табл. 6.
Таблица 6
Показатели антибиотикорезистентности основных грамположительных бактерий
(% чувствительных (S) и резистентных (R))
Table 6
Indicators of antibiotic resistance of the main gram-positive bacteria
(% sensitive (S) and resistant (R))
Антибактериальные препараты | R/S | S. aureus (n=10) | S. еpidermidis (n=8) | S. hominis (n=1) | S. haemolyticus (n=1) | E. faecalis (n=2) | E. faecium (n=3) |
Ампициллин | R, % (n) | 70,0 (7) | 50,0 (4) | 0 | 0 | 100 (2) | 100 (3) |
S, % (n) | 30,0 (3) | 50,0 (4) | 100 (1) | 100 (1) | 0 | 0 | |
Левофлоксацин | R, % (n) | 0 | 0 | 0 | 0 | - | - |
S, % (n) | 100 (10) | 100 (8) | 100 (1) | 100 (1) | - | - | |
Гентамицин | R, % (n) | 0 | 0 | 0 | 0 | - | - |
S, % (n) | 100 (10) | 100 (8) | 100 (1) | 100 (1) | - | - | |
Ванкомицин | R, % (n) | 0 | 0 | 0 | 0 | 50 (1) | 100 (3) |
S, % (n) | 100 (10) | 100 (8) | 100 (1) | 100 (1) | 50 (1) | 0 | |
Линезолид | R, % (n) | 0 | 0 | 0 | 0 | 0 | 0 |
S, % (n) | 100 (10) | 100 (8) | 100 (1) | 100 (1) | 100 (2) | 100 (3) | |
Тигециклин | R, % (n) | 0 | 0 | 0 | 0 | 0 | 0 |
S, % (n) | 100 (10) | 100 (8) | 100 (1) | 100 (1) | 100 (2) | 100 (3) | |
Сульфаметоксазол/Триметоприм | R, % (n) | 30,0 (3) | 12,5 (1) | 0 | 0 | - | - |
S, % (n) | 70,0 (7) | 87,5 (7) | 100 (1) | 100 (1) | - | - | |
Цефокситин | R, % (n) | 70,0 (7) | 50,0 (4) | 0 | 0 | - | - |
S, % (n) | 30,0 (3) | 50,0 (4) | 100 (1) | 100 (1) | - | - |
Примечание: «-» определение чувствительности к данному антибактериальному препарату
лабораторией не проводилось.
Note: "-" sensitivity to this antibacterial drug has not been determined by the laboratory.
Анализ чувствительности кандид обнаружил 100 % чувствительность всех представителей к амфотерицину, итраконазолу, кетоконазолу и флуцитозину. По отношению к флуконазолу резистентность была продемонстрирована у 5 % (n=1) Candida albicans.
Обсуждение / Discussion
Результаты нашего исследования продемонстрировали преобладание грамотрицательной микрофлоры в структуре возбудителей инфекций в ОРИТ (54 %). Грамотрицательные бактерии в настоящее время являются наиболее характерными возбудителями инфекций у пациентов в ОРИТ. Baviskar AS et al. (2019 г.) продемонстрировали среди лидирующих возбудителей инфекций в ОРИТ E. coli (26,59 %) и Acinetobacter spp. (18,08 %) [9]. Ретроспективное когортное исследование (длительность 5 лет) в Индии обнаружило доминирование K. pneumonia (18 %), A. baumannii (14 %) и E. coli (12 %), среди которых 31 % изолятов характеризовался множественной лекарственной устойчивостью [10]. По данным Первухина В. А. и др. (2019 г.) основные возбудители нозокомиальной пневмонии включали P. aeruginosa, A. baumannii и K. pneumoniae, при этом сравнение данных за 2012 и 2017 годы обнаружило значимый рост показателей их устойчивости к АБП: на 20,3 % у P. аeruginosa, на 29,8 % у A. baumannii и на 74,3 % у K. pneumoniae [11].
Наблюдающаяся стойкая тенденция увеличения доли штаммов со множественной лекарственной резистентностью является типичной для большинства стран [3][12–14] и служит одним из факторов риска летального исхода. К таким факторам, по данным Vincent JL et al. (2020 г.), относят инфицирование клебсиеллами, резистентными к бета-лактамным антибиотикам, включая третье поколение цефалоспоринов и карбапенемы (ОШ: 1,29; 95 % ДИ: 1,02–1,63; р=0,03), а также ацинетобактером, резистентным к карбапенемам (ОШ: 1,40; 95 % ДИ: 1,08–1,81; р=0,01) [4].
В РФ актуальные данные о возбудителях инфекций и параметрах их резистентности можно получить, используя веб-платформу AMRmap [15–17]. В ноябре 2023 г. AMRmap демонстрирует следующие топ-5 возбудителей инфекций в отделениях реанимации хирургического и терапевтического профиля: K. pneumoniae — 21,87 %, P. aeruginosa — 19,23 %, A. baumannii — 16,28 %, S. aureus — 12,13 % и E. coli — 9,6 % [ https://amrmap.ru/ Доступ от 08.11.2023].
По нашим данным, абсолютным лидером инфекций в ОРИТ (возбудители с клинически значимым ростом) являлась именно K. pneumoniae (22 %), при этом P. aeruginosa находилась на 7-ом месте в общей структуре возбудителей (4 %). Доля A. baumannii, согласно нашим результатам, составила 13 %, E. сoli — 11 %. При этом наши результаты обнаружили значительную долю стафилококков в структуре возбудителей инфекций в ОРИТ (19 %). Выявленный нами высокий уровень распространённости Candida spp. согласуется с данными ряда международных исследований, подтверждающими значимость грибковых инфекции для пациентов в ОРИТ. Результаты анализа корейской национальной системы надзора за внутрибольничными инфекциями (KONIS) свидетельствуют о том, что доля кандидемий увеличилась с 15,2 % в 2006 г. до 16,6 % в 2017 г. (р=0,001), наиболее типичным возбудителем начиная с 2013 г. стабильно являлась C. albicans [19]. В странах Европы частота инвазивного кандидоза в ОРИТ составляет 7,07 эпизодов на 1000 госпитализаций (данные исследования EUCANDICU) [20]. При этом уровень летальности в случае кандидемии весьма высок: в многоцентровом исследовании пациентов в критических состояниях было продемонстрировано, что при кандидемии и COVID-19 он составлял 39 %, при кандидемии без COVID-19–46 % [21].
Результаты нашего исследования указывают на высокий уровень резистентности таких грамотрицательных бактерий, как K. pneumoniae, A. baumannii, P. aeruginosa и S. maltophilia.
Множественная лекарственная резистентность K. pneumoniae — основного возбудителя инфекций в ОРИТ по нашим данным — свидетельствует о высоком риске неудач фармакотерапии. Рекомендованные схемы комбинированной антибиотикотерапии, направленной против данного микроорганизма, обычно включают назначение аминогликозидов и карбапенемов, цефалоспоринов III и IV поколения, ингибитор-защищённых пенициллинов, фторхинолонов [22–24], по отношению к которым K. pneumoniae в нашем исследовании продемонстрировала высокий уровень резистентности. Рост доли изолятов K. pneumoniae с множественной лекарственной резистентностью, выделяемых у пациентов ОРИТ, является глобальной тенденций [25][26]. Препаратами последней надежды обычно считаются тигециклин и колистин [26]. Чувствительность к первому лабораторией не определялась, единственным из АБП, к которому была сохранена чувствительность K. pneumoniae в нашем исследовании, являлся именно колистин.
A. baumannii по нашим данным был вторым по частоте выделения грамотрицательным возбудителем, профиль резистентности которого в целом совпал с K. pneumoniae и P. aeruginosa. Систематический обзор и метаанализ 126 исследований из 29 стран обнаружил, что общая распространённость множественной лекарственной устойчивости A. baumannii (данные пациентов с нозокомиальной пневмонией и вентилятор-ассоциированной пневмонией) составила 79,9 % (95 % ДИ: 73,9–85,4 %, 114 исследований), при этом максимальные значения были отмечены в странах Центральной Америки (100 %), Латинской Америки и Карибского бассейна (100 %), а минимальные — в Восточной Азии (64,6 %; 95 % ДИ: 50,2–77,6 %) [27].
Доля S. maltophilia в структуре клинически значимых возбудителей, согласно нашим результатам, составила 2 %. Данный микроорганизм был выделен из образцов мокроты пациентов с ИНДП и продемонстрировал резистентность ко всем протестированным АБП. Опубликованные данные указывают на то, что данный возбудитель чаще всего обнаруживают именно у пациентов с ИНДП (65,4 % против 17,3 % при инфекциях кровотока и 8,9 % при ИМВП [28]; 72,8 % против 3,4 % при инфекциях кровотока и 22,8 % при прочих инфекциях [29]). По данным Hafiz TA et al. (2022 г.) наибольшая чувствительность S. maltophilia была обнаружила по отношению к сульфаметоксазол/триметоприм (95,9 %), далее следовали левофлоксацин (68,9 %) и цефтазидим (33,1 %) [28]. Dimopoulos G et al. (2023 г.) продемонстрировали для S. maltophilia чувствительность к сульфаметоксазол/триметоприм (97,2 %), миноциклину (93,2 %) и левофлоксацину (59,2 %) [29]. В нашем исследовании чувствительность S. maltophilia к сульфаметоксазол/триметоприм не тестировалась, при этом по отношению ко всем прочим исследуемым АБП (включая бета-лактамы, аминогликозиды, левофлоксацин) была обнаружена 100 % резистентность.
Среди грамположительных бактерий в нашей работе лидировали стафилококки (2-ое место в общей структуре возбудителей с клинически значимым ростом, 19 %), среди которых основным был S. aureus. В целом, наши данные свидетельствуют о низком уровне резистентности Staphylococcus spp. S. aureus обнаружил 70 % резистентность исключительно по отношению к ампициллину и цефокситину. У пациентов с нозокомиальными инфекциями стафилококки занимают в среднем 3-е место по частоте выявления после основных грамотрицательных возбудителей [30–32], при этом большинство исследований отмечает увеличение доли метициллин-резистентного S. aureus [33–35]. Энтерококки в нашем исследовании были обнаружены в 5 %, они характеризовались 100 % чувствительностью по отношению ко всем тестируемым АБП, исключение — 50 % чувствительность E. faecalis к ванкомицину. Распространённость энтерококков, в частности, ванкомицин-резистентных (VRE), в структуре возбудителей нозокомиальных инфекций по международным данным в два раза выше: систематический обзор и метаанализ 75 исследований (европейский регион, период 2010–2020 гг.) обнаружил значение, равное 10,9 % (95 % доверительный интервал (ДИ): 8,7–13,4; диапазон: 6,1–17,5) для Enterococcus spp. и 1,1 % (95 % ДИ: 0,21–2,7; диапазон: 0,39–2,0) для VRE. В ОРИТ совокупная заболеваемость нозокомиальными инфекциями, вызванными Enterococcus spp. и VRE составила 9,6 (95 % ДИ: 6,3–13,5; диапазон: 0,39–36,0) и 2,6 (95 % ДИ: 0,53–5,8; диапазон: 0–9,7), соответственно [36].
Выводы / Conclusions
Результаты ретроспективного анализа данных пациентов с инфекциями, развившимися в ОРИТ, обнаружил, что в структуре возбудителей доминирует грамотрицательная микрофлора (54 %), в частности, такие её представители, как K. pneumoniae (22 %), A. baumannii (13 %), E. сoli (11 %), P. aeruginosa (4 %) и S. maltophilia (2 %). Наименьшими показателями антибиотикорезистентности характеризовалась E. сoli, 100 % резистентность ко всем тестируемым АБП была обнаружена для S. maltophilia. K. pneumoniae, A. baumannii и P. aeruginosa были чувствительны к колистину (88,9 %; 85,7 %, и 100 %, соответственно). Грамположительная микрофлора (стафилококки и энтерококки) имели в большинстве случаев высокую чувствительность к АБП.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Конфликт интересов. Конфликт интересов не заявляется.
Участие авторов. Все авторы внесли существенный вклад в подготовку работы, прочли и одобрили финальную версию статьи перед публикацией.
Финансирование. Исследование выполнено за счёт Российского научного фонда № 23-73-30004, https://rscf.ru/project/23-73-30004/
ADDITIONAL INFORMATION
Conflict of interests. No conflict of interest is declared.
Authors’ participation. All authors made a significant contribution to the preparation of the work, read and approved the final version of the article before publication.
Financing. The research was supported by Russian Science Foundation, grant #23-73-30004, https://rscf.ru/en/project/23-73-30004/
Список литературы
1. Яковлев С.В., Суворова М.П., Белобородов В.Б., и др. Распространённость и клиническое значение нозокомиальных инфекций в лечебных учреждениях России: исследование ЭРГИНИ. Антибиоти-ки и Химиотерапия. 2016;61(5-6):32-42.
2. European Centre for Disease Prevention and Control. Annual Epidemiological Report for 2018 — Healthcare-associated infections acquired in intensive care units. In: ECDC. Annual epidemiological report for 2018. Stockholm: ECDC; 2023. https://www.ecdc.europa.eu/en/publications-data/healthcare-associated-infections-intensive-care-units-annual-report-2018.
3. Kumar A, Chaudhry D, Goel N, Tanwar S. Epidemiology of Intensive Care Unit-acquired Infections in a Tertiary Care Hospital of North India. Indian J Crit Care Med. 2021 Dec;25(12):1427-1433. doi: 10.5005/jp-journals-10071-24058.
4. Vincent JL, Sakr Y, Singer M, et al. Prevalence and Outcomes of Infection Among Patients in Intensive Care Units in 2017. JAMA. 2020 Apr 21;323(15):1478-1487. doi: 10.1001/jama.2020.2717.
5. Izadi N, Eshrati B, Mehrabi Y, et al. The national rate of intensive care units-acquired infections, one-year retrospective study in Iran. BMC Public Health. 2021 Mar 29;21(1):609. doi: 10.1186/s12889-021-10639-6.
6. Ершов В.И., Белкин А.А., Горбачев В.И., Грицан А.И., Заболотских И.Б., Лебединский К.М., Лейдерман И.Н., Петриков С.С., Проценко Д.Н., Солодов А.А., Щеголев А.В., Тихомирова А.А., Ходченко В.В., Мещеряков А.О., Силкин В.В. Российское многоцентровое обсервационное клиническое исследование «Регистр респираторной терапии у пациентов с ОНМК (RETAS)»: инфекционные осложнения при искусственной вентиляции легких. Анестезиология и реаниматоло-гия . 2023;(1):19-25.
7. E Silva LGA, de Maio Carrilho CMD, Talizin TB, et al. Risk factors for hospital mortality in intensive care unit survivors: a retrospective cohort study. Acute Crit Care. 2023 Feb;38(1):68-75. doi: 10.4266/acc.2022.01375.
8. Hurley JC. Trends in ICU mortality and underlying risk over three decades among mechanically ventilated patients. A group level analysis of cohorts from infection prevention studies. Ann Intensive Care. 2023 Jul 11;13(1):62. doi: 10.1186/s13613-023-01159-0.
9. Baviskar AS, Khatib KI, Rajpal D, Dongare HC. Nosocomial infections in surgical intensive care unit: A retrospective single-center study. Int J Crit Illn Inj Sci. 2019 Jan-Mar;9(1):16-20. doi: 10.4103/IJCIIS.IJCIIS_57_18.
10. Chenchula S, Sadasivam B, Shukla A, et al. Health care associated infections, antimicrobial resistance and outcomes in patients admitted to intensive care unit, India: A Five-Year retrospective cohort study. J Infect Prev. 2023 Jul;24(4):159-165. doi: 10.1177/17571774231161821.
11. Первухин С.А., Стаценко И.А., Иванова Е.Ю., и др. Антибиотико-резистентность грамотрицательных возбудителей нозокомиальной пневмонии у пациентов отделения реанимации и интенсивной терапии. Клиническая микробиология и антимикробная химиотерапия . 2019;21(1):62-68.
12. Siwakoti S, Subedi A, Sharma A, et al. Incidence and outcomes of multidrug-resistant gram-negative bacteria infections in intensive care unit from Nepal - a prospective cohort study. Antimicrob Resist Infect Control. 2018 Sep 26;7:114. doi: 10.1186/s13756-018-0404-3.
13. Maina JW, Onyambu FG, Kibet PS, Musyoki AM. Multidrug-resistant Gram-negative bacterial infections and associated factors in a Kenyan intensive care unit: a cross-sectional study. Ann Clin Microbiol Antimicrob. 2023 Sep 14;22(1):85. doi: 10.1186/s12941-023-00636-5.
14. Althaqafi A, Yaseen M, Farahat F, et al. Evidence-Based Interventions to Reduce the Incidence of Common Multidrug-Resistant Gram-Negative Bacteria in an Adult Intensive Care Unit. Cureus. 2023 Jun 5;15(6):e39979. doi: 10.7759/cureus.39979.
15. Kuzmenkov AY, Trushin IV, Vinogradova AG, et al. AMRmap: An Interactive Web Platform for Analysis of Antimicrobial Resistance Surveillance Data in Russia. Front Microbiol. 2021 Mar 12;12:620002. doi: 10.3389/fmicb.2021.620002.
16. Кузьменков А.Ю., Виноградова А.Г., Трушин И.В., и др. AMRmap — система мониторинга антибиотикорезистентности в России. Кли-ническая микробиология и антимикробная химиотерапия. 2021; 23(2):198-204.
17. Виноградова А.Г., Кузьменков А.Ю. Практическое применение AMRmap: элементы подхода «от общего к частному» на примере Klebsiella pneumoniae. Клиническая микробиология и антимикробная химиотерапия. 2019;21(2):181-186.
18. https://amrmap.ru/ Режим доступа от: 08.11.2023.
19. Kim EJ, Lee E, Kwak YG, et al. Trends in the Epidemiology of Candidemia in Intensive Care Units From 2006 to 2017: Results From the Korean National Healthcare-Associated Infections Surveillance System. Front Med (Lausanne). 2020 Dec 17;7:606976. doi: 10.3389/fmed.2020.606976.
20. Bassetti M, Giacobbe DR, Vena A, et al. Incidence and outcome of invasive candidiasis in intensive care units (ICUs) in Europe: results of the EUCANDICU project. Crit Care. 2019 Jun 14;23(1):219. doi: 10.1186/s13054-019-2497-3.
21. Pallotta F, Brescini L, Ianovitz A, et al. The Clinical Characteristics of Bloodstream Infections Due to Candida spp. in Patients Hospitalized in Intensive Care Units during the SARS-CoV-2 Pandemic: The Results of a Multicenter Study. J Fungi (Basel). 2023 Jun 1;9(6):642. doi: 10.3390/jof9060642.
22. Yasin F, Assad S, Talpur AS, Zahid M, Malik SA. Combination Therapy for Multidrug-Resistant Klebsiella Pneumoniae Urinary Tract Infection. Cureus. 2017 Jul 22;9(7):e1503. doi: 10.7759/cureus.1503.
23. Russo A, Fusco P, Morrone HL, Trecarichi EM, Torti C. New advances in management and treatment of multidrug-resistant Klebsiella pneumoniae. Expert Rev Anti Infect Ther . 2023;21(1):41-55. doi:10.1080/14787210.2023.2151435.
24. Li Y, Kumar S, Zhang L, Wu H, Wu H. Characteristics of antibiotic resistance mechanisms and genes of Klebsiella pneumoniae. Open Med (Wars). 2023;18(1):20230707. Published 2023 May 12. doi:10.1515/med-2023-0707.
25. Sharma A, Thakur A, Thakur N, et al. Changing Trend in the Antibiotic Resistance Pattern of Klebsiella Pneumonia Isolated From Endotracheal Aspirate Samples of ICU Patients of a Tertiary Care Hospital in North India. Cureus . 2023;15(3):e36317. Published 2023 Mar 17. doi:10.7759/cureus.36317.
26. Karampatakis T, Tsergouli K, Behzadi P. Carbapenem-Resistant Klebsiella pneumoniae: Virulence Factors, Molecular Epidemiology and Latest Updates in Treatment Options. Antibiotics (Basel). 2023 Jan 21;12(2):234. doi: 10.3390/antibiotics12020234.
27. Mohd Sazlly Lim S, Zainal Abidin A, Liew SM, Roberts JA, Sime FB. The global prevalence of multidrug-resistance among Acinetobacter baumannii causing hospital-acquired and ventilator-associated pneumonia and its associated mortality: A systematic review and meta-analysis . J Infect. 2019 Dec;79(6):593-600. doi: 10.1016/j.jinf.2019.09.012.
28. Hafiz TA, Aldawood E, Albloshi A, et al. Stenotrophomonas maltophilia Epidemiology, Resistance Characteristics, and Clinical Outcomes: Understanding of the Recent Three Years' Trends. Microorganisms. 2022 Dec 18;10(12):2506. doi: 10.3390/microorganisms10122506.
29. Dimopoulos G, Garnacho-Montero J, Paramythiotou E, et al. Upraising Stenotrophomonas maltophilia in Critically Ill Patients: A New Enemy? Diagnostics (Basel). 2023 Mar 15;13(6):1106. doi: 10.3390/diagnostics13061106.
30. Yang X, Guo R, Xie B, et al. Drug resistance of pathogens causing nosocomial infection in orthopedics from 2012 to 2017: a 6-year retrospective study. J Orthop Surg Res. 2021 Feb 1;16(1):100. doi: 10.1186/s13018-021-02234-7.
31. Li SG, Liao K, Su DH, et al. [Analysis of pathogen spectrum and antimicrobial resistance of pathogens associated with hospital-acquired infections collected from 11 teaching hospitals in 2018]. Zhonghua Yi Xue Za Zhi. 2020 Dec 22;100(47):3775-3783. Chinese. doi: 10.3760/cma.j.cn112137-20200430-01389.
32. Saharman YR, Karuniawati A, Severin JA, Verbrugh HA. Infections and antimicrobial resistance in intensive care units in lower-middle income countries: a scoping review. Antimicrob Resist Infect Control. 2021 Jan 29;10(1):22. doi: 10.1186/s13756-020-00871-x.
33. Mehta Y, Hegde A, Pande R, et al. Methicillin-resistant Staphylococcus aureus in Intensive Care Unit Setting of India: A Review of Clinical Burden, Patterns of Prevalence, Preventive Measures, and Future Strategies. Indian J Crit Care Med. 2020 Jan;24(1):55-62. doi: 10.5005/jp-journals-10071-23337.
34. Зырянов С.К., Сычев И.Н., Гущина Ю.Ш. Современные проблемы инфекций, вызванных MRSA, и пути их решения. Антибиотики и Химиотерапия. 2017;62(7-8):69-79.
35. Романов А.В., Дехнич А.В., Сухорукова М.В., и др. Антибиотико-резистентность нозокомиальных штаммов Staphylococcus aureus в стационарах России: результаты многоцентрового эпидемиологического исследования «МАРАФОН» 2013-2014. Клиническая микро-биология и антимикробная химиотерапия. 2017;19(1):57-62.
36. Brinkwirth S, Ayobami O, Eckmanns T, Markwart R. Hospital-acquired infections caused by enterococci: a systematic review and meta-analysis, WHO European Region, 1 January 2010 to 4 February 2020. Euro Surveill. 2021 Nov;26(45):2001628. doi: 10.2807/1560-7917.ES.2021.26.45.2001628.
Об авторах
О. И. БутрановаРоссия
Бутранова Ольга Игоревна, к. м. н., доцент кафедры общей и клинической фармакологии; н. с.
Москва
С. К. Зырянов
Россия
Зырянов Сергей Кенсаринович, д. м. н., профессор, зав. кафедрой общей и клинической фармакологии; гл. н. с.; заместитель главного врача
Москва
А. А. Горбачева
Россия
Горбачева Анастасия Андреевна, аспират 1 года кафедры общей и клинической фармакологии; инженер-исследователь
Москва
Г. А. Пуцман
Россия
Пуцман Глеб Александрович, инженер-исследователь; врач-клинический фармаколог
Москва
Рецензия
Для цитирования:
Бутранова О.И., Зырянов С.К., Горбачева А.А., Пуцман Г.А. Анализ структуры и показателей антибиотикорезистентности возбудителей инфекций у пациентов в отделениях интенсивной терапии многопрофильного стационара. Качественная клиническая практика. 2023;(4):4-14. https://doi.org/10.37489/2588-0519-2023-4-4-14
For citation:
Butranova O.I., Zyryanov S.K., Gorbacheva A.A., Putsman G.A. Analysis of the infectious agent’s structure and antibiotic resistance parameters in patients in intensive care units of a multidisciplinary hospital. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2023;(4):4-14. (In Russ.) https://doi.org/10.37489/2588-0519-2023-4-4-14

















































