Перейти к:
Применение нового перорального противовирусного препарата молнупиравира в лечении COVID-19 с позиции безопасности
https://doi.org/10.37489/2588-0519-2022-3-35-51
Аннотация
Молнупиравир является противовирусным препаратом с широким спектром активности в отношении РНК-вирусов. Проведён анализ безопасности молнупиравира в клинических исследованиях при COVID-19. Согласно результатам исследования фазы I (NCT04392219) молнупиравир хорошо переносился в дозах от 50 до 800 мг дважды в день в течение 5,5 дня и в разовых дозах до 1600 мг. Частыми неблагоприятными событиями были головная боль (18,8 % плацебо против 12,5 % молнупиравира) при однократной дозе и диарея (7,1 % в обеих группах) при многократном применении. В исследовании фазы II в группе молнупиравира 800 мг отмечались нежелательные явления в виде головной боли, бессонницы и повышения уровня аланинаминотрансферазы. Серьёзные нежелательные явления, приведшие к госпитализации, наблюдались в группе плацебо (1,6 %) по причине гипоксии, в группе молнупиравира в дозе 400 мг у двух (3,2 %) участников по причине нарушения мозгового кровообращения и у одного (1,8 %) участника в дозе 800 мг в связи с острой дыхательной недостаточностью. В исследовании MOVe-OUT (NCT04575597) фазы III нежелательные явления отмечались в 30,4 % в группе молнупиравира и 33,0 % в группе плацебо. В исследовании фазы III CTRI/2021/06/033992 нежелательные явления встречались у 6,5 % в группе молнупиравира против 8,9 % при плацебо. Результаты проведённых исследований демонстрируют безопасность, хорошую переносимость молнупиравира в клинических испытаниях фаз I, II и III и противовирусную эффективность препарата в отношении COVID-19. Применение молнупиравира при COVID-19 лёгкой или умеренной (SpO2 > 93 %) степени тяжести в течение 5 дней после появления симптомов значительно снижает прогрессирование заболевания за счёт сокращения госпитализаций и/или частоты летальных исходов.
Ключевые слова
Для цитирования:
Хохлов А.Л., Рыбачкова Ю.В. Применение нового перорального противовирусного препарата молнупиравира в лечении COVID-19 с позиции безопасности. Качественная клиническая практика. 2022;(3):35-51. https://doi.org/10.37489/2588-0519-2022-3-35-51
For citation:
Khokhlov A.L., Rybachkova J.V. The use of a new oral antiviral drug molnupiravir in the treatment of COVID-19 from a safety perspective. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2022;(3):35-51. (In Russ.) https://doi.org/10.37489/2588-0519-2022-3-35-51
Введение / Introduction
Коронавирус-2 тяжёлого острого респираторного синдрома (severe acute respiratory syndrome coronavirus 2, SARS-CoV-2) — вирус, ответственный за коронавирусное заболевание — 2019 (coronavirus disease 2019, COVID-19), — вызвал более 166 000 000 случаев подтверждённых инфекций и 3 400 000 смертей во всём мире по состоянию на 23.05.20211, а по данным Всемирной организации здравоохранения (ВОЗ), на 25.02.2022 имелись сведения уже о 430 257 564 подтверждённых случаях COVID-19, из которых 5 922 049 привели к летальному исходу. По состоянию на 20.02.2022 введено в общей сложности 10 407 359 583 доз вакцин против SARS-CoV-22. Однако применение вакцин ассоциировано с возникновением побочных эффектов от лёгкой до средней степени тяжести, а также ограничением применения в связи с определёнными противопоказаниями.
Пандемия COVID-19 привела к острой необходимости разработки новых лекарственных препаратов, способных нивелировать синдромные нарушения витальных функций, приводящие к тяжёлому течению заболевания и возможному летальному исходу. В связи с этим определённую клиническую значимость приобретает применение молнупиравира — препарата с широким спектром активности в отношении РНК-вирусов (в том числе SARS-CoV-2, других коронавирусов, вируса гриппа, вируса гепатита С и др.). Препарат был разработан учёными из Университета разработки лекарств Эмори (Emory Institute for Drug Development, EIDD), США, при финансовой поддержке правительства США [1]. Изначально молнупиравир предназначался для лечения гриппа. На момент начала пандемии COVID-19 проводились доклинические исследования противовирусного действия препарата при сезонном гриппе. После распространения COVID-19 в программы доклинических и клинических исследований разработки молнупиравира было включено изучение его активности против возбудителя COVID-19 [1].
Цель / Goal
Цель работы — анализ информации о безопасности применения молнупиравира при COVID-19 в клинических исследованиях.
Молнупиравир представляет собой пролекарство, метаболизирующееся до аналога рибонуклеозида β-D-N4-гидроксицитидина (NHC), действует путём ингибирования РНК-зависимой РНК-полимеразы (RdRp, РНК-репликаза), что вызывает мутагенез РНК вируса [2][3]. Результаты проведённых исследований подтвердили, что молнупиравир обладает противовирусной активностью в отношении вирусов гриппа, птичьего гриппа, SARS, ближневосточного респираторного синдрома (Middle East respiratory syndrome-related coronavirus, MERS-CoV), а также SARS-CoV-2 (в основном проводились доклинические исследования на моделях in vivo и in vitro). Препарат быстро всасывается из желудочно-кишечного тракта, проходит через гематоэнцефалический барьер, хорошо распределяется в дыхательных путях (включая лёгкие), что потенциально важно для лечения респираторных инфекций.
По состоянию на 28.01.2022 компания Merck объявила об активности молнупиравира против штамма SARS-CoV-2 Омикрон (B1.1.529) in vitro согласно данным 6 доклинических исследований препарата. Необходимо проведение дальнейших клинических исследований для подтверждения эффективности молнупиравира в отношении нового штамма Омикрон3 и его безопасности.
С этой целью проведено рандомизированное контролируемое исследование (ChiCTR2200056817) с участием пациентов лёгкой или средней степени тяжести COVID-19. Оценивалась противовирусная эффективность и безопасность молнупиравира у пациентов, инфицированных штаммом SARS-CoV-2 Омикрон, с продолжительностью симптомов в течение 5 дней [29].
Первичной конечной точкой было время клиренса вирусной РНК на 5, 7 и 10-й дни исследования. Пациенты были рандомизированы для перорального приёма молнупиравира (800 мг) в комбинации с базовой терапией (n=77) или только базовое лечение (n=31) в течение 5 дней (2 раза в день).
Результаты исследования показали, что время клиренса вирусной РНК (первичная конечная точка) значительно снизилось в группе молнупиравира (медиана 9 дней) по сравнению с контрольной группой (медиана 10 дней) (p=0,0092). Это свидетельствует об эффективном влиянии молнупиравира на клиренс вирусной РНК у пациентов, инфицированных штаммом Омикрон, что согласуется с противовирусной эффективностью молнупиравира при лечении COVID-19.
Ключевой вторичной вирусологической конечной точкой этого исследования был процент пациентов с отрицательным результатом на вирусную РНК на 5, 7 и 10-й дни.
18,42 % пациентов достигли элиминации вирусной РНК на 5-й день лечения молнупиравиром по сравнению с группой контроля (0 %) (p=0,0092). На 7-й день у 40,79 % и 6,45 % пациентов в группе молнупиравира и контрольной группе соответственно был достигнут клиренс вирусной РНК (p=0,0004). На 10-й день исследования соответственно 76,32 % в группе молнупиравира против 51,6 % в группе контроля (p=0,02).
Кроме того, молнупиравир продемонстрировал хороший профиль безопасности, серьёзных нежелательных явлений в этом исследовании не наблюдалось. В группе молнупиравира выявлены 3 нежелательных явления (НЯ): сыпь у 1 пациента (1,3 %) и повышенный уровень АЛТ в 2,6 % случаев [29].
Согласно результатам исследования I фазы, у здоровых добровольцев подтверждён профиль безопасности молнупиравира. Среди участников в группе молнупиравира серьёзных нежелательных явлений (СНЯ) не было. Кроме того, менее половины пациентов, получающих препарат, сообщили о побочных эффектах. В 93,3 % случаев отмечалось лёгкое течение заболевания.
В первом рандомизированном двойном слепом плацебо-контролируемом исследовании фазы I применения молнупиравира на здоровых добровольцах по определению безопасности и фармакокинетики молнупиравира оценивались однократные и многократные дозы препарата. Кроме того, в данном исследовании изучалась фармакокинетика молнупиравира при применении разовых доз как после приёма пищи с высоким содержанием жира, так и в состоянии натощак с 14-дневным периодом отмывки (NCT04392219) [2].
Применение однократных доз молнупиравира 50–1600 мг и плацебо проведено на 64 субъектах. Исследование многократных доз молнупиравира 50–800 мг два раза в сутки или плацебо оценивалось у 56 добровольцев в течение 5,5 дня. Каждая группа повышения дозы включала 8 субъектов, из которых 6 получали молнупиравир, а 2 — плацебо. Влияние пищи на фармакокинетические параметры оценивалось у 10 добровольцев при применении молнупиравира в дозе 200 мг. За субъектами наблюдали в течение 14 дней после завершения приёма препарата для оценки безопасности, переносимости и фармакокинетики. Возраст испытуемых составлял от 19 до 60 лет, средний индекс массы тела был от 24,4 до 25,4 кг/м2. В табл. 1 представлены демографические данные субъектов исследования фазы I применения молнупиравира (NCT04392219).
Таблица 1
Демографические данные субъектов исследования фазы I молнупиравира (NCT04392219) [2]
Table 1
Demographics of subjects in the phase I molnupiravir study (NCT04392219) [2]
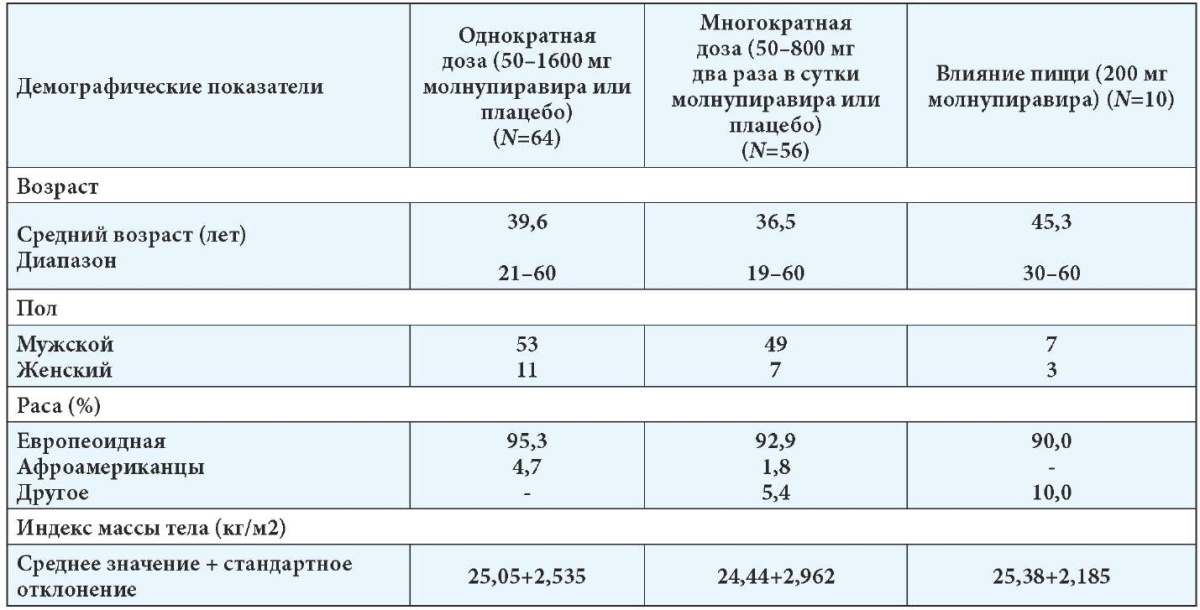
В когорте применения разовых возрастающих доз 37,5 % субъектов сообщили о нежелательных явлениях (НЯ). Не наблюдалось явных дозозависимых тенденций, при этом большая часть субъектов сообщали о НЯ после введения плацебо (43,8 %), чем при применении молнупиравира (35,4 %). В исследовании сообщалось только об одном НЯ средней степени тяжести (головная боль) в группе молнупиравира при дозе 400 мг и одном НЯ средней степени тяжести (тошнота и головная боль) после приёма плацебо. СНЯ в исследовании не отмечалось. В данном исследовании при применении однократных доз молнупиравира в сравнении с плацебо наиболее частым НЯ была головная боль, которая встречалась в 18,8 % случаев в группе плацебо и у 12,5 % пациентов в группе молнупиравира.
В когорте многократных возрастающих доз молнупиравира НЯ отмечались в 44,6 % случаев. Не наблюдалось явных дозозависимых тенденций, при этом большая часть субъектов сообщали о НЯ после введения плацебо (50,0 %), чем после применения молнупиравира (42,9 %). У одного пациента отмечалось НЯ средней степени выраженности — боли в ротоглотке, боли в конечностях и гриппоподобные проявления. Наиболее частым НЯ была диарея в 7,1 % случаев как при применении молнупиравира, так и в группе плацебо. Один доброволец прекратил приём исследуемого препарата на 4-й день из-за нежелательного явления в виде лёгкой, макулопапулёзной зудящей сыпи в когорте многократных доз после приёма 800 мг молнупиравира дважды в день, что, по мнению исследователей, связано с исследуемым препаратом. После прекращения лечения субъекту проведено лечение гормональными и антигистаминными препаратами, вследствие чего выявленные симптомы (зуд и сыпь) исчезли в течение 18 дней.
В исследовании оценки воздействия пищи каждый из трёх субъектов сообщил об одном НЯ, все из которых были лёгкой степени тяжести. При введении молнупиравира в сытом состоянии менее половины субъектов сообщили о нежелательных явлениях. Частота НЯ была выше после приёма плацебо, а 93,3 % нежелательных явлений были лёгкой степени тяжести [2].
В течение всего исследования не было зарегистрировано серьёзных нежелательных явлений, а также не было тенденций к увеличению частоты или тяжести нежелательных явлений при применении более высоких доз молнупиравира. Не наблюдалось клинически значимых изменений или дозозависимых тенденций в данных лабораторных показателей, показателях жизненно важных функций и данных электрокардиограммы.
Согласно результатам исследования фазы I, молнупиравир хорошо переносился в дозах от 50 до 800 мг два раза в день в течение 5,5 дня и в разовых дозах до 1600 мг. Наиболее часто наблюдаемыми неблагоприятными событиями были головная боль при однократном возрастании дозы и диарея при многократном возрастании дозы. Большее количество добровольцев, получавших плацебо, сообщали о головных болях при однократном увеличении дозы (18,8 % плацебо против 12,5 % молнупиравира), и такое же количество субъектов, получавших плацебо, сообщило о диарее в группе многократного увеличения дозы (7,1 %), что и субъектов, которые принимали молнупиравир [2].
Представленные данные по безопасности молнупиравира в фазу I, безусловно, имеют высокую степень доказательности и должны непременно учитываться при проведении дальнейших исследований препарата.
Молнупиравир также продемонстрировал хорошую переносимость и дозозависимую фармакокинетику после введения здоровым добровольцам в клинически значимых дозах, что позволяет оценить клиническую эффективность и безопасность его применения в крупномасштабных исследованиях COVID-19 [4].
В рандомизированное двойное слепое многоцентровое исследование фазы IIа (NCT04405570) включено 202 человека. 62 пациента, получали плацебо, молнупиравир в дозе 200 мг получали 23 пациента, 400 мг молнупиравира получали 62 пациента и 55 человек принимали 800 мг препарата. Основной конечной точкой этого исследования было время до клиренса вирусной РНК в мазках из носоглотки (<1018 копий/мл). В группе молнупиравира, принимавшей 800 мг, данный показатель был значительно меньше (медиана 14 дней), по сравнению с группой плацебо (медиана 15 дней, р=0,013). Время до клиренса вирусной РНК в группах молнупиравира 200 или 400 мг существенно не отличалось от участников, получавших плацебо.
Процент участников, у которых был достигнут клиренс РНК SARS-CoV-2 к 28-му дню исследования, также был выше в группе пациентов, принимающих 800 мг молнупиравира (92,5 %), по сравнению с теми, кто принимал 200 мг молнупиравира (91,3 %), 400 мг молнупиравира (78,7 %) или плацебо (80,3 %).
Что касается безопасности, то молнупиравир и плацебо были связаны с небольшим количеством нежелательных явлений, в основном незначительной степени тяжести [5]. При применении молнупиравира в дозе 800 мг отмечалась самая низкая частота НЯ. Единственными нежелательными явлениями, о которых сообщили более 4 участников, были головная боль, бессонница и повышение уровня аланинаминотрансферазы. Два (1,4 %) НЯ привели к отмене молнупиравира по сравнению с 1 (1,6 %) для плацебо. Нежелательные явления 3-й степени и выше имели место у 5,0 % и 8,1 % в группах молнупиравира и плацебо соответственно. Частота встречаемости НЯ в зависимости от применяемых доз молнупиравира исследования NCT04405570 представлена в табл. 2.
Таблица 2
Частота встречаемости нежелательных явлений в исследовании фазы IIа (NCT04405570)
Table 2
Frequency of Adverse Events in the Phase IIa Study (NCT04405570)
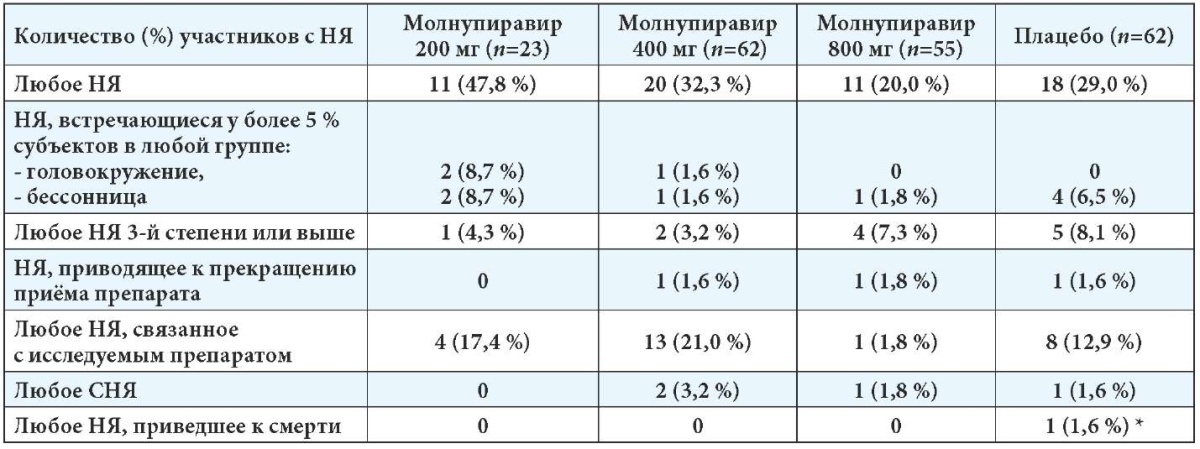
Примечание: * У субъекта было НЯ в виде гипоксии, которое привело к смерти. Данное СНЯ возникло через 31 день после завершения исследования и не было зарегистрировано в базе данных исследования, но было зарегистрировано в базе данных безопасности.
Note: * The subject had NYA in the form of hypoxia, which led to death. This SNA occurred 31 days after the completion of the study and was not registered in the study database, but was registered in the security database.
Частота встречаемости нежелательных явлений в исследовании фазы IIа
Во время исследования не отмечалось изменений в лабораторных параметрах, связанных с проводимым лечением в соответствующей дозе.
Выявлены 4 СНЯ, которые привели к госпитализации субъектов исследования. Это гипоксия при применении плацебо (1,6 %), в 3,2 % случаев выявлено нарушение мозгового кровообращения при приёме молнупиравира в дозе 400 мг, и у 1 добровольца (1,8 %) отмечались признаки острой дыхательной недостаточности при применении 800 мг молнупиравира. После завершения исследования у участника, получавшего плацебо, произошла смерть от COVID-19 за пределами 28-дневного временного интервала исследования [5].
Представленное исследование демонстрирует убедительные доказательства, подтверждающие эффективность применения молнупиравира в качестве перорального средства для снижения репликации инфекционного вируса и прерывания прогрессирования COVID-19 на ранних стадиях заболевания. Безопасность молнупиравира в данном исследовании согласуется с результатами исследования фазы I, а также прослеживается в текущих клинических исследованиях [2]. В целом молнупиравир хорошо переносился без повышения частоты нежелательных явлений, связанных с лечением, или серьёзных побочных эффектов по сравнению с участниками, получавшими плацебо. Не отмечалось никаких изменений в гематологических показателях, а также признаков почечной или печёночной недостаточности при любой дозе препарата.
Профиль безопасности молнупиравира был продемонстрирован на основании данных промежуточного и окончательного анализа результатов двойного слепого рандомизированного плацебо-контролируемого исследования MOVe-OUT (NCT04575597) фазы III [6].
Исследование было проведено для оценки эффективности и безопасности лечения молнупиравиром в течение 5 дней после появления признаков или симптомов у амбулаторных непривитых взрослых с диагнозом COVID-19 лёгкой и средней степени тяжести, лабораторно подтверждённым и, по крайней мере, имеющим один фактор риска для возникновения тяжёлого течения COVID-19 [6].
Участники исследования были случайным образом распределены для получения 800 мг молнупиравира или плацебо два раза в день в течение 5 дней. Основная конечная точка исследования — оценка частоты госпитализации или смерти на 29-е сутки. Частота встречаемости НЯ была основной конечной точкой безопасности.
Промежуточный анализ данного исследования был проведён на 775 пациентах, из них 387 человек получали молнупиравир и 388 — плацебо.
Промежуточный анализ показал, что 7,3 % пациентов (28/387), принимавших молнупиравир, по сравнению с 14,1 % пациентов, принимавших плацебо (53/377), были госпитализированы или умерли, что свидетельствует о значительном снижении риска госпитализации или смерти, на 50 % (p=0,0012) на 29-й день. В группе молнупиравира не было зарегистрировано летальных исходов по сравнению с 8 смертельными исходами в группе плацебо на 29-й день исследования.
Частота возникновения любых НЯ (35 % в группе молнупиравира, 40 % — плацебо) и НЯ, связанных с приёмом препарата (12 % против 11 % при применении молнупиравира по сравнению с группой плацебо соответственно), оказалась одинаковой в группах молнупиравира и плацебо. Однако меньше пациентов в группе молнупиравира прекратили лечение по сравнению с контрольной группой (1,3 % против 3,4 % соответственно) [7–9].
В окончательный анализ исследования MOVe-OUT было включено 1433 пациента (716 в группе молнупиравира и 717 — плацебо).
Согласно результатам окончательного анализа исследования, частота госпитализаций или смертей в течение 29-го дня составила 30 % по сравнению с результатами промежуточного анализа (50 %). Несмотря на выявленную разницу по первичной конечной точке исследования, молнупиравир продемонстрировал значительное снижение смертности. Риск смерти был ниже на 89 % (95 % ДИ, 14–99 %) при приёме молнупиравира, чем при приёме плацебо. Кроме того, исследование MOVe-OUT показало преимущества молнупиравира по шкале клинического прогрессирования ВОЗ по сравнению с плацебо. Разница между результатами промежуточного и окончательного анализов исследования MOVe-OUT представлена в табл. 3. Вероятно, что многие факторы коррелируют с этой разницей. Следует отметить, что большее количество участников на этапе включения имели низкую вирусную нагрузку (меньший вирусологический эффект) в группе окончательного анализа, чем во время промежуточного анализа. Кроме того, в окончательный анализ исследования в группу плацебо было включено несколько больше пациентов женского пола (ниже риск тяжёлого течения COVID-19, чем у пациентов мужского пола), а также большее количество участников с антителами к нуклеокапсиду SARS-CoV-2, что также предполагает более низкий риск.
Таблица 3
Сравнительный анализ данных между промежуточным и окончательным анализами исследования MOVe-OUT
Table 3
Comparison of data between interim and final analyzes of the MOVe-OUT study
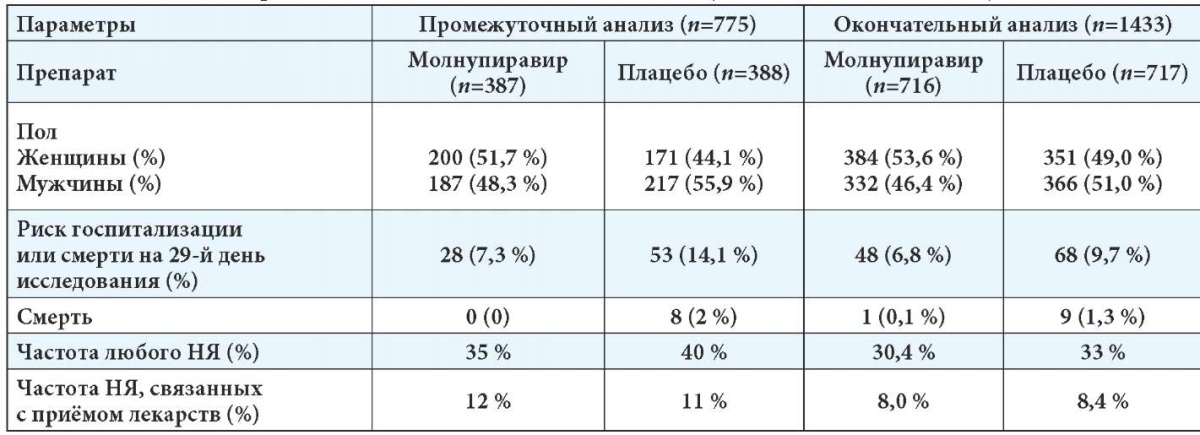
Все эти факторы могли способствовать более низкой общей частоте событий в группе плацебо в полностью рандомизированной выборке, чем в промежуточном анализе. Кроме того, в окончательный анализ исследования вошли новые страны с различной практикой госпитализации пациентов, что также могло повлиять на показатели госпитализации как часть первичной точки исследования.
Согласно результатам окончательного анализа, процент участников, у которых нежелательные явления были одинаковыми в обеих группах (30,4 % в группе молнупиравира и 33,0 % в группе плацебо), как и процент участников с неблагоприятными событиями, по мнению исследователей, был связан с режимом исследования (8,0 % против 8,4 %). Летальные исходы, вызванные неблагоприятными событиями, по мнению исследователей, не были связаны с режимом исследования, и реже отмечались в группе молнупиравира чем в группе плацебо.
После 29-го дня исследования, три НЯ в виде летальных исходов были зафиксированы в группе плацебо по сравнению с одной дополнительной смертью, зарегистрированной в группе молнупиравира.
Наиболее часто сообщаемые нежелательные явления (возникшие у ≥2 % участников в обеих группах) были пневмония, вызванная COVID-19 (у 6,3 % участников в группе молнупиравира по сравнению с 9,6 % в группе плацебо), диарея (2,3 % против 3,0 %) и бактериальная пневмония (2,0 % против 1,6 %); ухудшение течения COVID-19 фиксировалось как неблагоприятное событие в 7,9 % по сравнению с 9,8 %.
Часто сообщаемые нежелательные явления (происходящие у ≥1 % участников в любой группе) были оценены исследователями как связанные с режимом терапии — диарея (1,7 % против 2,1 %), тошнота (1,4 % против 0,7 %) и головокружение (1,0 % против 0,7 %). По одному участнику в группах молнупиравира и плацебо имели количество тромбоцитов ниже 50 000 на микролитр. Низкое количество тромбоцитов у пациента, получавшего молнупиравир, было зарегистрировано на 12-й день и не было, по мнению исследователей, связано с лечением (табл. 4).
Таблица 4
Частота нежелательных явлений в исследовании MOVe-OUT (NCT04575597) фазы III [6]
Table 4
Adverse Event Rates in the Phase III MOVe-OUT Study (NCT04575597) [6]

Примечания: ДИ — доверительный интервал; * Показанные различия относятся к молнупиравиру по сравнению с плацебо. Оценки различий были основаны на методе Миеттинена и Нурминена; † Связанными событиями были события, которые, по мнению исследователей, были связаны с назначенным режимом терапии.
Notes: ДИ — CI — confidence interval; * The differences shown relate to molnupiravir compared to placebo. Estimates of differences were based on the Miettinen and Nurminen method; † Related events were events that, according to the researchers, were associated with the prescribed therapy regimen.
Таким образом, данные исследования фазы III MOVе-OUT у негоспитализированных взрослых пациентов из группы риска с COVID-19 указывают на безопасность молнупиравира и эффективность приёма препарата в течение 5 дней после появления симптомов, в виде снижения риска госпитализации по любой причине или смерти в течение первых 29 дней исследования. Исследуемая популяция была репрезентативной для пациентов в реальной клинической практике с одним или несколькими факторами риска тяжёлого течения COVID-19 [10–13].
Как и в предыдущих исследованиях [2][5][14–16], никаких проблем с безопасностью молнупиравира выявлено не было и не было выявлено доказательств клинически значимых отклонений в лабораторных показателях.
Согласно полученным результатам промежуточного анализа (n=741) клинического исследования CTRI/2021/07/034588 фазы III (рандомизированное, открытое, плацебо-контролируемое, многоцентровое), среди амбулаторных взрослых больных с COVID-19 лёгкой степени тяжести побочные реакции носили несерьёзный характер, манифестировали в лёгкой форме и не приводили к прекращению лечения молнупиравиром. Среди самых распространённых НЯ были тошнота, диарея и головная боль4.
В рандомизированном двойном слепом плацебо-контролируемом многоцентровом исследовании фазы III CTRI/2021/06/033992 оценивалась эффективность и безопасность добавления молнупиравира к стандартному лечению коронавирусной инфекции COVID-19, протекающей в лёгкой форме5. Промежуточные данные этого исследования (n=353) были опубликованы 21 июля 2021 г.
В группе молнупиравира была 1 госпитализация по сравнению с 3 в группе плацебо, и 6,5 % пациентов в группе молнупиравира имели нежелательные явления по сравнению с 8,9 % в группе плацебо. Серьёзные неблагоприятные события были зарегистрированы у 1 субъекта в группе молнупиравира по сравнению с 3 в группе плацебо. В табл. 5 представлены опубликованные, неопубликованные (промежуточные результаты), остановленные и продолжающиеся исследования применения молнупиравира при COVID-19 [17].
Таблица 5
Обзор опубликованных и неопубликованных (промежуточные результаты) (А), остановленных (B) и продолжающихся (C) исследований безопасности и эффективности молнупиравира при COVID-19 [17]
Table 5
Overview of published and unpublished (interim results) (A), stopped (B) and ongoing (C) trials on the safety and efficacy of molnupiravir in COVID-19 [17]
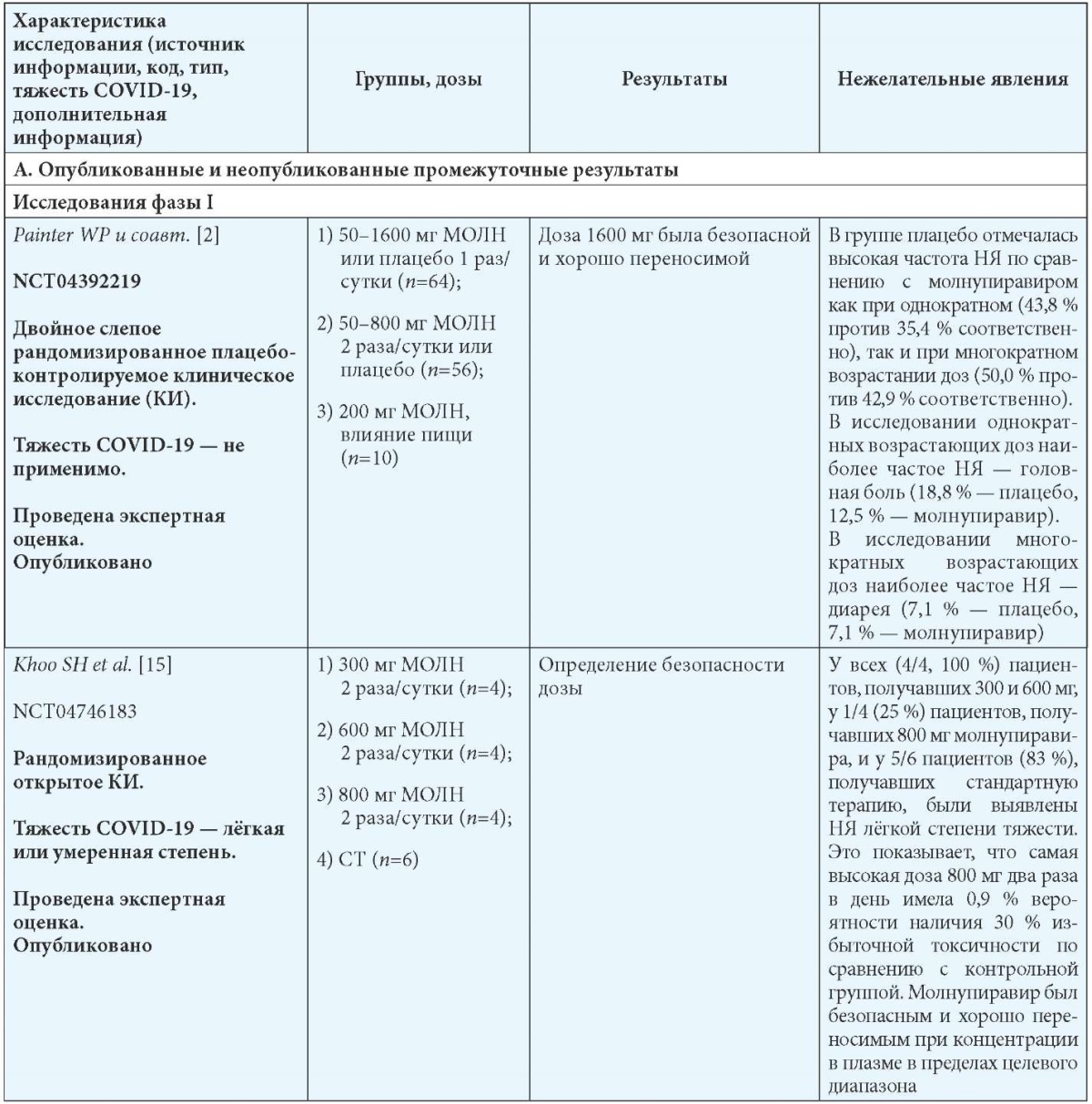

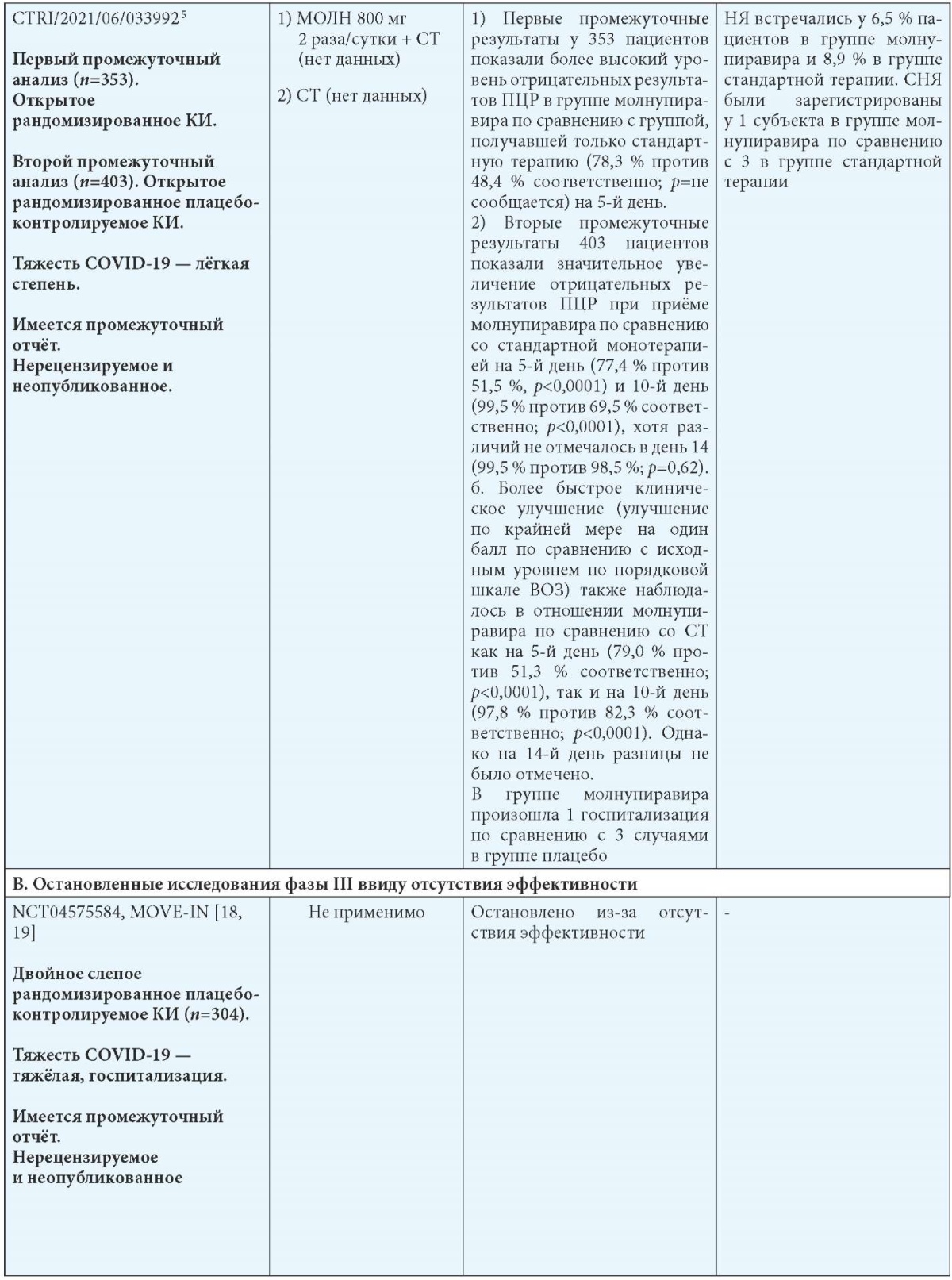
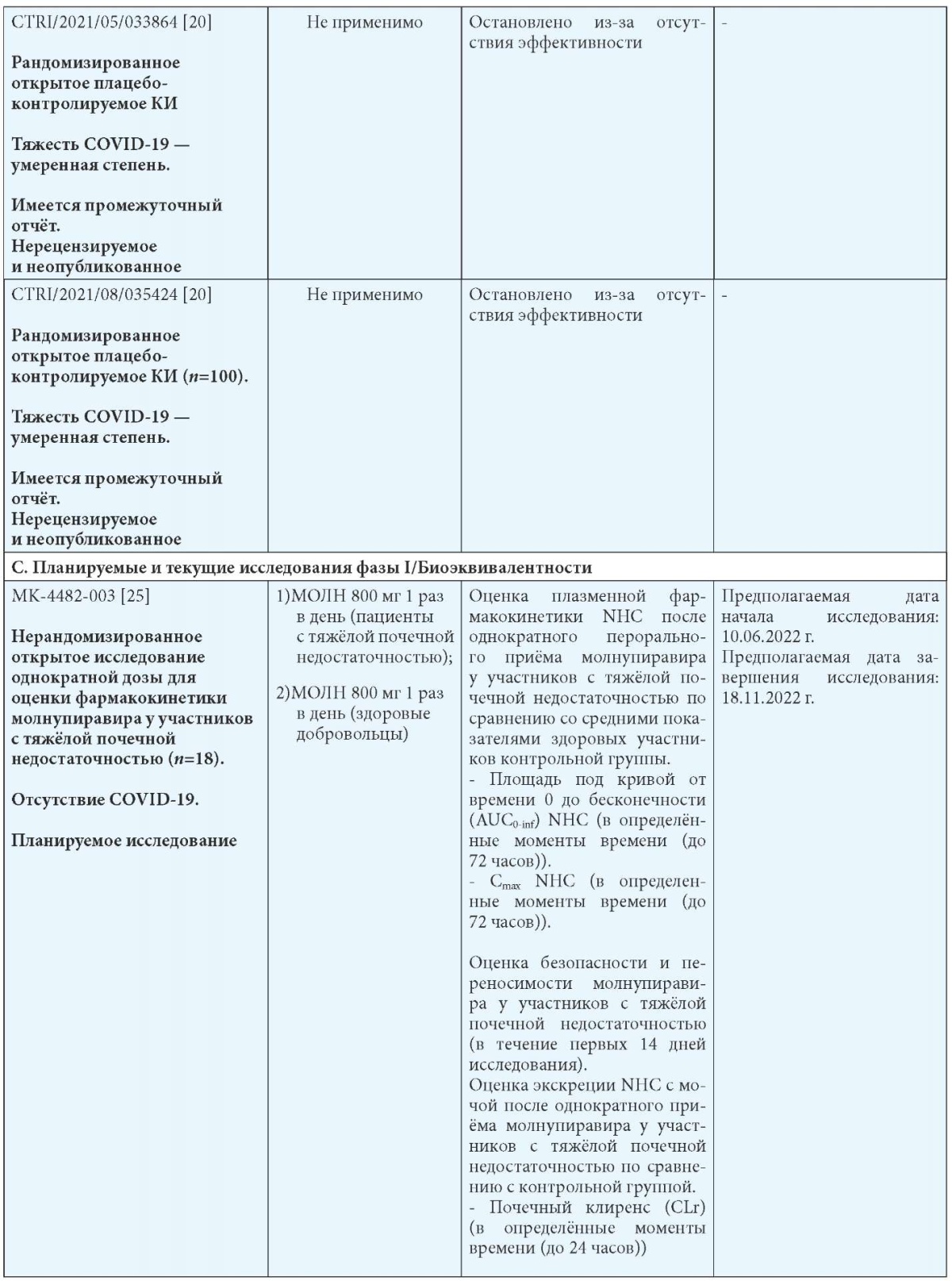
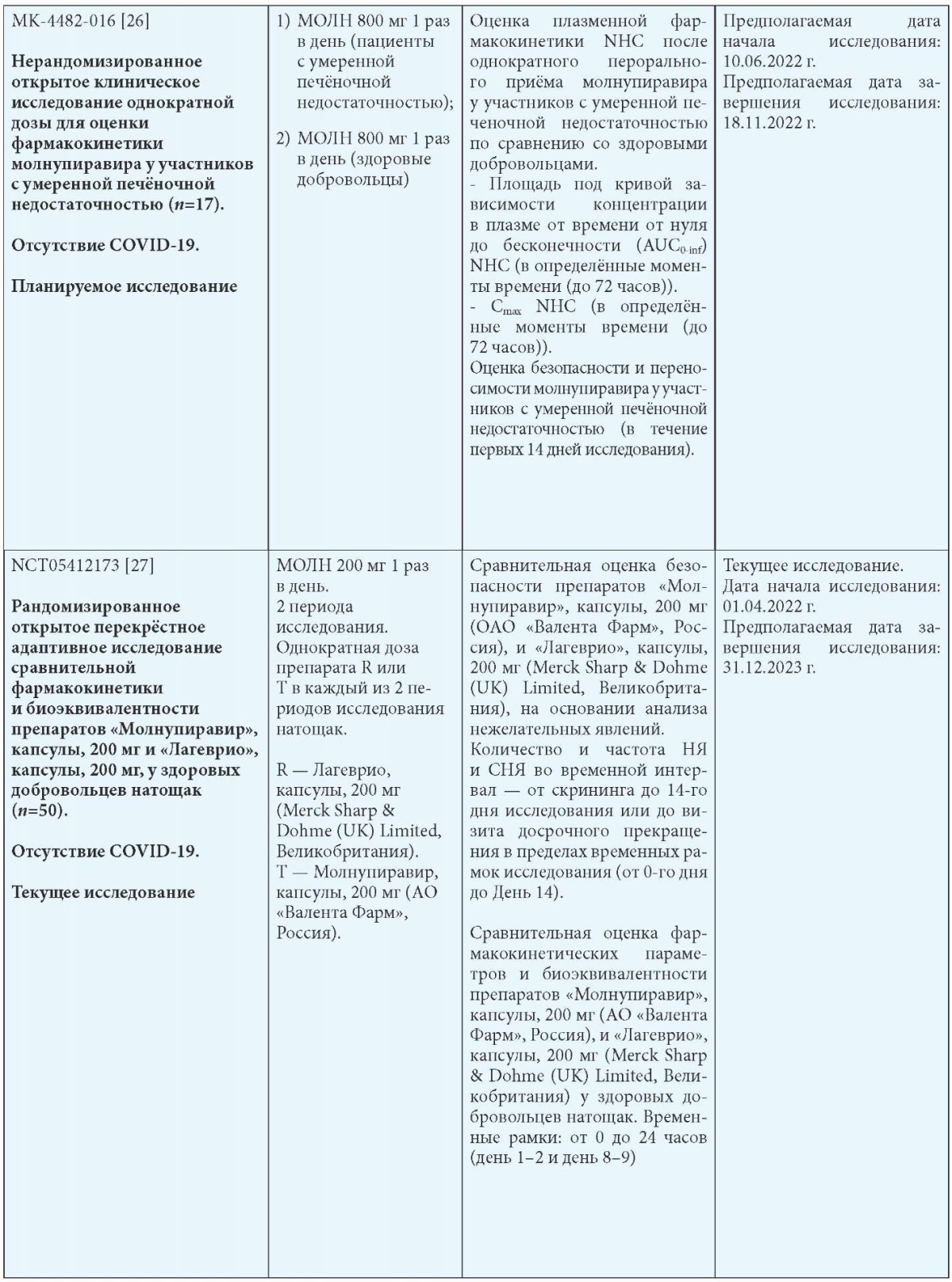
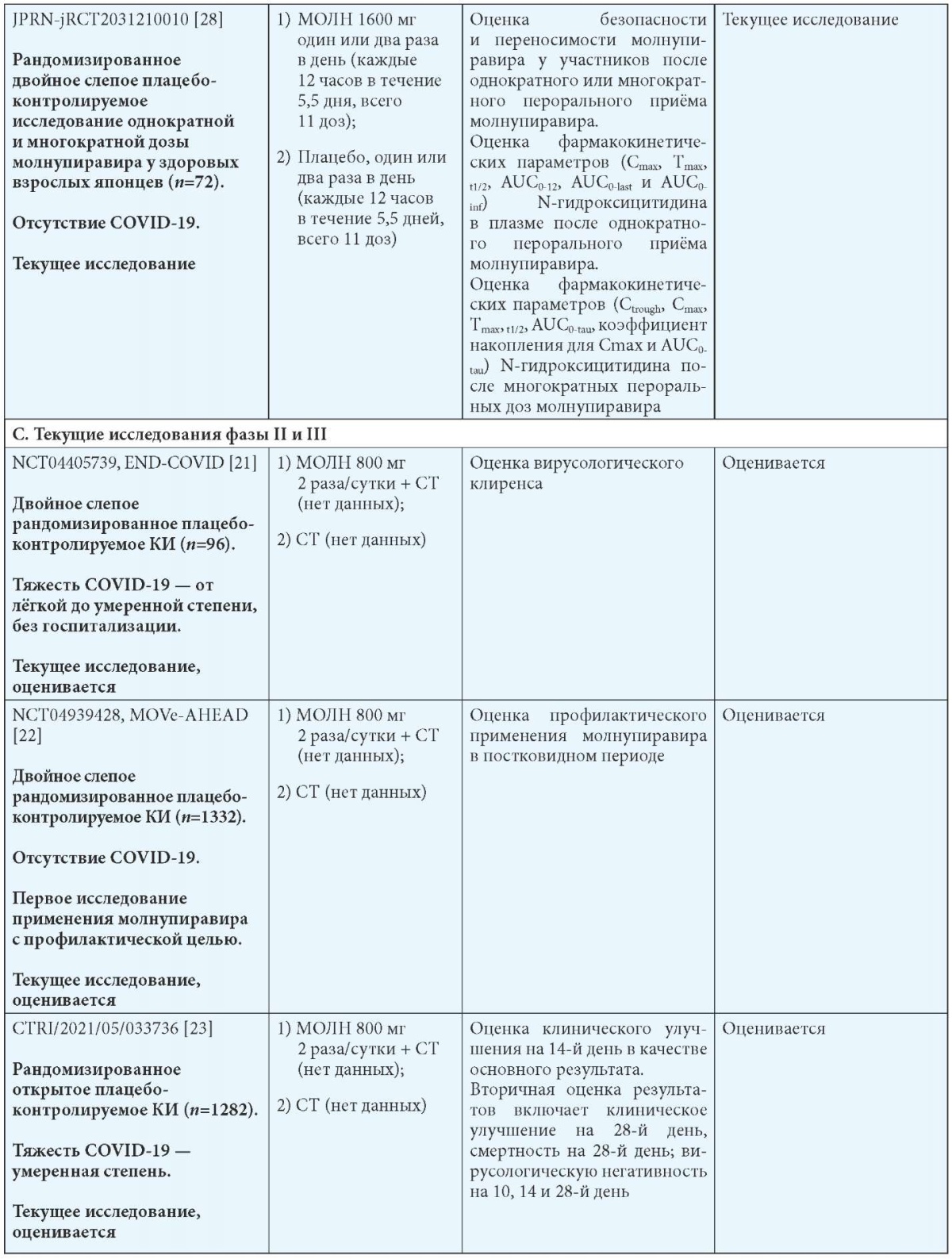
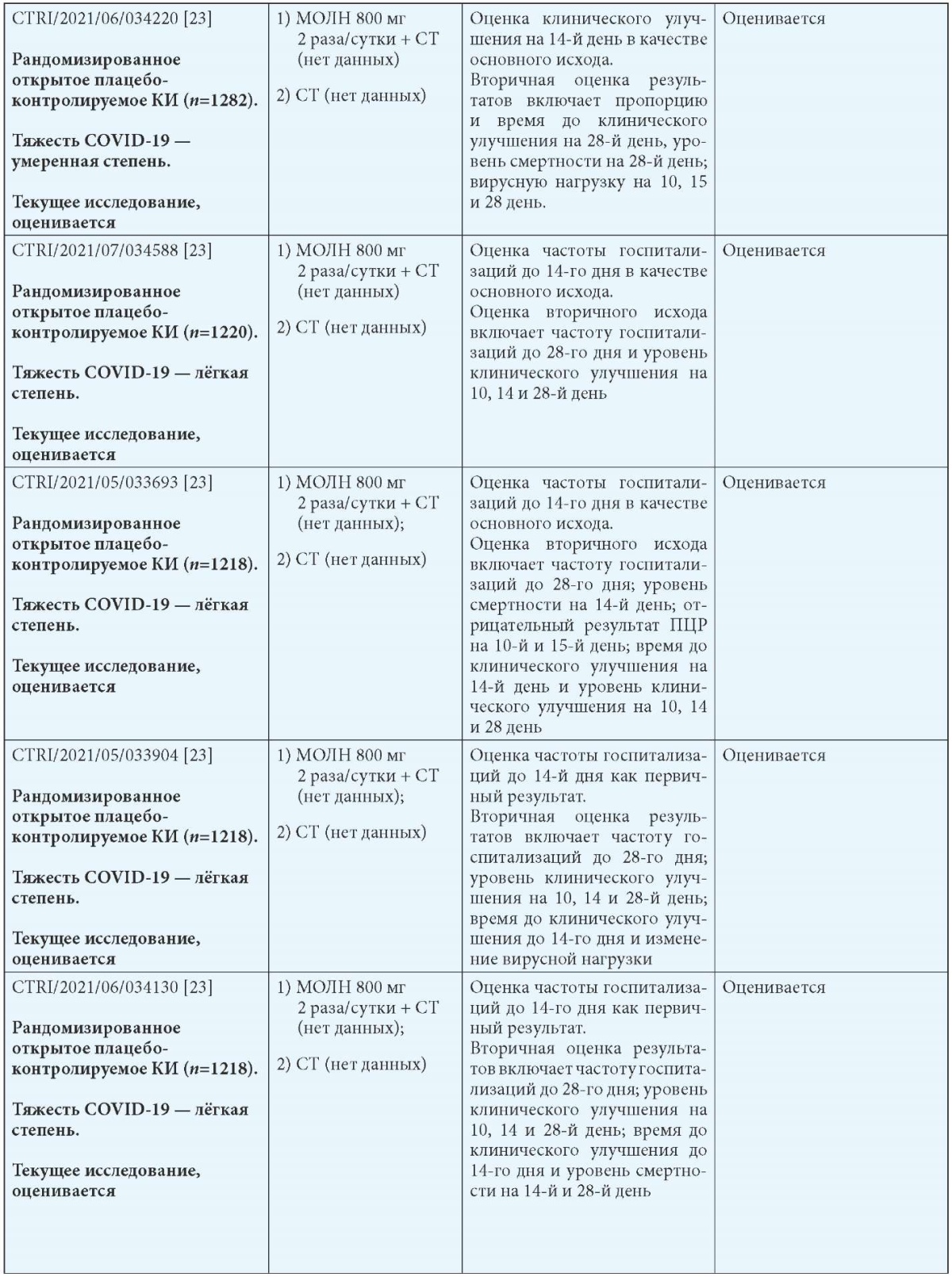
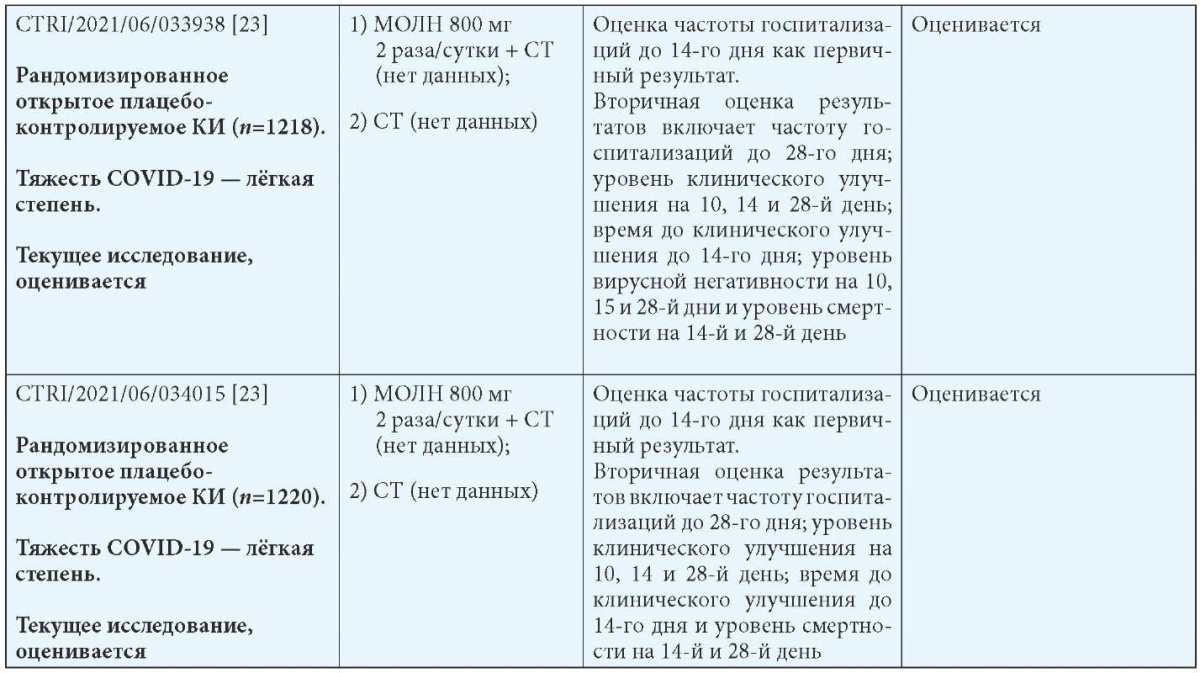
Примечания: МОЛН — молнупиравир; СТ — стандартная терапия; b Госпитализация определяется как госпитализация на срок более 24 часов с ЧДД 24 в минуту и SpO2 93 %.
Notes: МОЛН — molnupiravir; CT — standard therapy; b Hospitalization is defined as hospitalization for a period of more than 24 hours with a BPD of 24 per minute and SpO2 of 93 %.
Заключение / Conclusion
Результаты проведённых исследований демонстрируют безопасность, переносимость и противовирусную эффективность молнупиравира в отношении COVID-19 [24].
Механизм эффективности препарата, по-видимому, обусловлен снижением уровня носоглоточного инфекционного вируса SARS-CoV-2 и вирусной РНК [5].
Согласно имеющимся данным, молнупиравир хорошо переносится и признан безопасным без каких-либо серьёзных побочных эффектов в клинических испытаниях фаз I, II и III в краткосрочной перспективе. Применение молнупиравира при COVID-19 лёгкой или умеренной (SpO2 > 93 %) степени тяжести в течение 5 дней после появления симптомов значительно снижает прогрессирование заболевания за счёт сокращения госпитализаций и/или частоты летальных исходов. Безусловно, чтобы в полной мере говорить о безопасности препарата, необходимо сформировать достаточный банк данных безопасности молнупиравира в эпоху пандемии COVID-19. Необходимо дождаться результатов текущих исследований профилактического использования молнупиравира у пациентов в постковидном периоде, а также безопасности его назначения при лёгкой и средней степени тяжести COVID-19 в виде частоты госпитализаций.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
ADDITIONAL INFORMATION
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов, требующего раскрытия в данной статье.
Conflict of interests. Authors declare no conflict of interest requiring disclosure in this article.
Благодарности. Работа выполнялась без спонсорской поддержки.
Acknowledgments. The work was carried out without sponsorship.
Участие авторов. Хохлов А. Л. — анализ и интерпретация результатов работы, критический пересмотр содержания текста рукописи, участие в редактировании текста рукописи; Рыбачкова Ю. В. — сбор данных литературы, написание текста статьи, работа с источниками литературы, анализ данных.
Participation of authors. Khokhlov AL — analysis and interpretation of the study results, revision of the contents of the paper, participation in the editing of the paper; Rybachkova JV — compilation of data, writing of the paper, literature review, data analysis.
1. Weekly epidemiological update on COVID-19 — 25 May 2021. WHO; 2021. https://www.who.int/publications/m/item/weekly-epidemiological-update-oncovid19---25-may-2021.
2. World Health Organisation [accessed on 25 February 2022]. Available online: https://covid19.who.int.
3. Staff. Molnupiravir COVID-19 Oral Antiviral. www.precisionvaccinations.com. February 25, 2022. https://www.precisionvaccinations.com/vaccines/molnupiravir-antiviral.
4. Press_Release_Molnupiravir_Interim_Clinical_Results_Final_090721.pdf (heteroworld.com). (Last accessed on October 20, 2021.)
5. Optimus announces interim clinical results from phase III clinical trials of molnupiravir conducted in India. ThePrint. (Last accessed on October 20, 2021.)
Список литературы
1. Painter GR, Natchus MG, Cohen O, Holman W, Painter WP. Developing a direct acting, orally available antiviral agent in a pandemic: The evolution of molnupiravir as a potential treatment for COVID-19. Curr Opin Virol. 2021;50:17–22. doi: 10.1016/j.coviro.2021.06.003
2. Painter WP, Holman W, Bush JA, et al. Human Safety, Tolerability, and Pharmacokinetics of Molnupiravir, a Novel Broad-Spectrum Oral Antiviral Agent with Activity Against SARS-CoV-2. Antimicrob Agents Chemother. 2021;65(5):e02428–20. doi: 10.1128/AAC.02428-20
3. Toots M, Yoon J-J, Cox RM, Hart M, Sticher ZM, Makhsous N, Plesker R, Barrena AH, Reddy PG, Mitchell DG, Shean RC, Bluemling GR, Kolykhalov AA, Greninger AL, Natchus MG, Painter GR, Plemper RK. 2019. Characterization of orally efficacious influenza drug with high resistance barrier in ferrets and human airway epithelia. Sci Transl Med. 11:eaax5866. doi:10.1126/scitranslmed.aax5866 [PMC free article] [PubMed] [CrossRef] [Google Scholar].
4. Brian Buntz. Early safety concerns accompanied Merck’s molnupiravir, the first potential oral COVID-19 therapy. Drug Discovery and Development. October 4, 2021. https://www.drugdiscoverytrends.com/early-safety-concerns-accompanied-mercks-molnupiravir-the-first-potential-oral-covid-19-therapy.
5. Fischer W, Eron JJ, Holman W, Cohen MS, Fang L, Szewczyk LJ, Sheahan TP, Baric R, Mollan KR, Wolfe CR, Duke ER, Azizad MM, Borroto-Esoda K, Wohl DA, Loftis AJ, Alabanza P, Lipansky F, Painter WP. Molnupiravir, an Oral Antiviral Treatment for COVID-19. medRxiv [Preprint]. 2021 Jun 17:2021.06.17.21258639. doi: 10.1101/2021.06.17.21258639
6. Jayk Bernal A, Gomes da Silva MM, Musungaie DB, Kovalchuk E, Gonzalez A, Delos Reyes V, Martín-Quirós A, Caraco Y, Williams- Diaz A, Brown ML, Du J, Pedley A, Assaid C, Strizki J, Grobler JA, Shamsuddin HH, Tipping R, Wan H, Paschke A, Butterton JR, Johnson MG, De Anda C; MOVe-OUT Study Group. Molnupiravir for Oral Treatment of Covid-19 in Nonhospitalized Patients. N Engl J Med. 2021 Dec 16:NEJMoa2116044. doi: 10.1056/NEJMoa2116044. Epub ahead of print.
7. Efficacy and safety of molnupiravir (MK-4482) in non-hospitalized adult participants with COVID-19 (MK-4482-002) — full text view. ClinicalTrials.gov. (Last accessed on October 20, 2021).
8. Mahase E. Covid-19: molnupiravir reduces risk of hospital admission or death by 50% in patients at risk, MSD reports. BMJ. 2021 Oct 4;375:n2422. doi: 10.1136/bmj.n2422
9. Merck and Ridgeback's investigational oral antiviral molnupiravir reduced the risk of hospitalization or death by approximately 50 percent compared to placebo for patients with mild or moderate covid-19 in positive interim analysis of phase 3 study. Oct 2021. https://www.merck.com/news/merckand-ridgebacks-investigational-oral-antiviral-molnupiravir-reducedthe-riskof-hospitalization-or-death-by-approximately-50-percent-comparedto-placebo-for-patients-with-mild-or-moderat. [Accessed 20 October 2021].
10. Stokes EK, Zambrano LD, Anderson KN, et al. Coronavirus disease 2019 case surveillance — United States, January 22 – May 30, 2020. MMWR Morb Mortal Wkly Rep. 2020 Jun 19;69(24):759–65. doi: 10.15585/mmwr.mm6924e2
11. Ko JY, Danielson ML, Town M, et al. Risk factors for coronavirus disease 2019 (COVID-19)–associated hospitalization: COVID-19–associated hospitalization surveillance network and behavioral risk factor surveillance system. Clin Infect Dis. 2021 Jun 1;72(11):e695–e703. doi: 10.1093/cid/ciaa1419
12. Kompaniyets L, Goodman AB, Belay B, et al. Body mass index and risk for COVID-19-related hospitalization, intensive care unit admission, invasive mechanical ventilation, and death — United States, March–December 2020. MMWR Morb Mortal Wkly Rep 2021;70:355-61.
13. Rosenberg ES, Holtgrave DR, Dorabawila V, et al. New COVID-19 cases and hospitalizations among adults, by vaccination status — New York, May 3 – July 25, 2021. MMWR Morb Mortal Wkly Rep. 2021 Aug 27;70(34):1150–5. doi: 10.15585/mmwr.mm7034e1.
14. Arribas JR, Bhagani S, Lobo S, et al. Randomized trial of molnupiravir or placebo in patients hospitalized with Covid-19. NEJM Evid. doi: 10.1056/EVID oa2100044
15. Khoo SH, Fitzgerald R, Fletcher T, et al. Optimal dose and safety of molnupiravir in patients with early SARS-CoV-2: a phase I, open-label, dose-escalating, randomized controlled study. J Antimicrob Chemother. 2021 Nov 12;76(12):3286–95. doi: 10.1093/jac/dkab318
16. Caraco Y, Crofoot G, Moncada PA, et al. Phase 2/3 trial of molnupiravir for treatment of Covid-19 in nonhospitalized adults. NEJM Evid. doi: 10.1056/EVID oa2100043
17. Singh AK, Singh A, Singh R, Misra A. Molnupiravir in COVID-19: A systematic review of literature. Diabetes Metab Syndr. 2021 Nov- Dec;15(6):102329. doi: 10.1016/j.dsx.2021.102329
18. Efficacy and safety of molnupiravir (MK-4482) in hospitalized adult participants with COVID-19 (MK-4482-001) — full text view. ClinicalTrials. gov. (Last accessed on October 20, 2021).
19. Merck and Ridgeback biotherapeutics provide update on progress of clinical development program for molnupiravir, an investigational oral therapeutic for the treatment of mild-to-moderate COVID-19. Merck.com. (Last accessed on October 20, 2021).
20. Two Indian drugmakers to end trials of generic Merck pill for moderate COVID-19. Reuters. (Last accessed on October 20, 2021).
21. The safety of molnupiravir (EIDD-2801) and its effect on viral shedding of SARS-CoV-2 (END-COVID) — full text view. ClinicalTrials.gov. (Last accessed on October 20, 2021).
Об авторах
А. Л. ХохловРоссия
Хохлов Александр Леонидович, академик РАН, д. м. н., профессор, и. о. ректора, зав. кафедрой фармакологии и клинической фармакологии
Ярославль
SPIN-код: 9389-8926
Ю. В. Рыбачкова
Россия
Рыбачкова Юлия Владимировна, к. м. н., ассистент кафедры фармакологии и клинической фармакологии
Ярославль
Рецензия
Для цитирования:
Хохлов А.Л., Рыбачкова Ю.В. Применение нового перорального противовирусного препарата молнупиравира в лечении COVID-19 с позиции безопасности. Качественная клиническая практика. 2022;(3):35-51. https://doi.org/10.37489/2588-0519-2022-3-35-51
For citation:
Khokhlov A.L., Rybachkova J.V. The use of a new oral antiviral drug molnupiravir in the treatment of COVID-19 from a safety perspective. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2022;(3):35-51. (In Russ.) https://doi.org/10.37489/2588-0519-2022-3-35-51
















































