Перейти к:
Нежелательные лекарственные реакции нестероидных противовоспалительных средств: данные национальной базы за 10 лет
https://doi.org/10.37489/2588-0519-2021-4-16-26
Аннотация
Группа нестероидных противовоспалительных средств за прошедшее десятилетие занимает одну из лидирующих позиций по уровню востребованности населением. Во многом это обусловлено безрецептурным отпуском представителей данной фармацевтической группы, широким спектром назначения и доступным ценовым диапазоном. Отсутствие должного контроля за применением данных лекарств значительно затрудняет оценку безопасности, своевременное выявление и профилактику событий, ассоциированных с безопасностью пациентов.
Цель. Оценка данных национальной базы фармаконадзора по вопросам безопасности нестероидных противовоспалительных препаратов.
Материалы и методы. Данное исследование представляет собой «cross-sectional study» за период 2010-2020 гг. Оценка профиля безопасности международных непатентованных наименований (МНН) из группы НПВС на пострегистрационном этапе осуществлялась по данным выгрузки национальной базы (Автоматизированной информационной системы Росздравнадзора; АИС РЗН), а также по базам данных PubMed, Medline, Google Scholar, Elibrary.
Выводы. За десятилетний период количество зарегистрированных спонтанных сообщений составило 8 334 сообщения. В отношении трёх международных непатентованных наименований количество нежелательных лекарственных реакций превалирует - это метамизол (1875 (22,5 %)), ацетилсалициловая кислота (1716 (20,6 %)), диклофенак (979 (11,7 %)). Основным системно-органным классом, в отношении которого описываются события, ассоциированные с вопросами безопасности, является кожа и подкожные структуры. Данный факт не согласуется с данными референтных источников информации, что говорит о неэффективности пострегистрационных наблюдений со стороны держателей регистрационных удостоверений.
Ключевые слова
Для цитирования:
Сыраева Г.И., Колбин А.С. Нежелательные лекарственные реакции нестероидных противовоспалительных средств: данные национальной базы за 10 лет. Качественная клиническая практика. 2021;(4):16-26. https://doi.org/10.37489/2588-0519-2021-4-16-26
For citation:
Syraeva G.I., Kolbin A.S. Nonsteroidal anti-inflammatory drugs’ adverse drug reactions: 10 years of national database data. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2021;(4):16-26. (In Russ.) https://doi.org/10.37489/2588-0519-2021-4-16-26
Введение / Introduction
Большинство пациентов, принимающих нестероидные противовоспалительные средства (НПВС), обычно хорошо их переносят. Однако в случае более длительного лечения и при наличии у пациента сопутствующей патологии и отягощающих факторов (например, пожилой возраст, снижение функции экскреторных органов, декомпенсация сопутствующих состояний и пр.) риск возникновения нежелательной лекарственной реакции (НЛР) может значительно повышаться. По данным литературы, наиболее значимыми НЛР являются изменения со стороны желудочно-кишечного тракта, сердечнососудистой и почечной систем [1]. Мониторинг нежелательных реакций НПВС является актуальной проблемой и в силу их безрецептурного отпуска, низкой информированности населения, равно как и медицинских работников, о возможности развития серьёзных НЛР. Отсутствие должного контроля за применением НПВС значительно затрудняет оценку безопасности, своевременное выявление и профилактику возникновения НЛР [2].
Цель / Aim
Оценка данных национальной базы фармаконадзора по вопросам безопасности нестероидных противовоспалительных препаратов.
Задачи / Tasks:
1. Обзор существующих данных российской национальной базы по применению НПВС.
2. Анализ и выявление тех представителей нестероидных противовоспалительных средств, в отношении которых сведения передаются в национальную базу наиболее часто.
3. Сравнение данных по безопасности наиболее часто применяемых представителей группы нестероидных противовоспалительных средств на пост регистрационном этапе по данным открытых литературных источников и национальной базы Российской Федерации.
Материалы и методы / Materials and methods
Данное исследование представляет собой «crosssectional study» за период 2010–2020 гг. Оценка профиля безопасности международных непатентованных наименований (МНН) из группы НПВС на пострегистрационном этапе осуществлялась по данным выгрузки национальной базы (Автоматизированной информационной системы Росздравнадзора; АИС РЗН), а также по базам данных PubMed, Medline, Google Scholar, Elibrary.
На пострегистрационном этапе в мировой практике фармаконадзора внедрён и активно применяется метод сбора информации о безопасности ЛС посредством формирования и отправки в регуляторный орган спонтанного сообщения (СС). В соответствии с законодательными требованиями, информирование системы здравоохранения происходит путём предоставления СС в соответствующую структуру национальной системы фармаконадзора [3]. Внесение информации в АИС РЗН осуществляется на основании Федерального закона от 12.04.2010 г. № 61-ФЗ (ред. от 03.04.2020 г.) «Об обращении лекарственных средств», статья 64 «Фармаконадзор» [4]. Для всесторонней оценки события, связанного с развитием НЛР, в общемировой и российской практике формируются карты извещения, в которых репортёр (лицо, предоставляющее сведения в АИС РЗН) предоставляет определенный объём информации — информацию о пациенте, подозреваемом лекарственном средстве (ЛС), нежелательном явлении/реакции и лице, сообщившем о событии, также учитывается наличие и/или отсутствие критерия(ев) серьёзности и ожидаемость (предвиденность) события. Кроме того, указываются МНН, торговое наименование (ТН) ЛС, которое вызвало НЛР, его дозировка, даты начала и окончания, степень достоверности причинно-следственной связи события с применением лекарственного препарата, вносятся данные о сопутствующей терапии, пробы с повторным назначением (rechallenge) и отменой подозреваемого лекарственного средства (если применимо) [5].
Кодирование НЛР в Автоматизированной информационной системе Росздравнадзора (АИС РЗН) с апреля 2019 года происходит с использованием классификатора MedDRA версия 23.0 (Medical Dictionary for Drug Regulatory Aff airs v. 23.0).
Результаты / Results
За период с 2010 по 2020 г. из национальной базы было выгружено 8334 сообщения. Каждое сообщение, выгруженное из АИС РЗН, было проверено на предмет валидности, а именно на наличие определённого объёма информации, необходимого для дальнейшего анализа. Затем были определены основные МНН из группы НПВС, по которым в АИС РЗН была предоставлена информация. Алгоритм работы с сообщениями представлен на рис. 1.
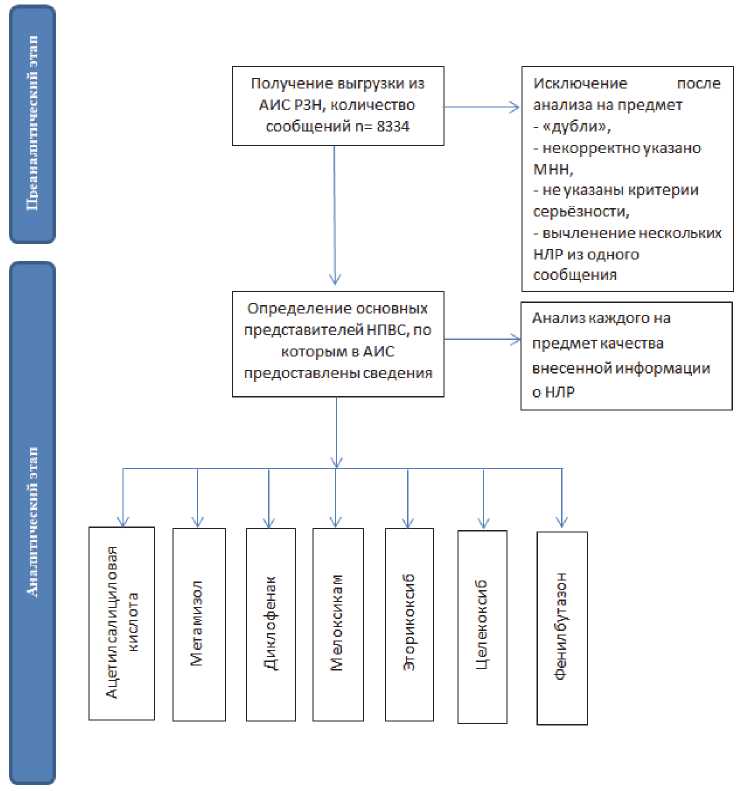
Рис. 1. Блок-схема с описанием ступеней анализа при работе с сообщениями из Автоматизированной информационной системы Росздравнадзора
Fig. 1. Flowchart describing the stages of analysis spontaneous messages from the Automated Information System of Roszdravnadzor
Примечание: АИС РЗН — Автоматизированная информационная система Росздравнадзора.
Note: АИС РЗН — AIS RZN — Automated Information System of Roszdravnadzor.
Как видно из данных, представленных на рис. 1, определены семь основных МНН, по которым предоставляются сведения. При ранжировании количества сообщений в отношении конкретного МНН распределение было следующим: 1) первое место приходилось на ацетилсалициловую кислоту (АСК) — количество предоставленных сообщений в АИС РЗН составило 3862 сообщения (46 %); 2) на втором месте — метамизол, 1925 сообщений (23 %); 3) далее по количеству сообщений располагались: диклофенак, 1392 (17 %); 4) мелоксикам — 715 (9 %); 5) эторикоксиб — 280 сообщений (3 %); 6) целекоксиб — 142 сообщения (1,7 %); 7) фенилбутазон — 18 сообщений (0,3 %). Соответственно, лидирующие позиции по частоте репортирования занимали три МНН: АСК, метамизол и диклофенак.
При работе с сообщениями информация была проанализирована на предмет дублирования, а также корректности предоставления данных (в одном сообщении могло быть закодировано более одного события, либо могло быть предоставлено несколько последующих сообщений типа «follow-up»), ввиду чего итоговое количество НЛР было меньше. По частоте валидных событий, зарегистрированных в АИС РЗН, первое место занимал метамизол — итоговое количество сообщений для данного ЛС составило 1875 (при наличии follow-up в анализ включалось только последнее).
Характеристика популяции, в отношении которой зарегистрированы НЛР, представлена на рис. 2.
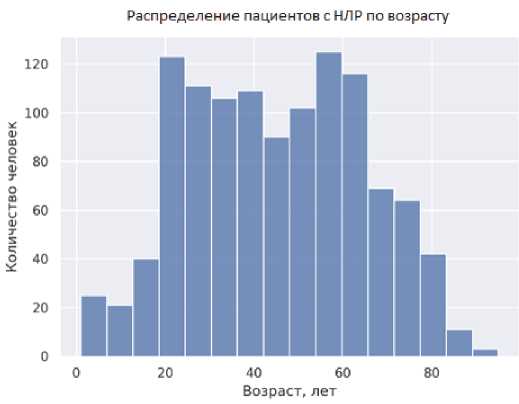
Рис. 2. Демографические характеристики пациентов, получавших метамизол в период с 2010 по 2020 г., по данным, полученным из Автоматизированной информационной системы Росздравнадзора
Fig. 2. Demographic characteristics of patients treated with metamizole between 2010 and 2020 according to data from the Automated Information System of Roszdravnadzor
Примечание: АИС РЗН — Автоматизированная информационная система Росздравнадзора.
Note: AIS RZN — Automated information system of Roszdravnadzor.
Как видно из данных, представленных на рис. 2, распределение по полу было следующим: количество женщин превалировало — 771 человек (65,7 %), количество мужчин — 391 человек (33,3 %), в 11 (0,9 %) сообщениях пол не был указан.
При работе с сообщениями синонимичные события были объединены в общий термин самого нижнего уровня (LLT — Lowest Level Term), который по дереву решений, предлагаемому программой, укладывался в преимущественный термин (PT — Preferred Term), который, в свою очередь, и определял системно-органный класс (SOC — System organ class) НЛР. Анализ полученной выгрузки позволил выделить наиболее часто встречающиеся события для метамизола, ассоциированные с вопросами безопасности, которые подробно представлены на рис. 3.
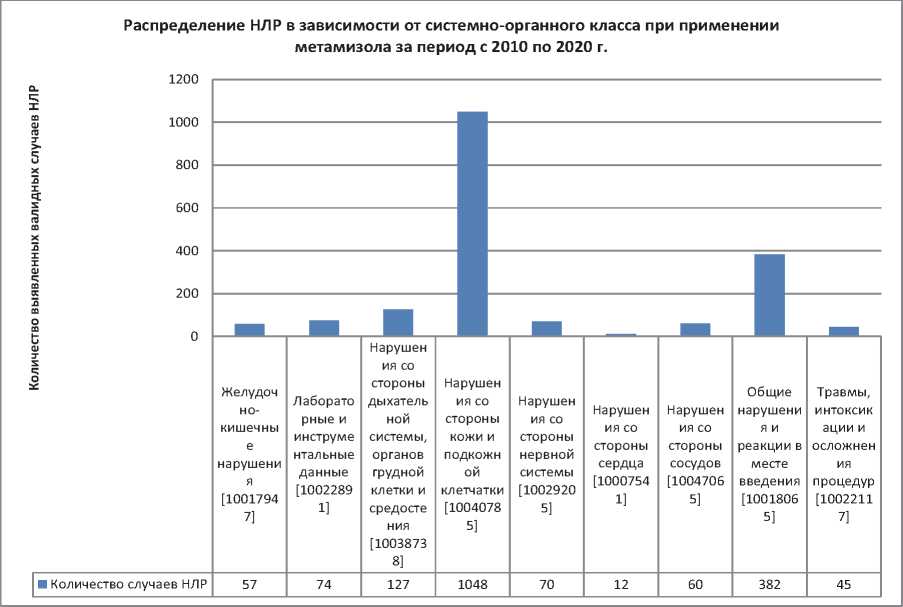
Рис. 3. Распределение НЛР в зависимости от системно-органного класса при применении метамизола за период с 2010 по 2020 г.
Fig. 3. Distribution of ADRs depending on the systemic organ class in the use of metamizole for the period from 2010 till 2020
Примечание: НЛР — нежелательная лекарственная реакция.
Note: НЛР — ADR — adverse drug reaction.
Как видно из данных, представленных на рис. 3, частота встречаемости зарегистрированных НЛР следующая: 1) ассоциированы с поражением кожи и подкожной клетчатки — 1048 сообщений; 2) общие нарушения и реакции в месте введения — 382; 3) нарушения со стороны дыхательной системы, органов грудной клетки и средостения — 127; 4) лабораторные и инструментальные данные — 74; 5) нарушения со стороны сосудов — 60; 6) нарушения со стороны нервной системы — 60; 7) желудочно-кишечные нарушения — 57; 8) травмы, интоксикации и осложнения процедур — 45; 9) нарушения со стороны сердца — 12.
Распределение описанных НЛР для МНН: метамизол по исходам представлено на рис. 4.
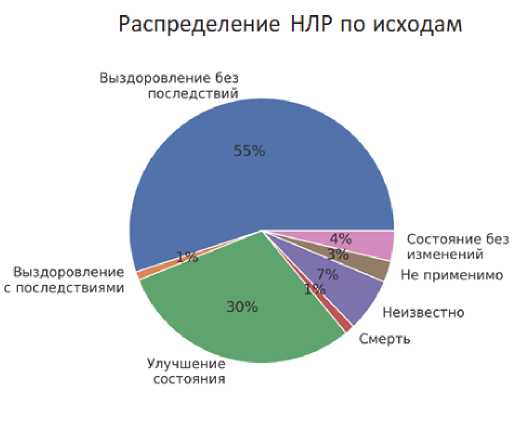
Рис. 4. Исходы НЛР при применении метамизола, по данным Автоматизированной информационной системы Росздравнадзора за период 2010–2020 гг.
Fig. 4. ADR outcomes in case of using metamizole according to the Automated Information System of Roszdravnadzor for the period 2010–2020
Примечания: НЛР — нежелательная лекарственная реакция; АИС РЗН — автоматизированная информационная система Росздравнадзора.
Notes: НЛР — ADR — adverse drug reaction, AIS RZN — Automated information system of Roszdravnadzor.
Как видно из данных, представленных на рис. 4, исход был указан в 1167 (99,5 %) случаях. Выздоровление без последствий отмечено у 639 пациентов (55,0 %), улучшение состояния — у 347 человек (29,9 %), исход не известен у 76 пациентов (6,5 %), состояние без изменений зарегистрировано у 43 человек (3,7 %), летальный исход отмечен у 14 человек (1,2 %), выздоровление с последствиями — у 12 человек (1,0 %), и исход отмечен как «не применимо» у 30 пациентов (2,6 %).
НЛР, для которых применим критерий серьёзности «летальный исход», были ассоциированы со следующими событиями: «Шок анафилактический», «Гранулоцитопения тяжёлая» и «Реакция анафилактоидная».
Итоговое количество сообщений для МНН: АСК составило 1716 (при наличии follow-up в анализ включалось только последнее).
Характеристика популяции, которая принимала в качестве подозреваемого лекарства АСК, проанализирована за 10-летний период и представлена на рис. 5.
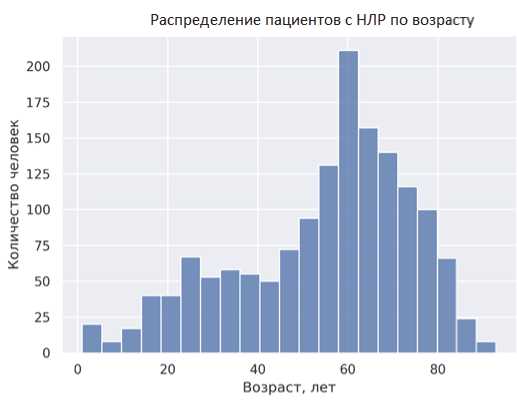
Рис. 5. Демографические характеристики пациентов, получавших АСК в период с 2010 по 2020 г., по данным, полученным из Автоматизированной информационной системы Росздравнадзора
Fig. 5. Demographic characteristics of patients treated with acetylsalicylic acid from 2010 till 2020 according to data obtained from the Automated Information System of Roszdravnadzor
Примечания: АИС РЗН — автоматизированная информационная система Росздравнадзора; АСК — ацетилсалициловая кислота.
Notes: AIS RZN — Automated information system of Roszdravnadzor; АСК — ASA — acetylsalicylic acid.
Как видно из данных, представленных на рис. 5, максимальный возраст составил 93 года, минимальный возраст 1 год, медиана — 59 лет (интерквартильная широта — от 43 до 69 лет). Распределение по полу было следующим: женщины — 929 (54,5 %); мужчины — 759 (44,5 %); пол не указан в 18 случаях (1,1 %). Системный анализ наиболее часто встречающихся НЛР позволил выделить следующие системно-органные классы (рис. 6).
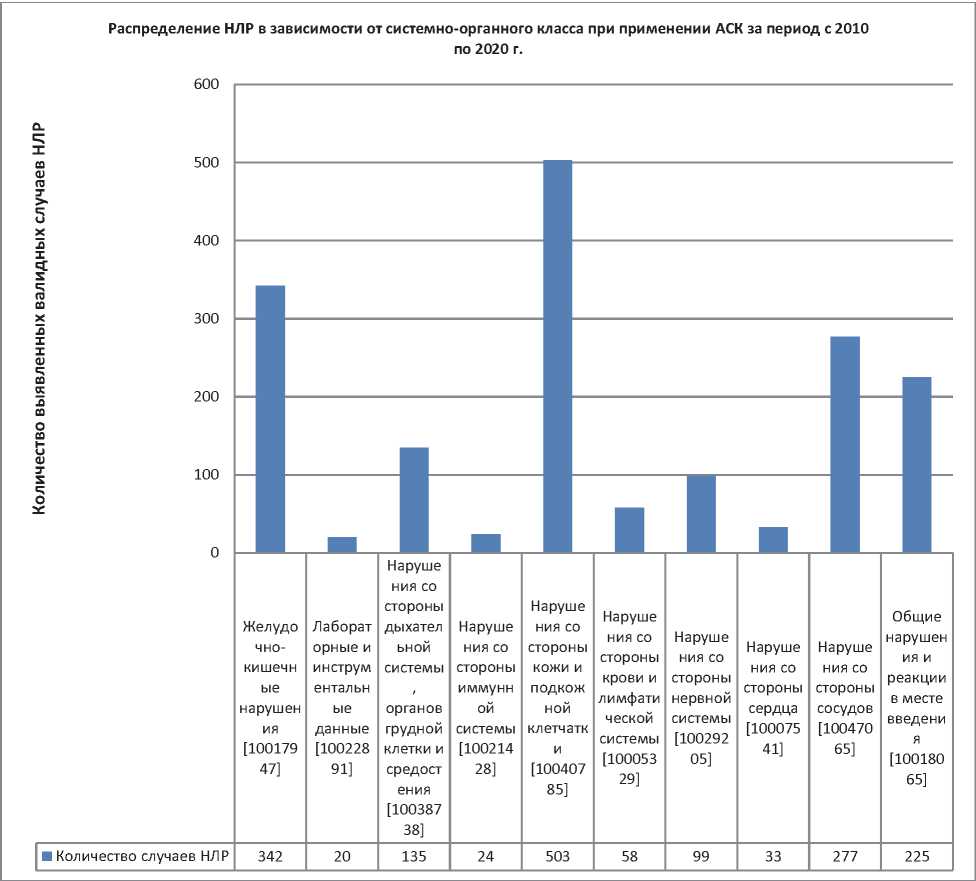
Рис. 6. Распределение НЛР в зависимости от системно-органного класса при применении АСК за период с 2010 по 2020 г.
Fig. 6. Distribution of ADRs depending on the systemic organ class in the use of ASA for the period from 2010 till 2020
Примечания: АСК — ацетилсалициловая кислота; НЛР — нежелательная лекарственная реакция.
Notes: АСК — ASA — acetylsalicylic acid; НЛР — ADR — adverse drug reaction.
Как видно из данных, представленных на рис. 6, частота встречаемости зарегистрированных НЛР следующая: 1) ассоциированы с поражением кожи и подкожной клетчатки — 503 сообщения; 2) ЖКТ — 342 сообщения; 3) нарушения со стороны сосудов зарегистрированы в 278 случаях; 4) общие реакции и нарушения в месте введения — 225 НЛР; 5) поражения дыхательной системы отмечены в 135 случаях; 6) поражения нервной системы — 99 сообщений; 7) кровь и лимфатическая система — 58 сообщений; 8) нарушения со стороны сердечно-сосудистой системы — 33 сообщения; 9) ассоциированные с поражением иммунной системы — 24 НЛР; 10) реакции лабораторные и инструментальные нарушения — 20 событий.
Распределение описанных НЛР для МНН: АСК по исходам представлено на рисунке 7.
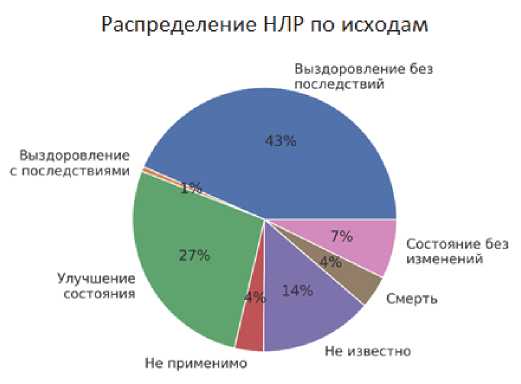
Рис. 7. Исходы НЛР при применении АСК, по данным Автоматизированной информационной системы Росздравнадзора за период 2010–2020 гг.
Fig. 7. ADR outcomes in case of using ASA according to the Automated Information System of Roszdravnadzor for the period 2010–2020
Примечания: НЛР — нежелательная лекарственная реакция; АСК — ацетилсалициловая кислота; АИС РЗН — автоматизированная информационная система Росздравнадзора.
Notes: НЛР — ADR — adverse drug reaction; АСК — ASA — acetylsalicylic acid; AIS RZN — Automated information system of Roszdravnadzor.
Как видно из данных, представленных на рис. 7, исход был указан в 1664 (97,5 %) случаях. Выздоровление без последствий отмечено у 723 человек (43,4 %), улучшение состояния отмечено у 454 человек (27,3 %), исход не известен у 230 человек (13,8 %), состояние без изменений зарегистрировано у 121 человека (7,3 %), летальный исход отмечен у 67 пациентов (4,0 %), выздоровление с последствиями — 10 человек (0,6 %), и исход отмечен как «не применимо» у 59 человек (3,5 %).
НЛР, для которых в качестве исхода указан «летальный исход», были ассоциированы со следующими событиями: «Инфаркт миокарда», «Кровотечение (неуточнённое)» и «Кровотечение из желудочно-кишечной язвы».
Следующее МНН по частоте регистрации НЛР (979) — диклофенак.
Характеристика популяции, в отношении которой зарегистрированы НЛР, представлена на рис. 8.
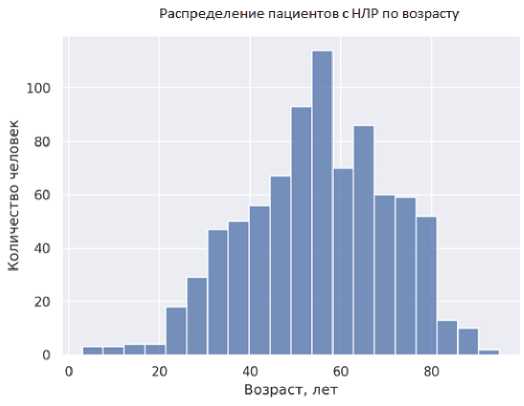
Рис. 8. Демографические характеристики пациентов, получавших диклофенак в период с 2010 по 2020 г., по данным, полученным из Автоматизированной информационной системы Росздравнадзора
Fig. 8. Demographic characteristics of patients treated with diclofenac between 2010 and 2020 according to data obtained from the Automated Information System of Roszdravnadzor
Примечание: АИС РЗН — автоматизированная информационная система Росздравнадзора.
Note: AIS RZN — Automated information system of Roszdravnadzor.
Как видно из данных, представленных на рис. 8, максимальный возраст составил 95 лет, минимальный возраст составил 3 года (медиана возраста — 55,5 года, интерквартильная широта — от 44 до 66 лет). Распределение по полу было следующим: количество женщин превалировало — 549 (60,7 %), количество мужчин — 340 (37,6 %), в 15 (1,7 %) сообщениях пол не указан. В общей сложности описано 979 различных проявлений НЛР. На рис. 9 представлены основные типы НЛР, а также их классификация по MedDRA.
Как видно из данных, представленных на рис. 9, классификатор MedDRA распределил зарегистрированные НЛР по 13 основным системно-органным классам, распределение по 4 основным из них оказалось следующим: 1) самое большое количество сообщений относится к нарушениям со стороны кожи и подкожно-жировой клетчатки — 682 сообщения; 2) на втором месте нарушения и реакции в местах введения — 119 НЛР; 3) желудочно-кишечные нарушения — 116 событий; 4) нарушения со стороны дыхательной системы, органов грудной клетки и средостения — 41 событие. Частота регистрации НЛР по другим органам и системам составляет менее 1 % и не является значимой.
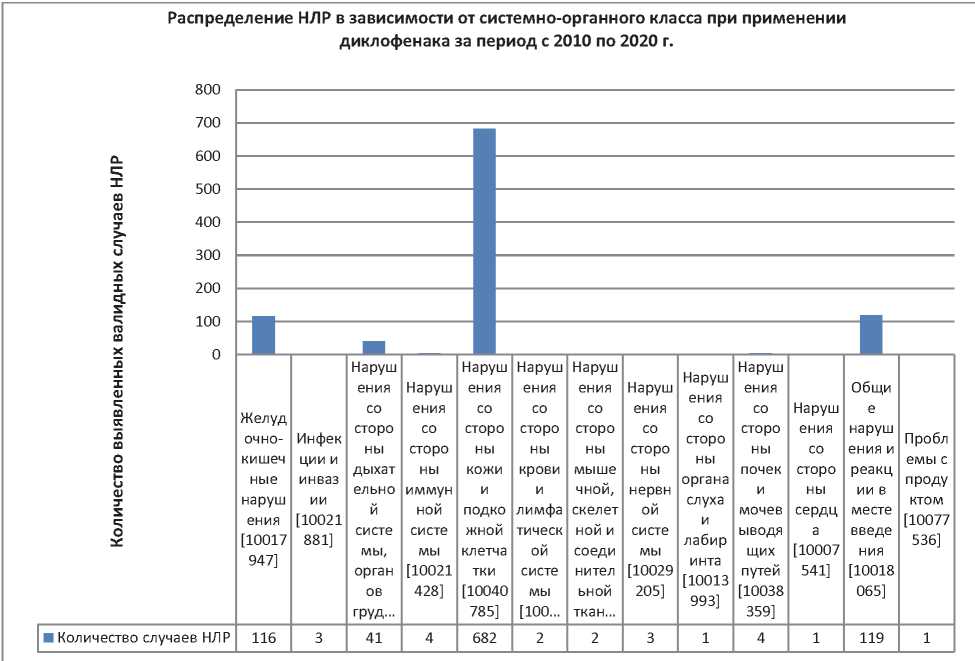
Рис. 9. Распределение НЛР в зависимости от системно-органного класса при применении диклофенака за период с 2010 по 2020 г.
Fig. 9. Distribution of ADRs depending on the systemic organ class in the use of diclofenac for the period from 2010 till 2020
Примечание: НЛР — нежелательная лекарственная реакция.
Note: НЛР — ADR — adverse drug reaction.
Распределение описанных НЛР для МНН: диклофенак по исходам представлено на рис. 10.
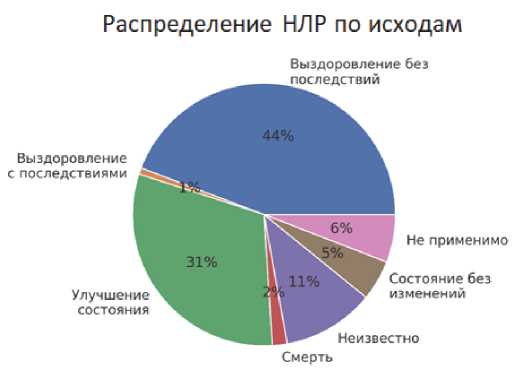
Рис. 10. Исходы НЛР при применении диклофенака, по данным Автоматизированной информационной системы Росздравнадзора за период 2010–2020 гг.
Fig. 10. ADR outcomes in case of using diclofenac according to the Automated Information System of Roszdravnadzor for the period 2010–2020
Примечания: НЛР — нежелательная лекарственная реакция; АИС РЗН — автоматизированная информационная система Росздравнадзора.
Notes: НЛР — ADR — adverse drug reaction; AIS RZN — Automated information system of Roszdravnadzor.
Как видно из данных, представленных на рис. 10, исход НЛР был указан в 884 (97,9 %) случаях. Выздоровление без последствий было отмечено у 391 пациента (43,3 %), улучшение состояния — в 274 случаях (30,3 %), исход не известен — у 100 человек (11,1 %), состояние без изменений зарегистрировано у 44 пациентов (4,9 %), летальный исход — у 16 человек (1,8 %), выздоровление с последствиями — у 7 человек (0,8 %), и исход отмечен как «не применимо» в 52 случаях (5,8 %).
НЛР, для которых в качестве исхода указан летальный исход, были ассоциированы со следующими событиями: «Шок анафилактический», «Гепатотоксический эффект, недостаточность почечная», «Некролиз эпидермальный токсичный», «Нефрит интерстициальный, недостаточность почечная острая».
Обсуждение полученных результатов / Discussion of the results obtained
В соответствии с проведённым анализом, группа НПВС за прошедшее десятилетие занимает одну из лидирующих позиций по уровню потребления населением [6]. Во многом это обусловлено безрецептурным отпуском представителей данной фармацевтической группы, широким спектром назначения и доступным ценовым диапазоном.
Несмотря на это, за десятилетний период в АИС РЗН выгружено всего 8334 сообщения, что не достигает необходимого минимума репортирования, рекомендуемого Всемирной организацией здравоохранения [7]. Для сравнения, открытая база данных FAERS США (FDA Adverse Event Reporting System) за аналогичный период времени для 3 рассмотренных МНН содержит суммарно 28 872 сообщения [8], что значительно превышает показатели репортирования в РФ, почти в 4 раза.
Несмотря на то что НПВС считают в целом безопасными лекарствами, для них возможен такой серьёзный исход НЛР, как смерть. По данным анализа национальной системы фармаконадзора, для трёх МНН, в отношении которых зафиксировано самое большое количество спонтанных сообщений, летальные исходы зарегистрированы со следующей частотой. Для ацетилсалициловой кислоты у 67 пациентов (0,8 %), для метамизола — 14 человек (0,17 %), для диклофенака — 16 человек (0,19 %). Также следует отметить тот факт, что средний возраст пациентов, для которых зарегистрированы НЛР с летальным исходом, укладывается в диапазон трудоспособного населения (интерквартильная широта — от 44 до 66 лет).
Данные, полученные из национальной базы, свидетельствуют о том, что НЛР отличались от тех, которые фигурируют в открытых литературных источниках. По информации из АИС РЗН, наиболее частым типом НЛР были события, связанные с поражением кожи и подкожной клетчатки (метамизол — 1048 (55,9 %), диклофенак — 682 сообщения (69,7 %), АСК — 503 (29,3 %) сообщения), а также общие нарушения и реакции в месте введения (метамизол — 382 (20,4 %), АСК — 225 (13,1 %), диклофенак — 119 (12,1 %)). Поражение ЖКТ по частоте встречаемости оказалось достаточно редким (АСК — 342 (19,9 %), метамизол — 57 (3,04 %), диклофенак — 116 (11,8 %)). Помимо этого, зафиксирован целый ряд событий, которые практически не встречаются в описаниях открытых литературных источников, а именно — поражения дыхательной системы (за исключением «аспириновой бронхиальной астмы») и поражения нервной системы.
Традиционно самыми частыми типами НЛР для НПВС описываются реакции гастротоксичности различной локализации и степеней тяжести, в качестве исходов описываются такие состояния, как диспепсия, тошнота, рвота, болевой синдром, ЖКТ — кровотечения, диарея, а также язвенные поражения [9]. Следующими по частоте возникновения являются НЛР, ассоциированные с поражением сердечнососудистой системы (ССС). Риск сердечно-сосудистых НЛР довольно высок, в качестве исходов в литературе описаны такие конечные точки, как инфаркт миокарда, инсульт или сердечно-сосудистая смерть [10]. Данные референтных источников информации не нашли своего отражения по результатам анализа национальной базы РФ, поражения сердечно-сосудистой системы также оказались довольно редкими (АСК — 33 (1,9 %), метамизол — 12 (0,6 %), диклофенак — 1 (0,1 %)).
Расхождение данных национальной базы о безопасности на пострегистрационном этапе и данных открытых литературных источников информации может быть связано с рядом обстоятельств. В первую очередь следует указать на возможную неэффективность пострегистрационном исследований. После регистрации ЛС и выхода его на рынок могут выявляться новые риски, связанные с его применением, которые не могли быть выявлены на предыдущих этапах (в ходе доклинических и клинических исследований). Это, с одной стороны, создаёт угрозу здоровью пациентов, с другой стороны — может повлиять на регистрационный статус препарата (препарат может быть отозван с рынка по причинам безопасности). В связи с этим законодательно регламентирована обязанность держателя регистрационного удостоверения (ДРУ) осуществлять пострегистрационный мониторинг безопасности лекарственных препаратов и представлять регулятору периодические отчёты по безопасности [5]. Соответственно, со стороны ДРУ проводятся недостаточно эффективные пострегистрационном наблюдения.
В перекос по объёму репортированной информации именно по определённому системно-органному классу также вносит свой вклад и низкая информированность медицинских работников. Принимая во внимание тот факт, что количество предоставленных сообщений относительно мало, можно также сделать вывод о низкой настороженности в вопросах безопасности группы НПВС всех звеньев системы фармаконадзора.
Ещё одним обстоятельством, которое может повлиять на учащение НЛР с преимущественным поражением кожи и подкожных структур, может быть несоблюдение лучших практик производственного контроля (Good Manufacture Practice; GMP) [11].
Выводы / Conclusions
На основании проведённого анализа данных национальной базы представляется возможным сделать следующие выводы:
1. За десятилетний период количество зарегистрированных спонтанных сообщений составило 8334 сообщения, что не достигает необходимого минимума репортирования.
2. НЛР зарегистрированы наиболее часто для трёх лекарств: метамизола (1875), ацетилсалициловой кислоты (1716) и диклофенака (979).
3. Несмотря на то что группа НПВС характеризуется благоприятным профилем безопасности, всё же в АИС РЗН зарегистрированы смертельные исходы. Для ацетилсалициловой кислоты в 4,0 % от всех зарегистрированных НЛР описан летальный исход; для метамизола — в 1,2 %; для диклофенака — в 1,8 %. Средний возраст пациентов, для которых зарегистрированы НЛР с летальным исходом, укладывается в диапазон трудоспособного населения (интерквартильная широта — от 44 до 66 лет).
4. Различия с литературными данными по вопросам безопасности могут быть объяснены рядом факторов, основным из которых авторы статьи считают неэффективность пострегистрационном наблюдения со стороны ДРУ.
5. Для актуализации данных относительно профиля безопасности заявленной группы ЛС необходим дальнейший мониторинг национальной базы с возможным обновлением референтных источников информации.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
ADDITIONAL INFORMATION
Конфликт интересов. Авторский коллектив заявляет об отсутствии конфликта интересов при подготовке данной статьи.
Conflict of interests. The team of authors declares that there is no conflict of interest in the preparation of this article.
Участие авторов: Сыраева Г. И. — концепция исследования, редактирование статьи, обзор литературы, написание статьи; Колбин А. С. — редактирование статьи.
Participation of authors. Syraeva GI — research concept, article editing, literature review, article writing; Kolbin AS — article editing.
Список литературы
1. Laine L, Smith R, Min K, Chen C and Dubois RW. Systematic review: the lower gastrointestinal adverse effects of non-steroidal anti-inflammatory drugs. Alimentary Pharmacology & Therapeutics. 2006;24(5):751–67. doi: 10.1111/j.1365-2036.2006.03043.x
2. Вельц Н. Ю., Букатина Т. М., Журавлёва Е. О., Кутехова Г. В., Дармостукова М. А., Олефир Ю. В., Романов Б. К., Глаголев С. В., Поливанов В. А. К вопросу о безопасности применения нестероидных противовоспалительных препаратов. Безопасность и риск фармакотерапии. 2018;6(3):123–9. [Velts NYu, Bukatina TM, Zhuravleva EO, Kutekhova GV, Darmostukova MA, Olefir YuV, Romanov BK, Glagolev SV, Polivanov VA. On the issue of safety of non-steroidal anti-inflammatory drugs. Safety and Risk of Pharmacotherapy. 2018;6(3):123–9. (In Russ).]. doi: 10.30895/2312-7821-2018-6-3-123-129
3. Сыраева Г. И., Колбин А. С., Матвеев А. В., Панежина В. С. Сравнительный обзор методологий оценки стоимости нежелательных лекарственных реакций в Российской Федерации и Бразилии. Фармация и фармакология. 2020;8(5):336–44. [Syraeva GI, Kolbin AS, Matveev AV, Panezhina VS. Comparative review of methodologies for estimating the cost of adverse drug reactions in the Russian Federation and Brazil. Pharmacy & Pharmacology. 2020;8(5):336–44. (In Russ).]. doi: 10.19163/2307-9266-2020-8-5-336-344
4. Федеральный закон Российской Федерации от 12.04.2010 г. № 61-ФЗ (ред. от 03.04.2020 г.) «Об обращении лекарственных средств», статья 64 «Фармаконадзор». [Federal Law of Russian Federation 12.04.2010 g. № 61-FZ (red. ot 03.04.2020) «Ob obrashchenii lekarstvennykh sredstv», stat’ya 64 «Farmakonadzor». (In Russ).]. Доступно по: https://fzrf.su/zakon/ob-obrashchenii-lekarstvennyh-sredstv-61-fz/st-64.php. Ссылка активна на 23.12.2021.
5. Правила надлежащей практики фармаконадзора Евразийского экономического союза, утвержденные решением Совета ЕЭК 03.11.2016 г., вступившие в силу 06.05.2017 г. [Pravila nadlezhashchei praktiki farmakonadzora Evraziiskogo ekonomicheskogo soyuza (utverzhdennye resheniem Soveta EEK 03.11.2016 g., vstupivshie v silu 06.05.2017 g. (In Russ).]. Доступно по: https://docs.cntd.ru/document/456026106. Ссылка активна на 23.12.2021.
6. Ежемесячный розничный аудит фармацевтического рынка РФ. DSM Group. СМК соответствует требованиям ISO 9001:2015. [Ezhemesyachnyi roznichnyi audit farmatsevticheskogo rynka RF. DSM Group. SMK sootvetstvuet trebovaniyam ISO 9001:2015 (In Russ).]. Доступно по: https://dsm.ru/marketing/free-information/analytic-reports/. Ссылка активна на 23.12.2021.
7. Крашенинников А. Е., Матвеев А. В., Марченко С. Д. Организация российской системы фармаконадзора: результаты опроса уполномоченных лиц по фармаконадзору. Безопасность и риск фармакотерапии. 2021;9(3):154–60. [Krasheninnikov AE, Matveev AV, Marchenko SD. Organisation of the Russian pharmacovigilance system: survey of pharmacovigilance officers. Bezopasnost’ i risk farmakoterapii = Safety and Risk of Pharmacotherapy. 2021;9(3):154–160. (In Russ).]. doi: 10.30895/2312-7821-2021-9-3-154-160
8. FDA.gov [Internet]. U.S. Food and Drug Administration: FEARS public dashboard. Available from: https://fis.fda.gov/sense/app/95239e26-e0be-42d9-a960-9a5f7f1c25ee/sheet/45beeb74-30ab-46be-8267-5756582633b4/state/analysis.
9. Gallelli L, Colosimo M, Pirritano D, Ferraro M, De Fazio S, Marigliano NM, & De Sarro G. Retrospective evaluation of adverse drug reactions induced by nonsteroidal anti-inflammatory drugs. Clin Drug Investig. 2007;27(2):115–22. doi: 10.2165/00044011-200727020-00004
10. Kearney PM, Baigent C, Godwin J, Halls H, Emberson JR, Patrono C et al. Do selective cyclo-oxygenase-2 inhibitors and traditional non-steroidal anti-inflammatory drugs increase the risk of atherothrombosis? Metaanalysis of randomised trials. BMJ. 2006;332(7553):1302–8. doi: 10.1136/bmj.332.7553.1302
11. Правила надлежащей производственной практики Евразийского экономического союза, решение совета Евразийской экономической комиссии, решение от 03 ноября 2016 года № 77. [Pravila nadlezhashchei proizvodstvennoi praktiki Evraziiskogo ekonomicheskogo soyuza, reshenie soveta Evraziiskoi ekonomicheskoi komissii, reshenie ot 03 noyabrya 2016 goda № 77. (In Russ).]. Доступно по: https://docs.cntd.ru/document/456026099. Ссылка активна на 23.12.2021.
Об авторах
Г. И. СыраеваРоссия
Сыраева Гульнара Ислямовна, заместитель управляющего по качеству; очный аспирант кафедры клинической фармакологии и доказательной медицины
SPIN-код: 9650-5671
Санкт-Петербург
А. С. Колбин
Россия
Колбин Алексей Сергеевич, д. м. н., профессор, заведующий кафедрой клинической фармакологии и доказательной медицины; профессор кафедры фармакологии медицинского факультета СПбГУ
SPIN-код: 7966-0845
Санкт-Петербург
Рецензия
Для цитирования:
Сыраева Г.И., Колбин А.С. Нежелательные лекарственные реакции нестероидных противовоспалительных средств: данные национальной базы за 10 лет. Качественная клиническая практика. 2021;(4):16-26. https://doi.org/10.37489/2588-0519-2021-4-16-26
For citation:
Syraeva G.I., Kolbin A.S. Nonsteroidal anti-inflammatory drugs’ adverse drug reactions: 10 years of national database data. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2021;(4):16-26. (In Russ.) https://doi.org/10.37489/2588-0519-2021-4-16-26
















































