Перейти к:
Оптимизация терапии хронического лимфолейкоза с использованием теории игр
https://doi.org/10.37489/2588-0519-2021-3-57-63
Аннотация
Современная стратегия лечения хронического лимфолейкоза (ХЛЛ) базируется на стратификации больных на группы генетического риска с использованием таких предикторов, как del(17p), мутация гена TP53 и мутационный статус генов вариабельного региона иммуноглобулинов. Наличие неблагоприятных предикторов является основанием для назначения новых таргетных препаратов, таких как ибрутиниб, вместо стандартной иммунохимиотерапии. В то же время полное генетическое тестирование не всегда возможно на этапе выбора первой линии терапии для всех пациентов, а эффект от того или иного лечения всегда имеет вероятностный характер. Решение о лечении в условиях неопределённости оптимальной стратегии, различного генетического риска и ответа на терапию можно описать с помощью методов теории игр. В представленной работе описана модель взаимодействия природы (заболевания) и человека (врача) на протяжении лечебного процесса, в рамках которой рассмотрено несколько различных сценариев терапии.
Целью исследования являлся поиск и доказательство оптимальной стратегии лечения, которая бы обеспечила максимально вероятную пятилетнюю беспрогрессивную выживаемость (БПВ) больного ХЛЛ. В качестве критерия оптимального решения использовали критерий Байеса — Лапласа. Доказано, что стратегия стратифицированного подхода к первой линии терапии больных ХЛЛ в зависимости от генетических предикторов более выигрышна («выигрыш» 71 %) по сравнению с назначением всем пациентам иммунохимиотерапии схемами флюдарабин + циклофосфан + ритуксимаб («выигрыш» 45 %) и бендамустин + ритуксимаб («выигрыш» 32 %). Однако оптимальной стратегией лечения больных ХЛЛ в условиях недостатка информации о генетических рисках пациента является терапия ибрутинибом для всех без исключения пациентов («выигрыш» 73 %). Описанный подход к анализу и оптимизации терапии ХЛЛ может использоваться в качестве метода формализации лечебных стратегий онкогематологических заболеваний и применяться в автоматизированных системах поддержки принятия врачебных решений.
Для цитирования:
Лучинин А.С., Стругов В.В. Оптимизация терапии хронического лимфолейкоза с использованием теории игр. Качественная клиническая практика. 2021;(3):57-63. https://doi.org/10.37489/2588-0519-2021-3-57-63
For citation:
Luchinin A.S., Strugov V.V. Optimization of chronic lymphocytic leukemia treatment using game theory. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2021;(3):57-63. (In Russ.) https://doi.org/10.37489/2588-0519-2021-3-57-63
Введение / Introduction
Общеизвестно, что в реальной клинической практике врачи часто оказываются в ситуации, когда приходится принимать решения, не обладая достаточным объёмом информации о пациенте или при её отсутствии, в частности — по причине ограниченных диагностических возможностей медицинских центров. Причинно-следственные связи между симптомами и окончательными диагнозами не всегда очевидны; существует частичная неопределённость, которая придаёт медицинским решениям вероятностный характер и может являться причиной врачебных ошибок. Именно поэтому в современной клинической медицине необходимо применение адекватных математических методов и моделей, использование которых позволит проводить анализ и оценку различных диагностических и лечебных показателей, принимать обоснованные решения в ходе терапии и тем самым минимизировать ошибки на всех этапах лечебно-диагностического процесса.
Учитывая изложенное, представляется перспективным использование методов теории игр — раздела математики, ориентированного на построение формальных моделей принятия оптимальных решений в условиях конфликта. Разработанная Джоном фон Нейманом, Оскаром Моргенштерном и нобелевским лауреатом в области экономики Джоном Форбсом Нэшем теория игр описывает рациональные стратегии принятия решений участниками игры, их последствия и динамические взаимодействия между ними [1]. Теория игр широко применяется в различных сферах нашей жизни, её методы неоднократно использовались в медицине, например при изучении антибиотикорезистентности, канцерогенеза, диагностики лейкозов, при лечении рака [2–5]. В клинической медицине теория игр предполагает создание модели взаимодействия человека (врача) и природы (заболевания). «Игра» человека с природой отражает конфликтную ситуацию, возникающую при столкновении интересов «игроков».
В настоящее время эволюция стратегии терапии хронического лимфолейкоза (ХЛЛ) характеризуется ежегодным уменьшением случаев назначения химиотерапии благодаря применению новых, таргетных молекул. Концепция свободного от химиотерапии лечения становится всё более доминирующей. Изменение терапевтической парадигмы базируется на результатах проведённых международных многоцентровых клинических исследований и на прогностических критериях, в качестве которых выступают генетические предикторы, такие как del(17p), мутации гена TP53 (мутTP53), а также мутационный статус генов вариабельного региона иммуноглобулинов (IGHV) [6].
Современный алгоритм принятия решения о выборе первой линии терапии ХЛЛ базируется на результатах генетических анализов (рис. 1). В данном алгоритме выделяются два критических момента, когда врач принимает решение о лечении пациента. Первый — заключается в выборе между иммунохимиотерапией и препаратом «Ибрутиниб» с учётом результатов генетических тестов. Второй — возникает в случае назначения иммунохимиотерапии и включает в себя выбор конкретной схемы лечения, на что могут влиять такие факторы, как возраст пациента, его общее состояние, коморбидность и профиль токсичности лекарственных препаратов [7].
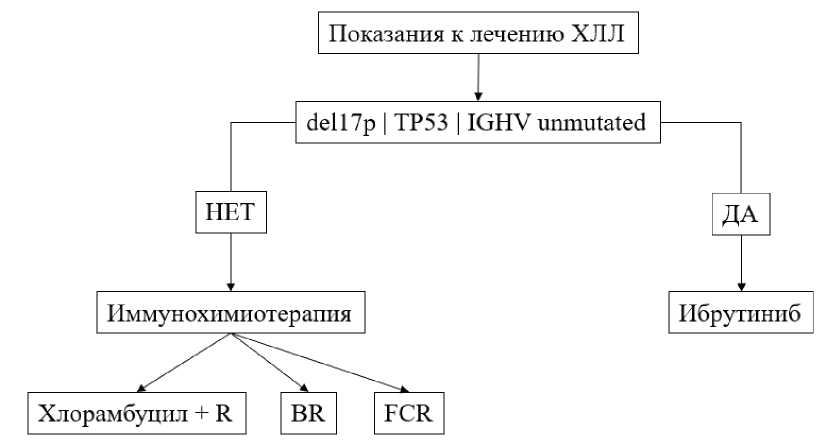
Рис. 1. Упрощённая стратегия первой линии терапии больных ХЛЛ
Примечания: R — ритуксимаб; BR — бендамустин + ритуксимаб, FCR — флюдарабин + циклофосфамид + ритуксимаб; del(17p) — делеция короткого плеча 17-й хромосомы; TP53 — мутации гена TP53; IGHV unmutated — немутированный вариант генов вариабельного региона тяжёлой цепи иммуноглобулинов.
Figure 1. Th e simplifi ed fi rst-line therapy strategy for CLL patients
Notes: R — Rituximab; BR — Bendamustine + Rituximab, FCR — Fludarabine + Cyclophosphamide + Rituximab; del(17p) — the deletion of a small piece of chromosome 17; TP53 — TP53 gene mutation; IGHV unmutated — Immunoglobulin Heavy Chain Gene Unmutated Status.
В свете теории игр при возникновении у человека ХЛЛ действия природы наносят ему ущерб путём прогрессирования злокачественного процесса, который без лечения приводит к осложнениям и гибели пациента. Действия врача направлены на противодействие развитию болезни и продление жизни больного. Задача каждого из участников конфликта «выиграть» — достигнуть своей цели. Конечно, следует оговориться, что это не игра в прямом смысле этого слова и решения (ходы) в данной ситуации принимаются только врачом в одностороннем порядке с целью выбора лечения. Патогенез ХЛЛ зависит от биологических свойств опухоли, что обусловливает её чувствительность или рефрактерность к выбранной терапии. Такая модель взаимодействия врача и заболевания в виде реального пациента с ХЛЛ может быть описана методами теории игр, а значит — формализована для принятия конкретных врачебных решений. В случае с лечением ХЛЛ «игра» проводится в условиях частичной неопределённости. Например, если генетические предикторы ответа на терапию известны, так как врач сделал генетический анализ своему пациенту и знает его результат перед выбором метода лечения, эффективность выбранного метода всё равно будет иметь вероятностный характер. В том случае, если биологические свойства опухоли изначально неизвестны или изучены частично, тогда «игра» с природой происходит в рамках ещё большей неопределённости. Другими словами, существует некая вероятностная мера, в соответствии с которой нужный терапевтический результат будет достигнут или нет. При этом врач, принимающий решение, имеет определённую информацию о вероятностях исхода терапии пациента, в частности, на основании данных клинических исследований, однако только математический расчёт вероятностных мер факторов, влияющих на исход заболевания, позволит выбрать оптимальную стратегию лечения.
Цель исследования / The purpose of the study
Предложить математическое обоснование выбора первой линии терапии больных ХЛЛ и определить оптимальную стратегию лечения в условиях дефицита диагностической информации о пациенте.
Методы / Methods
Выбор оптимальной стратегии базировался на методах теории вероятностей. В качестве критерия оптимального решения использовали критерий Байеса — Лапласа (также известный как EMV-критерий). Данный критерий исключает условия полной неопределённости — его использование предполагает, что возможным состояниям пациента можно приписать определённую вероятность их наступления и, определив математическое ожидание выигрыша для каждого решения, выбрать то, которое обеспечит наилучший результат:
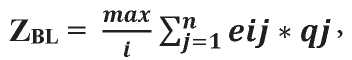
где qj — вероятность выявления неблагоприятного генетического предиктора j;
eij — вероятность «выигрыша» (достижение благоприятного исхода течения заболевания) в зависимости от генетического предиктора j с использованием метода лечения i. Под «выигрышем» понимали вероятность достижения пациентом беспрогрессивной выживаемости (БПВ) продолжительностью как минимум 5 лет. Достижение данной цели необходимо врачу и его пациенту. В качестве генетических предикторов (j) ответа на лечение использовали del(17p), мутации гена TP53 и мутационный статус IGHV. Так как мутации гена TP53 без del(17p) встречаются редко (в 4–5 % случаев), а прогноз эффективности лечения при наличии любого из этих предикторов одинаковый, оба фактора объединили в один del(17p)/мутTP53. Вариант лечения хлорамбуцил + ритуксимаб исключили для упрощения модели как наименее применяемый и эффективный. Итоговая «игровая» модель представлена на рис. 2. Согласно представленной модели, у врача имеются 3 варианта лечения больного ХЛЛ: 1) назначение препарата «Ибрутиниб»; 2) назначение схемы иммунохимиотерапии FCR; 3) назначение схемы иммунохимиотерапии BR.
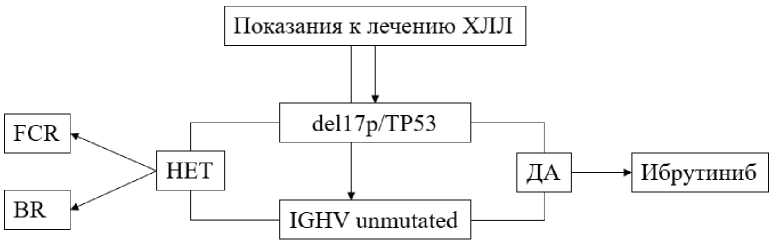
Рис. 2. Модель первой линии терапии больных ХЛЛ
Примечания: R — ритуксимаб; BR — бендамустин + ритуксимаб; FCR — флюдарабин + циклофосфамид + ритуксимаб; del(17p) — делеция короткого плеча 17-й хромосомы; TP53 — мутации гена TP53; IGHV unmutated — немутированный вариант генов вариабельного региона тяжёлой цепи иммуноглобулинов.
Figure 2. The first-line therapy model for CLL patients
Notes: R — Rituximab; BR — Bendamustine + Rituximab; FCR — Fludarabine + Cyclophosphamide + Rituximab; del(17p) — the deletion of a small piece of chromosome 17; TP53 — TP53 gene mutation; IGHV unmutated — Immunoglobulin Heavy Chain Gene Unmutated Status.
Результаты / Results
По правилам существующей стратегии лечения больных с ХЛЛ выявление любого из неблагоприятных генетических предикторов ведёт к выбору терапии препаратом «Ибрутиниб», отсутствие всех неблагоприятных предикторов — к терапии по схемам FCR или BR. Такая стратегия лечения является оптимальной тогда и только тогда, когда вероятность «выигрыша» (продолжительность БПВ≥5 лет) будет максимальной при соблюдении названных выше правил. Так как вероятность пятилетней БПВ на различной терапии в условиях наличия или отсутствия неблагоприятных генетических предикторов является известной величиной, описанной в проведённых ранее клинических исследованиях, можно выделить 12 различных сценариев действий врача и записать их в матрицу «выигрышей» (матрицу вероятностей пятилетней БПВ) (табл. 1). Следует иметь в виду, что у одного и того же пациента одновременно может быть сочетание разных предикторов ответа на терапию, как неблагоприятных, так и благоприятных. Согласно проведённым исследованиям, del(17p)/мутTP53 является наиболее значимым неблагоприятным предиктором эффективности лечения и фактором прогноза течения ХЛЛ. В связи с этим вероятность БПВ на любой терапии у пациентов с мутированным вариантом IGHV-генов (IGHV mutated) следует считать истинной только в условиях отсутствия del(17p)/мутTP53. В то же время при наличии del(17p)/мутTP53 прогностическим значением мутационного статуса IGHV можно пренебречь, а прогноз следует оценивать по максимально неблагоприятному сценарию.
Таблица 1
Матрица вероятностей пятилетней БПВ больных ХЛЛ при различной терапии
Table 1
The probability matrix of 5-year progressive free survival in patients with CLL in diff erent therapy
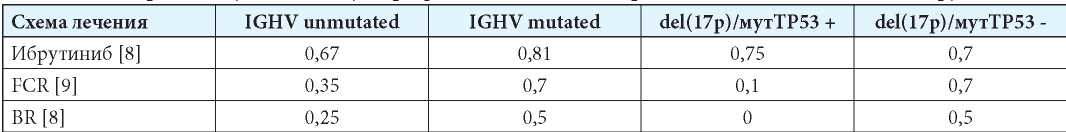
Рассмотрим первый вариант стратегии лечения, когда пациенту проведено всё необходимое генетическое обследование и врач точно (с вероятностью = 1) знает о наличии или отсутствии предикторов неблагоприятного течения заболевания. Тогда при наличии del(17p)/мутTP53 или отсутствии мутаций в генах IGHV (немутированный вариант IGHV) оптимальной стратегией лечения будет терапия ибрутинибом, что обеспечит максимальную вероятность пятилетней БПВ по сравнению с иммунохимиотерапией согласно матрице вероятностей (см. табл. 1). При втором варианте врач не знает результатов генетического обследования больного ХЛЛ, например, по причине того, что данные анализы не проводятся в его медицинском центре, следовательно, всем пациентам в качестве первой линии назначается терапия FCR или BR. Тогда вероятность «выигрыша» будет зависеть от того, с какой вероятностью у пациента может присутствовать тот или иной неблагоприятный предиктор. Согласно данным литературы, частота встречаемости немутированного варианта IGHV-генов в популяции больных с активным ХЛЛ составляет 0,6, а del(17p)/мутTP53 — 0,1 [10][11]. Таким образом, вероятность сочетания у одного пациента немутированного варианта IGHV-генов и del(17p)/мутTP53 равняется произведению этих двух независимых событий: 0,6*0,1=0,06 (6 %). Вероятность наличия у пациента или немутированного варианта IGHV-генов, или del(17p)/мутTP53 равняется 0,6+0,1-0,06=0,64. Следовательно, если считать, что стратегия лечения на основе обязательного генетического тестирования является оптимальной, то при 100%-ном выборе иммунохимиотерапии в качестве первой линии врач будет ошибаться с частотой 64 %, то есть выбирать неоптимальную стратегию лечения.
Докажем, какая из стратегий лечения является оптимальной. Для оценки вероятности «выигрыша» при лечении в условиях неопределённости построим другую матрицу вероятностей и воспользуемся критерием Байеса — Лапласа (табл. 2). Согласно построенной матрице вероятностей и принимая во внимание тот факт, что наличие del(17p)/мутTP53 нивелирует прогностическое значение мутационного статуса IGHV-генов при назначении пациенту в качестве первой линии терапии схемы FCR, мы получим три сценария развития (табл. 3). Таким образом, «выигрыш» у случайно взятого пациента с ХЛЛ с неизвестным генетическим статусом заболевания при использовании в качестве первой линии терапии схемы FCR составит 45,1 %.
Таблица 2
Матрица вероятностей пятилетней БПВ больных ХЛЛ при различной терапии в условиях неопределённости генетического статуса
Table 2
The probability matrix of 5-year progressive free survival in patients with CLL in diff erent therapy and unknown genetic status
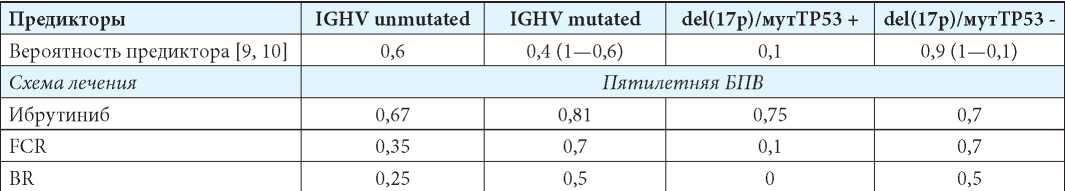
Таблица 3
Матрица вероятностей пятилетней БПВ больного ХЛЛ при терапии FCR в условиях неопределённости генетического статуса
Table 3
The probability matrix of 5-year progressive free survival in a patient with CLL in FCR therapy and unknown genetic status
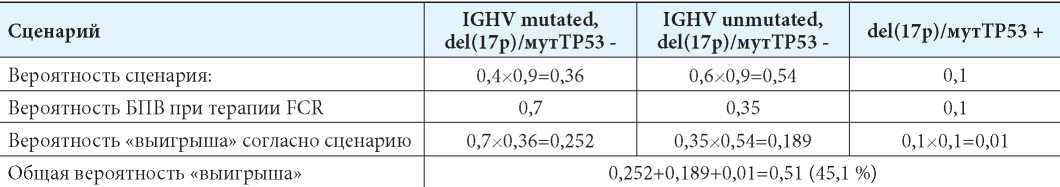
При назначении пациенту в качестве первой линии терапии схемы BR мы также получим три сценария развития (табл. 4). «Выигрыш» у случайно взятого пациента с ХЛЛ с неизвестным генетическим статусом заболевания при использовании в качестве первой линии терапии схемы BR составит только 31,5 %. Интересно, что прогнозируемые таким способом результаты лечения больных ХЛЛ по схемам FCR и BR не сильно отличаются от значений БПВ, полученных в ходе рандомизированного клинического исследования CLL10 [7].
Варианты исходов при стратегии назначения всем пациентам препарата «Ибрутиниб» в условиях неопределённости их генетического статуса представлены в табл. 5. «Выигрыш» у случайно взятого пациента с ХЛЛ с неизвестным генетическим статусом заболевания при использовании в качестве первой линии терапии препарата «Ибрутиниб» составит 72,8 %.
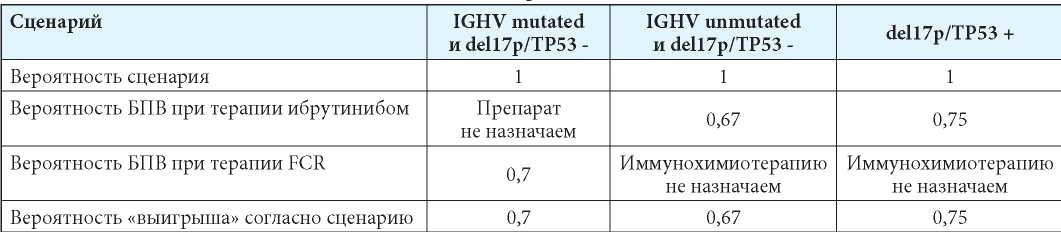
В условиях определённости, когда генетический статус пациента известен, врач действует по сценарию, описанному современными клиническими рекомендациями. Он рекомендует назначение ибрутиниба при наличии del(17p)/мутTP53 или немутированного варианта IGHV-генов и схему FCR (при отсутствии противопоказаний) — при IGHV-мутированном варианте и отрицательном генетическом тесте на del(17p)/мутTP53 (табл. 6). Согласно такой стратегии, вероятность пятилетней БПВ у пациента с ХЛЛ с IGHV mutated и отсутствием мутации del(17p)/мутTP53 при первой линии терапии FCR составит 70 %, при наличии IGHV unmutated и отсутствии del17p/TP53 и лечении ибрутинибом — 67 %, а при del(17p)/мутTP53 и лечении ибрутинибом — 75 %. Средняя вероятность «выигрыша» — 71 %.
Таблица 4
Матрица вероятностей пятилетней БПВ больного ХЛЛ при терапии BR в условиях неопределённости генетического статуса
Table 4
The probability matrix of 5-year progressive free survival in a patient with CLL in BR therapy and unknown genetic status
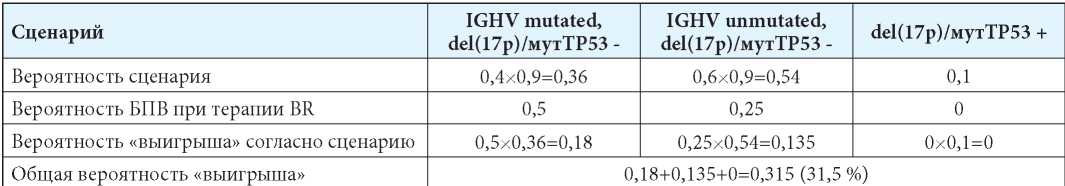
Таблица 5
Матрица вероятностей пятилетней БПВ больного ХЛЛ при терапии ибрутинибом в условиях неопределённости генетического статуса
Table 5
The probability matrix of 5-year progressive free survival in a patient with CLL in Ibrutinib therapy and unknown genetic status
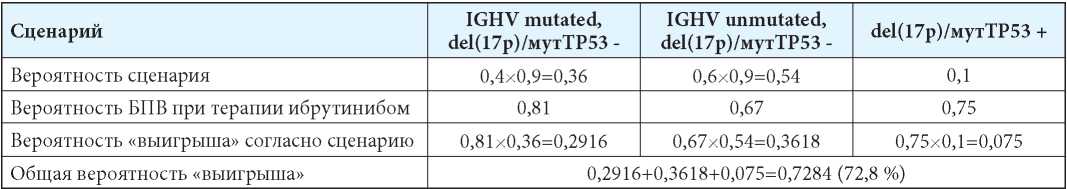
Таблица 6
Матрица вероятностей пятилетней БПВ больного ХЛЛ при терапии ибрутинибом или FCR в условиях определённости генетического статуса
Table 6
The probability matrix of 5-year progressive free survival in a patient with CLL in Ibrutinib or FCR therapy
Заключение / Conclusion
Существующая на сегодняшний день стратегия стратифицированного подхода к выбору первой линии терапии больных ХЛЛ в зависимости от генетических предикторов более выигрышна (вероятность «выигрыша» 71 %) по сравнению с назначением всем пациентам иммунохимиотерапии схемами FCR (вероятность «выигрыша» 45 %) и BR (вероятность «выигрыша» 32 %). Однако оптимальной стратегией лечения больных ХЛЛ в условиях недостатка информации о генетических рисках пациента является терапия ибрутинибом для всех без исключения пациентов (вероятность «выигрыша» 73 %).
В то же время, с экономической точки зрения, лечение ибрутинибом всех без исключения пациентов в первой линии менее выгодно, чем генетическое тестирование на этапе определения первичной стратегии терапии.
Описанный подход к анализу и оптимизации терапии ХЛЛ может использоваться в качестве метода формализации лечебных стратегий любых онкогематологических заболеваний и применяться в автоматизированных системах поддержки принятия врачебных решений.
Таким образом, использование в практической медицине методов теории игр позволяет минимизировать риск врачебных ошибок при выборе стратегии лечения пациентов и коррекции терапии.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
ADDITIONAL INFORMATION
Конфликт интересов. Стругов В. В. сообщает о получении гранта на проведение наблюдательного исследования от компании «Янссен», гонораров за выступления от компаний «Янссен» и «Эббви», а также спонсорской помощи на посещение медицинских конференций от компании «Эббви». Лучинин А. С. заявляет об отсутствии конфликтов интересов.
Conflict of interest. Strugov VV informs about receiving a grant for conducting an observational study from the Janssen company, speaking fees from the Janssen and Ebbvi companies, as well as sponsorship for attending medical conferences from the Ebbvi company. Luchinin AS declares the absence of conflicts of interest.
Список литературы
1. Osborne MJ. An introduction to game theory. Oxford University Press. 2002.
2. Conlin PL, Chandler JR, Kerr B. Games of life and death: antibiotic resistance and production through the lens of evolutionary game theory. Curr Opin Microbiol. 2014;21:35–44. doi: 10.1016/j.mib.2014.09. PMID: 25271120
3. Gatenby RA, Vincent TL. An evolutionary model of carcinogenesis. Cancer Res. 2003;63(19):6212–20. PMID: 14559806
4. Torkaman A, Charkari NM, Aghaeipour M. An approach for leukemia classification based on cooperative game theory. Anal Cell Pathol (Amst). 2011;34(5):235–46. doi: 10.3233/ACP-2011-0016. PMID: 21988887
5. Stanková K, Brown JS, Dalton WS, Gatenby RA. Optimizing Cancer Treatment Using Game Theory: A Review. JAMA Oncol. 2019;5(1):96–103. doi: 10.1001/jamaoncol.2018.3395. PMID: 30098166
6. Hallek M. Chronic lymphocytic leukemia: 2019 update on diagnosis, risk stratification and treatment. Am J Hematol. 2019;94(11):1266–87. doi: 10.1002/ajh.25595. PMID: 31364186
7. Barbara Eichhorst, Anna-Maria Fink, Jasmin Bahlo, Raymonde Busch, Gabor Kovacs, Christian Maurer, Elisabeth Lange, Hubert Köppler, Michael Kiehl, Martin Sökler, Rudolf Schlag, Ursula Vehling-Kaiser, Georg Köchling, Christoph Plöger, Michael Gregor, Torben Plesner, Marek Trneny, Kirsten Fischer, Harmut Döhner, Michael Kneba, Clemens-Martin Wendtner, Wolfram Klap-per, Karl-Anton Kreuzer, Stephan Stilgenbauer, Sebastian Böttcher, Michael Hallek, international group of investigators; German CLL Study Group (GCLLSG). First-line chemoimmunotherapy with bendamustine and rituximab versus fludarabine, cyclophosphamide, and rituximab in patients with advanced chronic lymphocytic leukaemia (CLL10): an international, open-label, randomised, phase 3, non-inferiority trial. Lancet Oncol. 2016;17(7):928–42. doi: 10.1016/S1470-2045(16)30051-1. PMID: 27216274
8. Jennifer A Woyach, Amy S Ruppert, Nyla A Heerema, Weiqiang Zhao, Allison M Booth, Wei Ding, Nancy L Bartlett, Danielle M Brander, Paul M Barr, Kerry A Rogers, Sameer A Parikh, Steven Coutre, Arti Hurria, Jennifer R Brown, Gerard Lozanski, James S Blachly, Hatice G Ozer, Brittny Major-Elechi, Briant Fruth, Sreenivasa Nattam, Richard A Larson, Harry Erba, Mark Litzow, Carolyn Owen, Charles Kuzma, Jeremy S Abramson, Richard F Little, Scott E Smith, Richard M Stone, Sumithra J Mandrekar, John C Byrd. Ibrutinib regimens versus chemoimmunotherapy in older patients with untreated CLL. N Engl J Med. 2018;379(26):2517–28. doi: 10.1056/NEJMoa1812836. PMID: 30501481
9. Kirsten Fischer, Jasmin Bahlo, Anna Maria Fink, Valentin Goede, Carmen Diana Herling, Paula Cramer, Petra Langerbeins, Julia von Tresckow, Anja Engelke, Christian Maurer, Gabor Kovacs, Marco Herling, Eugen Tausch 2, Karl-Anton Kreuzer, Barbara Eichhorst, Sebastian Böttcher, John F Seymour, Paolo Ghia, Paula Marlton, Michael Kneba, Clemens-Martin Wendtner, Hartmut Döhner, Stephan Stilgenbauer, Michael Hallek. Longterm remissions after FCR chemoimmunotherapy in previously untreated patients with CLL: updated results of the CLL8 trial. Blood. 2016;127(2):208– 15. doi: 10.1182/blood-2015-06-651125. PMID: 26486789
10. Thorsten Zenz, John G Gribben, Michael Hallek, Hartmut Döhner, Michael J Keating, Stephan Stilgenbauer. Risk categories and refractory CLL in the era of chemoimmunotherapy. Blood. 2012;119(18):4101–7. doi: 10.1182/blood-2011-11-312421. PMID: 22394601
11. Jennifer Crombie, Matthew S. Davids. IGHV Mutational Status Testing in Chronic Lymphocytic Leukemia. Am J Hematol. 2017;92(12):1393–7. doi: 10.1002/ajh.24808. PMID: 28589701
Об авторах
А. С. ЛучининРоссия
Лучинин Александр Сергеевич, к. м. н., с. н. с. отдел организации и сопровождения научных исследований
Киров
В. В. Стругов
Россия
Стругов Владимир Владимирович, н. с. НИЛ онкогематологии
Санкт-Петербург
Рецензия
Для цитирования:
Лучинин А.С., Стругов В.В. Оптимизация терапии хронического лимфолейкоза с использованием теории игр. Качественная клиническая практика. 2021;(3):57-63. https://doi.org/10.37489/2588-0519-2021-3-57-63
For citation:
Luchinin A.S., Strugov V.V. Optimization of chronic lymphocytic leukemia treatment using game theory. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2021;(3):57-63. (In Russ.) https://doi.org/10.37489/2588-0519-2021-3-57-63

















































