Перейти к:
Полиморфизм генов артериальной гипертензии у детей с ожирением и артериальной гипертензией
https://doi.org/10.37489/2588-0519-2020-5-70-79
Аннотация
Артериальная гипертензия (АГ) среди детей и подростков с ожирением диагностируется с частотой 24,8—40 % случаев. Патогенез АГ среди детей с ожирением продолжает изучаться в связи с определением новых генетических и эпигенетические факторов, определяющих её течение. Полиморфизм генов АГ может служить причиной поддержания повышенного сосудистого тонуса, даже при условии оптимизации нутритивного статуса ребёнка.
Цель исследования: изучение полиморфизмов генов артериальной гипертензии AGT: 704, AGТ: 521; AGTR2: 1675; еNOS3:786 среди детей с ожирением и АГ в зависимости от динамики артериального давления (АД) на немедикаментозное реабилитационное лечение.
Материалы и методы. В исследование было включено 50 детей 11—14 лет с ожирением и АГ, которым была назначены диета и курсы специальных физических упражнений в течение 6 месяцев. Проведено сравнение 2 групп детей: дети, которые сохранили АГ после лечения «АГ6 мес+» и дети, у которых после лечения АГ не диагностировали, «АГ6 мес-». Группу сравнения составили 34 здоровых ребёнка с нормальными массо-ростовыми показателями и АД. Проведено клиническое обследование и анализ полиморфизмов AGT: 704, AGТ: 521; AGTR2: 1675; еNOS3:786.
Результаты. Сравнительный анализ генотипических вариантов показал диспропорциональное распределение аллелей в зависимости от динамики АД. У детей группы «АГ6 мес+» наблюдалось преобладание мутантных гомозиготных аллелей гена AGTR2 АА(А) 45 % (22 %) и снижение частоты выявления нормального гомозиготного аллеля GG(G) 9,0 % (9,6 %), а также была установлена сопряжённость по данным многомерного анализа с гомозиготой СС для AGT 704, гетерозиготой СТ для AGТ521 и гомозиготой СС для гена eNOS, чего не определялось у детей в группе «АГ6 мес -» и у детей группы сравнения.
Заключение. Выявление причинно-значимых полиморфизмов генов артериальной гипертензии у детей с ожирением позволит прогнозировать риск развития стабильной АГ и определять тактику лечения.
Ключевые слова
Для цитирования:
Маскова Г.С., Хохлов А.Л., Сироткина А.М. Полиморфизм генов артериальной гипертензии у детей с ожирением и артериальной гипертензией. Качественная клиническая практика. 2020;(5):70-79. https://doi.org/10.37489/2588-0519-2020-5-70-79
For citation:
Maskova G.S., Khokhlov A.L., Sirotkina A.M. Polymorphism of genes of arterial hypertension among children with obesity and arterial hypertension. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2020;(5):70-79. (In Russ.) https://doi.org/10.37489/2588-0519-2020-5-70-79
Введение
Нарастание эпидемии ожирения среди детей приводит к раннему старту и распространению артериальной гипертензии (АГ) с сохранением этого тренда во взрослую жизнь. [1][2][3]. АГ среди детей и подростков с ожирением диагностируется с частотой 24,8—40 % случаев [4][5][6][7]. Патогенез АГ среди детей с ожирением продолжает изучаться в связи с определением новых генетических и эпигенетические факторов, определяющих её течение [8, 9]. Основные профилактические и терапевтические стратегии борьбы с АГ сегодня строятся исходя из концепции предиктивной, превентивной и персонализированной медицины [10]. Значительное место в этом процессе занимает изучение генетической предрасположенности и определение показаний к генетическому обследованию для оценки персонализированных рисков развития болезни [11][12][13][14].
В патогенезе АГ особую роль играют гены-кандидаты, детерминирующие синтез ангиотензина AGT, ангиотензин-превращающего фермента (АСЕ), синтетазы оксида азота (NOS3) и др. [15][16][17].
Результаты клинико-генетических сопоставлений «между полиморфизмом генов ренин-ангиотензиновой системы (RAS) и развитием АГ не позволяют однозначно оценить функциональную значимость генетических полиморфизмов. Мутантные аллели полиморфизмов встречаются с разной частотой в различных популяциях и не всегда ассоциируются с риском развития патологии» [18]. Недостаточно изучены полиморфизмы генов АГ у детей с ожирением в зависимости от стабильности повышенного системного сосудистого тонуса [19].
В связи с вышеизложенным, поиск генетических основ формирования и поддержания артериальной гипертензии у детей с ожирением представляет значительный научный интерес.
Целью настоящего исследования стало изучение полиморфизмов генов AGT: 704, AGТ: 521; AGTR2: 1675; еNOS3:786 и сравнительный анализ их генотипических вариантов у детей с ожирением и артериальной гипертензией в зависимости от динамики артериального давления на немедикаментозное реабилитационное лечение.
Материалы и методы
В исследование было включено 50 детей в возрасте 11—14 лет с ожирением 1—3-й степени и систолической артериальной гипертензией (САГ). Показанием для включения в исследование было значение индекса массы тела (ИМТ) от +2,0 SDS до +3,9 и наличие САГ, установленной согласно Федеральным клиническим рекомендациями «Артериальная гипертензия у детей», 2016 г. [20]. Показанием для исключения из исследования было морбидное ожирение (ИМТ>4,0 SDS), вторичный и наследственный характер ожирения, а также вторичная (симптоматическая) АГ, связанная с эндокринной патологией, патологией сердца, почек и др.
Исследование проводилось в период 2016-2018 гг. Протокол и дизайн были одобрены Этическим комитетом ФГБОУ ВО ЯГМУ Минздрава России. Родителями пациентов было подписано информированное согласие на участие в исследовании.
Наблюдение и обследование детей проводилось в условиях городской детской поликлиники. Дети соблюдали в домашних условиях назначенную диету, получили по 2 курса физической реабилитации (по 2 месяца) в поликлинике в течение 6 месяцев, не получали антигипертензивной терапии, имели сформированную приверженность лечению и положительную эффективность реабилитации через 6 месяцев от начала наблюдения (снижение ИМТ и % жировой массы в составе тела, повышение переносимости физической нагрузки).
Первую группу наблюдения составили 32 подростка (20 мальчиков и 12 девочек) с ожирением (ОЖ), у которых после немедикаментозной реабилитации через 6 месяцев сохранялась систолическая артериальная гипертензия (группа «АГ6 мес+»).
Вторую группу наблюдения составили 18 подростков (16 мальчиков и 2 девочки) с ОЖ, у которых после немедикаментозной реабилитации через 6 месяцев не диагностировали САГ (группа «АГ6 мес -»).
Группу сравнения составили 34 подростка (26 мальчиков и 8 девочек) 11—14 лет 1—2 группы здоровья, с нормальным АД и нормальным количеством жировой массы в составе тела. Группы наблюдения были сопоставимы по полу и возрасту. Во всех группах наблюдения преобладали мальчики. Клиническая характеристика обследованных детей представлена в табл. 1.
Таблица 1
Клиническая характеристика детей

Диагноз ожирения детям выставлялся на основании клинического осмотра с оценкой ИМТ и определением жировой массы в составе тела (%). Диагноз САГ детям выставлялся на основании 3-кратной оценки офисного АД, а также результатов суточного мониторирования АД (СМАД) [21]. Лабораторное обследование включало клинический и биохимический анализ крови. Анализ наследственности проведён для оценки распространённости и срока старта АГ и ОЖ у родственников различной степени родства. Приверженность лечению оценивали, по суммарной оценке, в баллах: соблюдения диеты (0—2 балла), двигательной активности (0—2 балла), частоте посещения врача-педиатра (0—2 балла) и эндокринолога (0—2 балла) и прохождению курсов реабилитационного лечения (0—2 балла). Суммарная оценка всех исследуемых показателей в 4 балла и более оценивалась, как наличие приверженности лечению. Исследовалась распространённость различных аллельных вариантов генов, а также взаимосвязь полиморфизма генов AGT: 704, AGТ: 521; AGTR2: 1675; еNOS3:786 с группами наблюдения и группой сравнения. Исследование полиморфизма генов проводилось на анализаторе нуклеиновых кислот BioRad iQ5 в лаборатории кафедры клинической фармакологии с курсом ИПДО ЧУЗ «Дорожная клиническая больница на станции Ярославль ОАО «РЖД». Для определения генетических полиморфизмов методом полимеразной цепной реакции в препаратах ДНК человека, полученных из периферической крови, использовались реагенты компании «Синтол» (Россия). Кровь отбиралась из локтевой вены в пробирку, содержащую антикоагулянт К2ЭДТА. Кровь не замораживалась, не центрифугировалась, и в тот же день доставлялась в генетическую лабораторию.
Для оценки распространённости различных аллельных вариантов генов AGT: 704, AGТ: 521; AGTR2: 1675; еNOS3:786 у детей с ожирением в исследуемой популяции были проведены тесты Харди—Вайнберга для изучения распределения частот встречаемости генотипов у детей в обследуемой выборке (табл. 2).
Таблица 2
Распределение частот полиморфных генотипов в исследуемой выборке (равновесие Харди—Вайнберга)
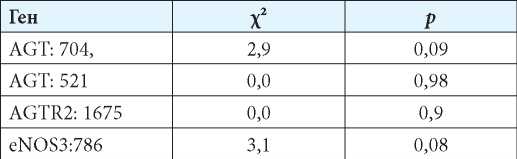
Статистическая обработка данных проводилась при помощи пакета прикладных программ «Statistica 13.0» (StatSoft Inc., США). Осуществлялась проверка нормальности распределения количественных признаков с использованием критерия Шапиро—Уилка. Для установления однородности сравниваемых групп применялся метод проверки статистических гипотез об извлечении выборок из одной генеральной совокупности. При сравнении двух независимых групп по одному признаку были использованы классический критерий χ² по Пирсону с применением поправки Йетса, критерий Манна—Уитни. Критическое значение уровня статистической значимости принимали равным 5 %. Многомерная статистика проведена с использованием метода многомерного шкалирования качественных данных —анализ соответствий (англ. correspondence analysis).
Результаты
Клиническая оценка нутритивного статуса детей показала, что среди детей групп наблюдения дет с ОЖ 1-й степени составили 60,0 %, дети с ОЖ 2-й степени — 28,0 %, и дети с ОЖ 3-й степени — 12,0 %. Таким образом, среди обследованных детей 11—14 лет с нутритивными нарушениями и исходно САГ не преобладали дети со среднетяжёлым и тяжёлым ожирением, что минимизировало влияние исключительно тяжести ОЖ на формирование АГ в изучаемой выборке. Уровень артериальной гипертензии в исходном состоянии у детей с нутритивными нарушениями соответствовал АГ 1-й степени — у 63,8 %, а у 36,2 % — АГ 2-й степени.
Оценка генеалогического анамнеза свидетельствовала о высоком распространении АГ в группах наблюдения (в 47 % семей) без учёта степени родства и сроков её развития, в 33 % семей зафиксирована АГ у родственников 1-й линии родства и в 30 % семей установлено ОЖ у родственников 1-й линии родства. Полученные данные свидетельствовали о широком распространение АГ и ожирения в общей популяции современного населения.
Таблица 3
Частота встречаемости полиморфных вариантов генотипов у детей 11—14 лет в исследуемой популяции
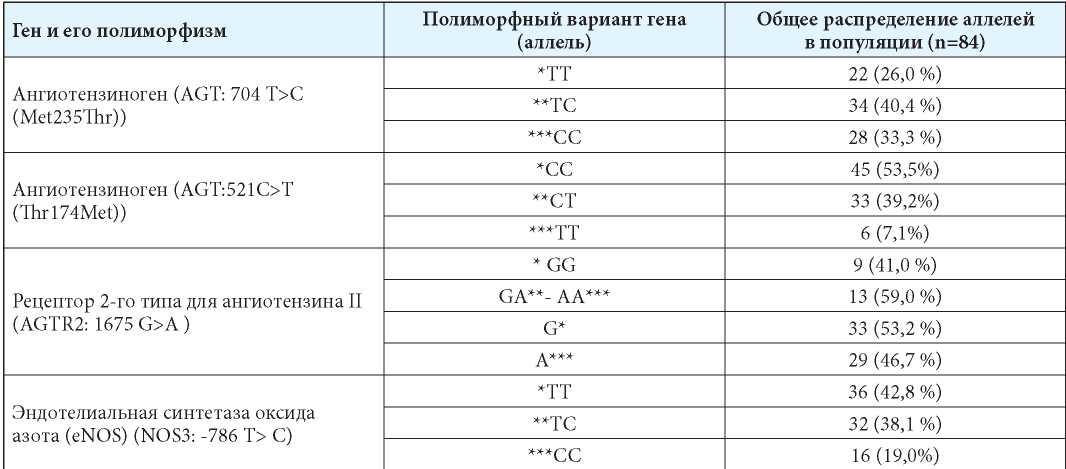
Примечания: * — норма гомозигота; ** — гетерозигота; *** — мутация гомозигота.
Изучение полиморфизмов генов АГ в обследованной выборке детей позволило оценить распространение полиморфных вариантов аллелей. Для генов ангиотензиногена (AGT:521С>T (Th r174Met)) и эндотелиальной синтетазы оксида азота (eNOS) (NOS3: -786 T>C) зафиксировано преобладание распространения нормальной гомозиготы СС (53,5 %) и ТТ (42,8 %) над патологическими гомозиготами ТТ (7,1 %)(р>0,001) и СС (19,0 %), соответственно. Для генов ангиотензиногена (AGT: 704 T>C (Met235Thr)) и рецептора 2-го типа для ангиотензина II (AGTR2: 1675 G>A) в обследованной популяции детей было характерно высокое распространение гомозиготных аллелей СС (33,0 %) и АА/А (59/46 %), соответственно. Согласно данным литературы ген AGT: 704 (Met235Thr) имеет прогностическое значение для определения риска АГ, особенно предрасположены к АГ лица с генотипом СС, в некоторых исследованиях показано, что данный полиморфизм ассоциируется с уровнем АД и риском развития гипертрофии миокарда левого желудочка; а наличие мутации АА для гена AGTR2: 1675 у лиц женского пола ассоциируют с повышенной чувствительностью AGTR2 к ангиотензину II [11]. Полиморфизм гена эндотелиальной синтетазы монооксида азота T786C (rs2070744) имеет значение в процессах образования NO. Гомозиготный генотип СС полиморфизма T786C обуславливает более высокие значения систолического и диастолического АД в сравнении с носителями других вариантов у молодых здоровых лиц [22][23].
Для анализа различий трёх исследуемых групп был проведён непараметрический анализ вариаций по методу Kruskal—Wallis с установлением достоверности различий частот для трёх исследуемых групп. Достоверные различия между тремя группами получены по таким клиническим переменным, как уровень артериального давления (р=0,001), наличие в наследственности артериальной гипертензии без учёта степени родства (р=0,004), наследственность по артериальной гипертензии среди родственников 1-й линии родства (р=0,052), по индексу массы тела (р=0,005) и степени ожирения (р=0,001). Различия генетического полиморфизма среди 3 групп подтверждены для генов: ангиотензиногена (AGT: 704 T>C (Met235Thr) (р=0,041), ангиотензиногена (AGT: 521С >T (Th r174Met н) (p =0,045), рецептора 2-го типа для ангиотензина II (AGTR2: 1675 G>A), p=0,013) и эндотелиальной синтетазы оксида азота (eNOS) (NOS3: -786 T>C) (р=0,04).
Попарное сравнение групп обследованных детей показало достоверность отличий уровня АД у детей из групп «АГ6 мес+» и «АГ6мес—» от уровня АД у детей группы сравнения (р=0,001 и р=0,001, соответственно) и отсутствие различий по распространению различной стпени АГ между детьми групп «АГ6 мес+» и «АГ6 мес—». Однако у детей с позитивной динамикой АД под влиянием реабилитационного лечения реже, чем у детей с отсутствием положительной динамики регистрировали АГ 2-й степени: у 22,3 % и 50 % детей, соответственно, и более часто регистрировали АГ 1-й степени: у 77,7 % и 50 % детей, соответственно. Группы детей с нутритивными нарушениями не различались по ИМТ, степени тяжести ожирения, однако среди детей из группы АГ «6 мес+» преобладали дети с ОЖ 1-й степени (62 %), в то время как среди детей из группы АГ «6 мес-» детей с ожирением 1-й степени было в 2 раза меньше (33 %), а преобладали дети с ожирением 2- и 3-й степени (суммарно 55 %). Частота регистрации АГ в семейном анамнезе артериальной гипертензии среди всех родственников и у родственников 1-й линии родства у детей, у которых не удалось достигнуть снижения АД (группа наблюдения «АГ6 мес+») превышала таковую у детей группы сравнения(ГС) (р=0,001 и р=0,05, соответственно).
Результаты исследования частоты встречаемости аллелей, изучаемых генов представлены в таблицах 4—8. Оценка частоты встречаемости аллелей гена AGTR2 для девочек в зависимости от группы наблюдения представлена в табл. 4.
Таблица 4
Частота встречаемости аллелей гена AGTR2 у девочек
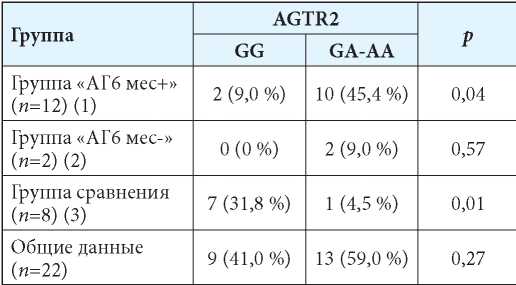
Примечания: p(G1-G3)=0,01; p(G2-G3)=0,002; p(A1-A3)=0,004; p(A2-A3)=0,24.
Для девочек из группы «АГ6 мес+» частота встречаемости гомо- и гетерозиготы GA-AA была значительно выше частоты встречаемости гомозиготы GG гена AGTR2 (2 (9 %) против 10 (45 %); р=0,04)) и регистрировалась чаще, чем в двух других группах. В тоже время у девочек группы сравнения (ГС) достоверно чаще определяли нормальный гомозиготный вариант GG (31,4 %) (р=0,01). Результаты исследования частоты встречаемости аллелей гена AGTR2 у мальчиков показали аналогичную тенденцию для детей группы «АГ6 мес+», когда преобладала гемизигота А над гемизиготой G (р=0,04), а также получено более высокое распространение гемизиготы А и более низкое G у мальчиков «АГ6 мес+» относительно здоровых сверстников (табл. 5).
Таблица 5
Частота встречаемости аллелей гена AGTR2 у мальчиков
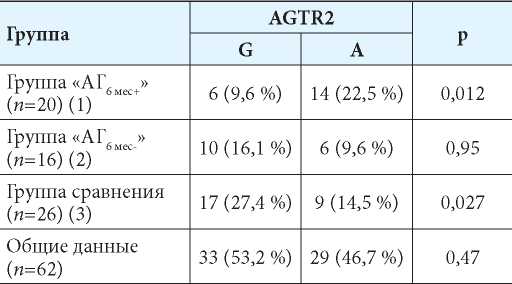
Примечания: p(G1-G3)=0,018; p(G2-G3)<0,05; p(G1-G2)<0,05; p(A1-A3)=0,018; p(A2-A3)=0,85; p(A1-A2)<0,05.
Ген AGTR2, кодирующий один из белков-рецепторов к ангиотензину II, опосредует основные сердечно-сосудистые эффекты ангиотензина II. У взрослых пациентов показано, что частота встречаемости мутантного аллеля A гена AGTR2 была значительно выше у больных с очень высоким сердечно-сосудистым риском и значимо ниже в группе пациентов со средним/низким риском прогнозируемых событий [24].
Для гена AGТ: 521 у детей группы «АГ6 мес+» и детей группы сравнения установлено более высокое распространение гетерозиготы СТ (43,7 % и 50%, соответственно), чем у детей «АГ6 мес-» (табл. 6).
Таблица 6
Частота встречаемости аллелей гена AGТ: 521 в обследуемой популяции
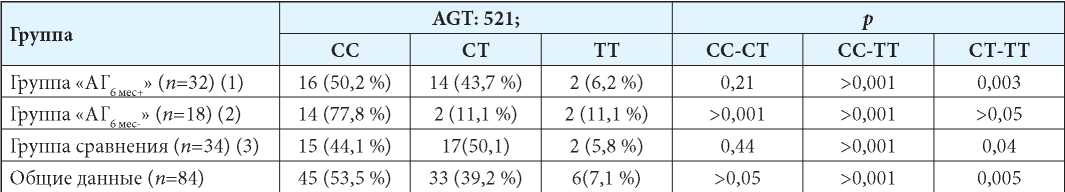
Примечания: p(ТТ1-ТТ3)>0,05; p(ТТ2-ТТ3) =0,053; p(ТТ1-ТТ2)=1,0; p(СT1-СT3) >0,05; p (СT2-СT3) = 0,03; р(СТ1-СТ2)>0,05; p(СС1-СС3) > 0,05; p(СС2-СС3)=0,08; p(СС1-СС2)=0,128.
В проведённом исследовании для аллелей гена AGТ: 704 у детей с сохранением АГ установлено преобладание распространения мутантной гомозиготы СС (50 %) и гетерозиготы ТС (37,5 %) в сравнении с нормальной гомозиготой ТТ (12,5 %) (табл. 7). У детей, нормализовавших АД на фоне реабилитации, распределение гомозиготных аллелей СС и ТТ было одинаковым и составило по 44,4 %. Попарное сравнение групп показало достоверно более высокое распространение мутантной гомозиготы СС для детей с ожирением в обеих группах относительно группы сравнения (p(СС1-СС3) <0,001; p(СС2-СС3) =0,008). Для детей, нормализовавших АД, установлена более высокая распространённость нормальной гомозиготы ТТ относительно детей с сохранением АД (р=0,012) и отсутствие различий от детей группы сравнения.
Таблица 7
Частота встречаемости аллелей гена AGТ: 704 в обследуемой популяции
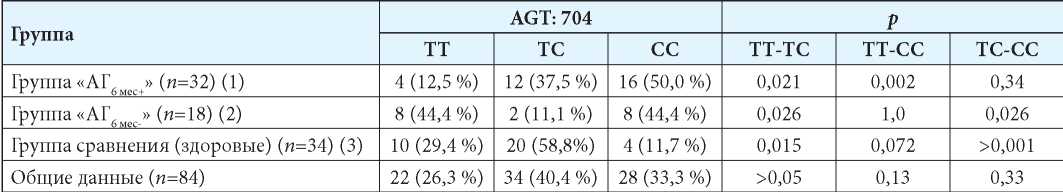
Примечания: p(ТТ1-ТТ3)=0,09; p(ТТ2-ТТ3)=0,27; p(ТТ1-ТТ2)=0,012; p(TС1-TС3)=0,084; p(TС2-TС3)<0,001; р(TС1-TС2)>0,05; p(СС1-СС3)<0,001; p(СС2-СС3)=0,008; p(СС1-СС2)=0,7.
При оценке распространённости аллелей гена eNOS 786 установлено преобладание во всех группах нормальной гомозиготы ТТ, при отсутствии межгрупповых различий (табл. 8). Максимальное представительство мутантной гомозиготы СС было установлено у детей с сохранением артериальной гипертензии (31,2 %), при этом были получены только тенденции к различию с другими группами p(СС1-СС3) =0,053 и p(СС1-СС2) = 0,053.
Таблица 8
Частота встречаемости аллелей гена eNOS 786
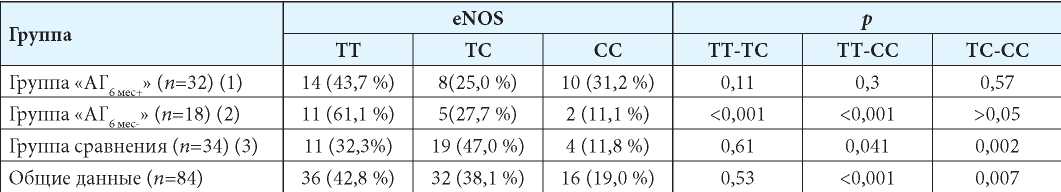
Примечания: p(ТТ1-ТТ3)=0,22; p(ТТ2-ТТ3)>0,05; р(ТТ1-ТТ2)=0,13; p(TС1-TС3)=0,03; p(TС2-TС3)=0,054; p(TС1-TС3)=0,43; p(СС1-СС3)=0,053; p(СС2-СС3)=0,94; p(СС1-СС2)=0,053.
Таким образом, по результатам непараметрического анализа вариаций у подростков с нутритивными нарушениями, САГ и отсутствием положительной динамики АД на фоне эффективного реабилитационного лечения в течение 6 месяцев (группа «АГ6мес+») более часто, чем у детей из группы сравнения (ГС) регистрировали артериальную гипертензию (АГ) у родственников и родственников 1-й линии родства (р=0,001 и р=0,05, соответственно). Генетический полиморфизм характеризовался большей частотой выявления гомозиготы АА/А гена рецептора 2-го типа для ангиотензина II (AGTR2: 1675 G>A), чем у детей в группе сравнения (р=0,004 и р=0,018, соответственно), а также гомозиготы СС для гена AGТ: 704, чем в группе сравнения (р<0,001). В то же время у подростков из группы «АГ6 мес-» не получено различий в наследственной отягощённости по АГ первой линии родства, полиморфизм генов AGTR2 и AGТ: 521 не имел отличий от здоровых детей, а по распространённости мутантной гомозиготы СС AGТ: 704 от детей группы «АГ6 мес+».
Для более дифференцированного освещения вопроса о взаимоотношениях изучаемых полиморфизмов в исследуемых группах было проведено одномоментное рассмотрение их соотношения в трёхмерном пространстве. С целью представления характера взаимного влияния между учитываемыми переменными, значимо различающимися в сформированных группах, был проведён анализ соответствий. В 2-мерном пространстве учитывались координаты, соответствующие кодам как переменных, так и групп. Первично учитывалась максимально объяснённая Инерция (Inertia) при достоверном разделении, как координат переменных, так и групп. Графическое представление для каждой ситуации учёта переменных представлено на диаграммах рассеяния. Линией разделения являлся координатный ноль.
По результатам анализа соответствий между полиморфизмами значимых генов и группами наблюдения получены следующие результаты. Переменная «ген ангиотензиногена» (AGT: 704 T>C) показала полное разделение кодов, соответствующих трём полиморфным аллелям при одномоментном разделении по переменной «группа» (при Инерции равной 67,32 %, х2 =6,57, df=4, p≤0,04) (рис. 1). Для кода 101 (группа сравнения), был более характерен гетерозиготный полиморфизм ТС и нормальный гомозиготный полиморфизм ТТ (на рисунке 1 группа сравнения (код 101) расположена в одном пространстве с аллелями ТТ и ТС выше линии 0), в то время как для групп «АГ6 мес-» (код 102) и «АГ6 мес+» (код 103), был характерен патологический гомозиготный полиморфизм СС, (на рис. 1 — коды 102 и 103 расположены в одном пространстве с аллелем СС, ниже линии 0), что говорит о том, что наличие патологического гомозиготного полиморфизма СС характерно для детей групп наблюдения «АГ6 мес-» и «АГ6 мес+».
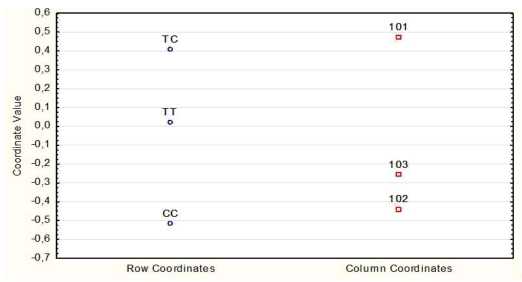
Рис. 1. Диаграмма рассеяния качественных значений и соответствий полиморфизма гена ангиотензиноген AGT: 704 T>C (Met235Thr) в пределах 3 рассматриваемых групп (авторы Маскова Г.С., Хохлов А.Л., 2020 г.)
Примечания: ТТ — нормальная гомозигота, ТС — гетерозигота, СС — мутантная гомозигота; координата в колонке: 101 — группа сравнения, 102 — «АГ6 мес-», 103 — «АГ6 мес+»
Анализ переменной ген ангиотензиноген (AGT:521С>T) по значению переменной показал полное разделение друг от друга кодов полиморфных аллелей, параллельно произошло разделение по переменной группа (при Инерции равной 83,61 %, х2=7,9, df=4, p>0,05). Для группы «АГ6 мес+» наибольшее сопряжение получено с гетерозиготой СТ и патологической гомозиготой ТТ, в то время как для группы «АГ6 мес-» выявлено большее сродство к нормальному гомозиготному аллелю СС.
Анализ переменной Рецептор 2-го типа для ангиотензина II (AGTR2: 1675 G>A) для девочек показал достоверное разделение друг от друга по значениям кодов полиморфных аллелей при одновременном разделении по переменной группа кода 101 (группа сравнения) от 102 («АГ6 мес-») и 103 («АГ6 мес+») при Инерции 100 %, х2=8,8, df=2, (p≤0,01) (рис. 2).
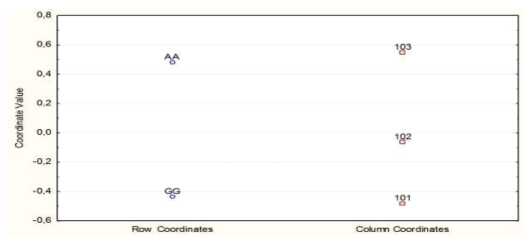
Рис. 2. Диаграмма рассеяния качественных значений и соответствий между полиморфизмом гена рецептора 2-го типа для ангиотензина II (AGTR2: 1675 G>A у девочек в пределах трёх рассматриваемых групп (авторы Маскова Г.С., Хохлов А.Л., 2020 г.)
Примечания: GG — нормальная гомозигота, АА — мутантная гомозигота, а координата в колонке:101 — группа сравнения, 102 — группа «АГ 6 мес-», 103 — группа «АГ 6 мес+»
Для группы «АГ6 мес+» у девочек было получено сопряжение с патологическим гомозиготным аллелем АА, в то время как для группы «АГ 6 мес-» и группы сравнения — к нормальному аллелю GG, хотя для группы детей «АГ 6 мес-» это сродство было выражено в меньшей степени. Аналогичные тенденции были установлены и для мальчиков по гемизиготам А и G.
Анализ переменной «эндотелиальная синтетаза оксида азота» (eNOS) (NOS3: -786 T>C) показал разделение друг от друга значения кодов, соответствующих полиморфным аллелям. Разделение по признаку «группа» показало разделение кода 101 (группа сравнения) от кодов 102 и 103 (группы наблюдения), при полном совпадении кодов 102 и 103 (при Инерции 79,17, х2=6,5, df=4, p>0,05), что говорит о сопряжении полиморфизма гетерозиготы к группе сравнения, а гомозигот ТТ и СС — к группам наблюдения. Для дифференциации преимущественного преобладания патологической и нормальной гомозиготы в группах наблюдения, нами проведён повторный анализ многомерного сравнения при меньшей Инерции 20,8, х2 =1,7, df=4, p>0,05, который показал чёткое разделение групп: «АГ6 мес+» — сродство к мутантной гомозиготе СС, а «АГ6 мес-» — сродство к нормальной гомозиготе ТТ (рис. 3).
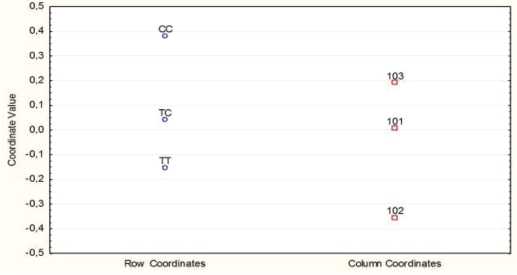
Рис. 3. Диаграмма рассеяния качественных значений и соответствий полиморфизма гена «эндотелиальная синтетаза оксида азота» (eNOS) (NOS3: -786 T>C) в пределах 3-х рассматриваемых групп (авторы Маскова Г.С., Хохлов А.Л., 2020 г.)
Примечания: ТТ — нормальная гомозигота, ТС — гетерозигота, СС — мутантная гомозигота; координата в колонке: 101 — группа сравнения, 102 — группа «АГ6 мес-» и 103 — группа «АГ6 мес+».
Обсуждение
Проведенный комплексный анализ позволил установить у детей с ОЖ и САГ при отсутствии эффекта снижения АД после немедикаментозной реабилитации большее сродство мутантной гомозиготы СС для ангиотензиногена AGT: 704 T> C (Met235Thr), гетерозиготны СТ для ангиотензиногена 521 (AGT:521С> T), преобладание мутантных гомозиготных аллелей гена AGTR2 АА(А) для гена AGTR2 для девочек и мальчиков и мутантной гомозиготы СС для эндотелиальной синтетазы оксида азота 786 (eNOS) (NOS3: -786 T>C), чем у детей с эффектом снижения АД под влиянием лечения и у детей без нутритивных нарушений (группа сравнения). Генетический полиморфизм детей с ожирением и САГ, у которых удалось добиться снижения АД в ходе реабилитационного лечения, был представлен в большей степени нормальными гомозиготными аллелями для гена ангиотензиногена AGT:521; рецептора 2-го типа для ангиотензина II AGTR2: 1675 и эндотелиальной синтетазы оксида азота 786 (eNOS), что сближало их с детьми группы сравнения, однако по сродству мутантной гомозиготной аллели СС гена ангиотензиноген 704 (AGT: 704 T>C (Met235Thr)) эти дети не отличались от детей, у которых не было достигнуто эффекта снижения АД, но достоверно отличились от группы сравнения.
Таким образом, у подростков с ожирением и систолической артериальной гипертензией, у которых на фоне общей эффективности реабилитации в течение 6-месячного периода лечения сохранилось повышенное АД (группа «АГ6 мес+»), распространённость полиморфизмов генов АГ отличалась от полиморфизмов генов у подростков из группы сравнения и подростков с ожирением и систолической артериальной гипертензией, у которых на фоне общей эффективности реабилитации в течение 6 месячного периода лечения снизился уровень АД (группа «АГ6 мес-»).
Определена высокая частота носительства мутантных гомозиготных генов — кандидатов АГ у подростков группы «АГ6 мес+», что может быть фактором риска поддержания артериальной гипертензии, даже при условии оптимизации нутритивного статуса в ходе немедикаментозного реабилитационного лечения. Данный аргумент позволяет персонализировано и патогенетически обосновано оценивать риски сохранения артериальной гипертензии, учитывая имеющийся генетический полиморфизм и обосновывать рекомендации по дальнейшей тактике ведения детей, в том числе и решение вопроса о назначении и выборе антигипертензивной терапии. Актуальность этого вопроса разделяют ведущие российские детские кардиологи, которые считают необходимым «расширение показаний к использованию в педиатрии основных групп гипотензивных лекарственных средств, применяемых у взрослых и необходимость выведения этих препаратов из категории «off -label», то есть необходимо внесение соответствующих изменений в инструкции по медицинскому применению» [3].
Заключение
Реабилитация детей с ожирением предполагает не только снижение массы тела, но коррекцию коморбидных с ним состояний, в том числе артериальной гипертензии. Полиморфизм генов АГ можно рассматривать в качестве фактора риска поддержания повышенного сосудистого тонуса, даже при условии оптимизации нутритивного статуса ребёнка. Подростков 11—14 лет с ожирением и стойкой артериальной гипертензией на фоне улучшения нутритивного статуса под влиянием реабилитационного лечения через 6 месяцев следует относить в группу высокого риска формирования стабильной артериальной гипертензии в связи с установленным у них высоким распространением мутантных гомозиготных аллелей генов артериальной гипертензии гомозиготы СС для ангиотензиногена AGT: 704 T>C (Met235Thr), гетерозиготы СТ для ангиотензиногена 521 (AGT:521С>T), мутантных гомозиготных аллелей АА(А) для гена AGTR2 для девочек и мальчиков и полиморфизма СС для эндотелиальной синтетазы оксида азота 786 (eNOS) (NOS3: -786 T>C).
Ограниченность исследования. Результаты проведённого исследования имеют ограниченность интерпретации в связи с проведением в небольшой выборке детей и отсутствием более длительного катамнестического наблюдения. Требуют продолжения исследования, связанные с сопоставлением различных вариантов полиморфизма генов АГ у детей с ожирением в зависимости от возраста старта АГ, стабильности повышенного сосудистого тонуса и возможности обратимости изменений.
Благодарность. Выражаем благодарность врачу клинической лабораторной диагностики ЧУЗ «Клиническая больница «РЖД-Медицина» г. Ярославль» Царевой И.Н. за проведение генетических исследований.
Список литературы
1. Flynn JT, Kaelber DC, Baker-Smith CM et al. Subcommittee on Screening and Management of High Blood Pressure in Children. Clinical Practice Guideline for Screening and Management of High Blood Pressure in Children and Adolescents. Pediatrics. 2017;140(3): e20171904 DOI: 10.1542/peds.2017-1904
2. Lurbe E, Cifkova R, Cruickshank JK et al. Management of high blood pressure in children and adolescents: recommendations of the European Society of Hypertension. J Hypertens. 2009; 27:1719-42; DOI: 10.1097/HJH.0b013e32832f4f6b.
3. Леонтьева И.В. Лечение артериальной гипертензии у детей и подростков // Росcийский вестник перинатологии и педиатрии. — 2019. — Т.64. — №1. — С.15-24. [Leontyeva IV. Treatment of hypertension in children and adolescents. Rossiyskiy vestnik perinatalogii i pediatrii. 2019; 64:(1):15-24 (In Russ).]. DOI: 10.21508/1027—4065—2019—64—1—15—24
4. Koebnick C, Black MH, Wu J et al. High blood pressure in overweight and obese youth: Implications for screening. Journal of Clinical Hypertension. 2013;15(11):793-805. DOI: org/10.1111/jch.12199
5. Skinner AC, Perrin EM, Moss LA, Skelton JA. Cardiometabolic risks and severity of obesity in children and young adults. N Engl J Med. 2015;373(14):1307-1317. DOI: 10.1056/NEJMoa1502821
6. Куприенко Н.Б., Смирнова Н.Н. Распространенность артериальной гипертензии у детей школьного возраста с избыточной массой тела и ожирением // Профилактическая и клиническая медицина. — 2020. — Т.75. — №2. — С.64-69. [Kuprienko NB, Smirnova NN. Рrevalence of hypertension in school-age children with overweight and obesity. Preventive and clinical medicine. 2020;75(2):64-69. (In Russ).].
7. Бокова Т.А., Лукина Е.В. Артериальная гипертензия у детей и подростков с ожирением: современные подходы к профилактике и лечению // Практика педиатра. — 2015. — № 4. — С.16-20. [Bokova TA, Lukina EV. Arterial’naya gipertenziya u detej i podrostkov s ozhireniem: sovremennye podhody k profilaktike i lecheniyu. Praktika pediatra. 2015;(4):16-20. (In Russ).].
8. Маскова Г.С., Черная Н.Л., Нагорнова Э.Ю. и др. Функция эндотелия плечевой артерии у подростков с ожирением в зависимости от степени выраженности клинико-трофологических и метаболических нарушений // Кардиология.— 2014. — Т.54. — №2. — С.31-35. [Maskova GS, Chernaya NL, Nagornova EY et al. Funkciya endoteliya plechevoj arterii u podrostkov s ozhireniem v zavisimosti ot stepeni vyrazhennosti klinikotrofologicheskih i metabolicheskih narushenij. Kardiologiya. 2014;54(2):31-35. (In Russ).]. DOI: 10.18565/cardio.2014.2.31-36
9. Kelly RK, Thomson R, Smith KJ et al. Factors Affecting Tracking of Blood Pressure from Childhood to Adulthood: The Childhood Determinants of Adult Health Study. J Pediatr. 2015 Dec;167(6):1422-8. e2. DOI: 10.1016/j.jpeds.2015.07.055
10. Приказ Министерства здравоохранения РФ от 24 апреля 2018 г. N 186 «Об утверждении Концепции предиктивной, превентивной и персонализированной медицины»[Order of the Ministry of health of the Russian Federation of April 24, 2018 N 186 «Ob utverzhdenii Koncepcii prediktivnoj, preventivnoj i personalizirovannoj mediciny» (In Russ).]. Доступно по: https://nop2030.ru/dokumenty/prikaz-ministerstva-zdravoohraneniyarf-ot-24-aprelya-2018-g-n-186-ob-utverzhdenii-kontseptsii-prediktivnojpreventivnoj-i-personalizirovannoj-meditsiny/ Ссылка активна на 21.09.2020.
11. Хохлов А.Л. Персонализированные подходы к лечению заболеваний, связанных с нарушениями липидного обмена и атеросклерозом. — М.: Технополис; 2016. — 428 с. [Khokhlov AL. Personalizirovannye podhody k lecheniyu zabolevanij, svyazannyh s narusheniyami lipidnogo obmena i aterosklerozom. Moscow: Tekhnopolis; 2016. (In Russ).].
12. Лифшиц Г.И., Кох Н.В, Киреева В.В. и др. Некоторые молекулярно-генетические механизмы формирования ожирения и метаболического синдрома // Фармакогенетика и Фармакогеномика. — 2017. — №1.— С.5-9. [Lifshits GI, Kokh NV, Kireeva VV, et al. Some molecular genetic mechanisms of the obesity and metabolic syndrome. Pharmacogenetics and Pharmacogenomics. 2017;(1):5-9. (In Russ).].
13. Ковтун О.П., Устюжанина М.А. Полиморфизм генов PPARG (P12A), APOA1 (G75A) и APOE (C112A и A158C) у детей с ожирением и артериальной гипертензией: исследование «случай—контроль» // Вопросы современной педиатрии. — 2018. — Т.17. — № 4. — С.307-315. [Kovtun OP, Ustyuzhanina MA. Polymorphism of PPARG (P12A), APOA1 (G75A), and APOE (C112A and A158C) Genes in Children with Obesity and Arterial Hypertension: A Case-Control Study. Current Pediatrics. 2018;17(4):307-315. (In Russ).]. DOI.org/10.15690/vsp.v17i4.1924
14. Шевченко О.В., Свистунов А.А., Бородулин В.Б. и др. Генетические основы патогенеза эссенциальной артериальной гипертензии (обзор) // Саратовский научно-медицинский журнал. —2011. — Т.7. — №1. — С.83-87. [Shevchenko OV, Svistunov AA, Borodulin VB et al. Genetic pathogenesis of essential arterial hypertension (the review). Saratov Journal of Medical Scientific Research. 2011; 7(1):83-87. (In Russ).].
15. Поздняков, Н.О., Хохлов А.Л. Полиморфизм гена eNOS: распространённость и связь с заболеваниями // Фарматека. — 2015. — №13. — С.21-24. [Pozdnyakov NO, Khokhlov AL. eNOS gene polymorphism: prevalence and association with disease. Farmateka. 2015;(13):21-24. (In Russ).].
16. Хромова А.В., Феликсова О.М., Куба А.А., Бебякова Н.А. Анализ влияния структурной перестройки промотора гена NOS3 на продукцию вазоактивных эндотелиальных факторов // Вестник Северного (Арктического) федерального университета. Серия «Медико-биологические науки». — 2015. — №4. — С.107-115. [Khromova AV, Feliksova OM, Kuba AA, Bebyakova NA. The effect of structural adjustment in NOS3 gene promoter on the production of endothelium-derived vasoactive factors. Vestnik Severnogo (Arkticheskogo) federal’nogo universiteta. Seriya “Mediko-biologicheskie nauki”. 2015(4):107-115. (In Russ).]. DOI 10.17238/issn2308-3174.2015.4.107
17. Wang HJ, Hinney A, Song JY et al. Association of common variants identified by recent genome-wide association studies with obesity in Chinese children: a case-control study. BMC Med Genet. 2016;17:7. DOI: 10.1186/s12881-016-0268-4
18. Левицкий С.Н., Первухина О.А., Бебякова Н.А. Роль полиморфизма генов ренин-ангиотензиновой системы в формировании сердечно-сосудистой патологии // Вестник Северного (Арктического) федерального университета. Серия «Медико-биологические науки. — 2016. — №4. — С.30-39. [Levitskiy SN, Pervukhina OA, Bebyakova NA. The role of gene polymorphisms of the renin-angiotensin system in the formation of cardiovascular pathology. Vestnik Severnogo (Arkticheskogo) federal’nogo universiteta. Seriya “Mediko-biologicheskie nauki”. 2016;(4):30-39. (In Russ).]. DOI: 10.17238/issn2308-3174.2016.4.30
19. Маскова Г.С., Ганузин В.М. Врачебная профессиональная консультация подростков с артериальной гипертензией как фактор профилактики сердечно-сосудистых нарушений у взрослых // Практическая медицина. Педиатрия. — 2017. — Т.111. — №10. — С.67-71. [Maskova GS, Ganuzin VM. Medical professional consultation to adolescents with arterial hypertension as a factor of cardiovascular disorders prevention in adults. Prakticheskaya medicina. Pediatriya. 2017;111(10):67-71. (In Russ).].
20. Артериальная гипертензия у детей. Клинические рекомендации. 2016. ID: КР571. [Pediatric Hypertension. Federal Clinical guidelines. 2016. ID: КР571. (In Russ).]. Доступна по: http://cr.rosminzdrav.ru//recomend/814. Ссылка активна на 03.09.2020
21. Агапитов Л.И., Черепнина И.В. Диагностика и лечение артериальной гипертензии у детей и подростков в свете новых клинических рекомендаций Американской академии педиатрии // Российский вестник перинатологии и педиатрии. — 2019. — Т.64. — №4. — С.114-127. [Agapitov LI, Cherepnina IV. Diagnostics and treatment of arterial hypertension in children and adolescents, overview of new clinical guidelines of the American Academy of Pediatrics. Ros Vestn Perinatol i Pediatr. 2019; 64:(4): L.I. Agapitov, I.V. Cherepnina114—127 (In Russ).]. DOI: 10.21508/1027—4065—2019—64—4—114—127
22. Santiago Cuevas, Van Anthony M. Villar, Pedro A. Jose. Genetic Polymorphisms Associated with Reactive Oxygen Species and Blood Pressure Regulation. The Pharmacogenomics Journal. 2019 Aug; 19(4):315—336. DOI: 10.1038/s41397-019-0082-4
23. Jira M, Zavodna E, Honzikova N et al. Association of eNOS gene polymorphisms T-786C and G894T with blood pressure variability in man. Physiol Res. 2011;60(1):193-7. DOI: 10.33549/physiolres.931887
24. Хохлов А.Л. Полиморфизм генов eNOS и AGTR2 как фактор риска развития ишемической болезни сердца // Проблемы стандартизации в здравоохранении. — 2015. — №9-10. — С.46-50. [Khokhlov AL. Gene polymorphism eNOS and AGTR2 as a risk factor for the development of coronary heart disease. Journal of Standardization Problems in Health Care. 2015;(9-10):46-50 (In Russ).].
Об авторах
Г. С. МасковаРоссия
Маскова Галина Станиславовна - к. м. н., доцент кафедры педиатрии ИПДО
SPIN-код: 4980-8245
Ярославль
А. Л. Хохлов
Россия
Хохлов Александр Леонидович - д. м. н., профессор, член-корр. РАН, зав. кафедрой клинической фармакологии
SPIN-код: 9389-8926
Ярославль
А. М. Сироткина
Россия
Сироткина Альфия Михайловна - к.м.н., доцент, заведующая кафедрой терапии педиатрического факультета
SPIN-код: 1019-0752
Ярославль
Рецензия
Для цитирования:
Маскова Г.С., Хохлов А.Л., Сироткина А.М. Полиморфизм генов артериальной гипертензии у детей с ожирением и артериальной гипертензией. Качественная клиническая практика. 2020;(5):70-79. https://doi.org/10.37489/2588-0519-2020-5-70-79
For citation:
Maskova G.S., Khokhlov A.L., Sirotkina A.M. Polymorphism of genes of arterial hypertension among children with obesity and arterial hypertension. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2020;(5):70-79. (In Russ.) https://doi.org/10.37489/2588-0519-2020-5-70-79
















































