Перейти к:
Реализация количественного интегрального анализа при оценке нежелательных явлений при проведении клинических исследований: в фокусе трастузумаб
https://doi.org/10.37489/2588-0519-2024-4-21-34
EDN: ZEWDXG
Аннотация
Авторским коллективом разработана методика углублённого изучения безопасности фармакотерапии на основе количественного интегрального анализа нежелательных явлений в рамках проведения клинических исследований. Методика была апробирована на данных, полученных в рамках исследования биоэквивалентности лекарственного средства трастузумаб. Интеграция данной методологии позволит выйти на риск-ориентированный подход при назначении лекарственной терапии в рамках реальной клинической практики и минимизировать последствия потенциально токсичных медикаментов. Таким образом, алгоритм, предложенный авторским коллективом в рамках данной статьи, позволит персонализировано подходить к фармакотерапии пациентов.
Цель работы. Практическая реализация разработанных авторами подходов к индивидуализированной оценке безопасности фармакотерапии на основе количественного интегрального анализа нежелательных явлений.
Материалы и методы. Методика представляет собой пятиэтапный алгоритм модификации сведений, полученных в отношении зарегистрированных нежелательных явлений при проведении клинических исследований. Последующая интегральная оценка нежелательных явлений лекарственных средств, в рамках которой каждому из событий присваивается определённый балл, весовой коэффициент с последующей агрегацией данных для получения интегрального показателя на системно-органном и организменном уровнях.
Выводы. Предлагаемые авторами статьи алгоритмы для системного анализа нежелательных явлений, связанных с применением трастузумаба позволяют спрогнозировать безопасность назначаемой фармакотерапии, и, в перспективе перейти к риск-ориентированному подходу при применении данного лекарственного средства на пострегистрационном этапе.
Ключевые слова
Для цитирования:
Верведа А.Б., Василюк В.Б., Сыраева Г.И., Фарапонова М.В., Попов А.В. Реализация количественного интегрального анализа при оценке нежелательных явлений при проведении клинических исследований: в фокусе трастузумаб. Качественная клиническая практика. 2024;(4):21-34. https://doi.org/10.37489/2588-0519-2024-4-21-34. EDN: ZEWDXG
For citation:
Verveda A.B., Vasilyuk V.B., Syraeva G.I., Faraponova M.V., Popov A.V. Implementation of quantitative integral analysis in assessing events associated with safety issues during clinical trials: focusing on trastuzumab. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2024;(4):21-34. (In Russ.) https://doi.org/10.37489/2588-0519-2024-4-21-34. EDN: ZEWDXG
Введение / Introduction
По информации Государственного Реестра Лекарственных Средств Российской Федерации ежегодно по международному непатентованному наименованию (МНН) «трастузумаб» одобряется от 7 до 20 клинических исследований различных фаз и дизайнов1. С одной стороны, это говорит о том, что онкологическая заболеваемость остаётся на относительно высоком уровне, с другой — что существующая необходимость в лекарственном обеспечении населения является приоритетной задачей отечественных фармацевтических компаний. Трастузумаб представляет собой рекомбинантное моноклональное антитело, разработанное для распознавания p185HER2. Для снижения иммуногенности, антитело было гуманизировано, что позволило максимизировать потенциал рекрутирования эндогенных иммунных эффекторных клеток. Особенности структуры данного МНН определяют сложность как первоначального синтеза, так и воспроизведения трастузумаба, что находит своё отражение при проведении клинических исследований с оценкой фармакокинетических параметров и вопросов, ассоциированных с вопросами безопасности.
Для обоснованной интерпретации результатов клинических исследований, на наш взгляд, недостаточно использовать только общепринятые качественные оценки с использованием статистических критериев при сопоставлении отдельных групповых показателей, например, нежелательных явлений (НЯ). В качестве критериев принятия решений целесообразно применять интегральные количественные, обладающие определённой мерой признаки. Важно отметить, что количественная оценка подразумевает анализ не только групповых, но и индивидуальных данных, что существенно повышает релевантность заключений по итогам проведённых исследований.
Цель работы / Objective
Практическая реализация разработанных авторами подходов к индивидуализированной оценке безопасности фармакотерапии на основе количественного интегрального анализа нежелательных явлений.
Материалы и методы / Materials and methods
Представлена реализация разработанного авторами методического подхода к оценке безопасности на основе количественного интегрального анализа НЯ [1], представляющего собой адаптацию нечёткой логики к сфере клинических исследований [2][3]. Приведена поэтапная индивидуализированная оценка НЯ по результатам клинических исследований препарата трастузумаб.
На этапе определения весовых коэффициентов был проведён экспертный опрос для оценки важности отдельных характеристик НЯ с использованием метода анализа иерархий (МАИ). Методология МАИ была реализована экспертами — членами Независимого Комитета по мониторингу данных (НКМД / Independent Data Monitoring Committee), организованного на базе ООО «Научно-исследовательский центр Эко-безопасность». В соответствии с международными требованиями (в частности, в Руководстве Международной конференции по гармонизации E6 (6), раздел 5.5)2 НКМД должен оценивать ход исследования как с точки зрения безопасности, так и эффективности, и должен давать рекомендации спонсору относительно продолжения, модификации или прекращения исследования. В руководстве E9 (5) говорится, что НКМД должен иметь письменные операционные процедуры; он должен вести отчёты о своих заседаниях и промежуточных результатах, которые он рассматривал. В конце исследования эти записи позволяют исследователям, спонсору и регулирующим органам оценить основания для решений НКМД. В руководстве подчёркивается, что независимость комитета, контролирующая обмен информацией о сравнительных группах, защищает целостность исследования от негативного влияния доступа к информации о текущем исследовании. НКМД, созданный на базе ООО «Научно-исследовательский центр Эко-безопасность» полностью соответствует всем заявленным требованиям.
По результатам выполнения всех этапов индивидуализированной оценки НЯ показана возможность установления отдельных добровольцев с неблагоприятными отклонениями в состоянии здоровья. Проведена углублённая оценка нежелательных явлений на основе интегрального индивидуального показателя безопасности на системно-органном и организменном уровнях.
Рассчитывали следующие описательные статистики интегральных групповых показателей НЯ — среднее арифметическое (M), стандартное отклонение (SD), медиана (Me), верхняя (UQ) и нижняя (LQ) квартили. Также приводили численность группы (N), минимальные (Min) и максимальные (Max) значения показателя.
Частоты встречаемости в тексте представлены в виде абсолютной частоты (n), относительной частоты (%), а также представлена численность группы (N).
Реализация основных этапов проведения клинического исследования для оценки безопасности препарата трастузумаб методом количественного интегрального анализа
Дизайн исследования был разработан с учётом как российских рекомендаций по проведению исследований первой фазы3 4 5. Данное исследование предполагало двойной слепой рандомизированный дизайн в параллельных группах с использованием в качестве активного контроля лекарственного препарата с доказанной эффективностью (стандартом) направлен на подтверждение эквивалентности фармакокинетического профиля биоподобного исследуемого препарата трастузумаб.
Клинический этап исследования биоэквивалентности был проведён на базе центра ООО «Научно-исследовательский центр Эко-безопасность» в период с 10 октября 2022 г. по 27 июня 2023 г. Всего было скринировано 95 человек, из которых 84 здоровых добровольца мужского пола в возрасте от 18 до 45 лет (включительно) были отобраны в соответствии с критериями включения (по 42 в каждой группе). Все субъекты завершили участие в исследовании согласно протоколу, за исключением трёх субъектов, которые досрочно завершил участие в исследовании.
На каждом из этапов добровольцы были госпитализированы в клинический центр, все процедуры были стандартизированы, их выполнение контролировалось сотрудниками исследовательского центра. Получение препарата и манипуляции с кровью проводились в одинаковых условиях (включая, но не ограничиваясь, использованием одинакового типа и производства внутривенных катетеров, игл, одинаковых систем дезинфекции, типов лабораторных и транспортных пробирок, морозильных камер и т. д.). Все добровольцы из обеих групп получали одинаковую пищу в каждом из периодов госпитализации, соблюдался единый интервал времени между периодами.
Количественный интегральный анализ безопасности включал 5 основных этапов.
Этап 1 — присвоение каждой из характеристик НЯ балльной оценки
В ходе клинического исследования препарата трастузумаб в соответствии с протоколом были оценены следующие характеристики НЯ: серьёзность, степень тяжести («тяжесть»), наличие связи с исследуемым препаратом («связь»), предпринятые меры («лечение»), предпринятые меры в отношении препарата («препарат») и исход явления («исход»). Дополнительно к требованиям протокола в настоящем исследовании анализировали количество НЯ у одного добровольца («количество»). Принимая во внимание, что в ходе клинического исследования серьёзные нежелательные явления (СНЯ) не были зарегистрированы, представленная характеристика не была включена в дальнейший анализ.
Присвоенные унифицированные балльные оценки для каждой из анализируемых характеристик, ранжированные по порядку возрастания уровня потенциального неблагоприятного воздействия на организм, приведены в табл. 1. Для описания характеристики НЯ добровольцев, у которых нежелательные явления не зарегистрированы, введена категория «отсутствует».
Таблица 1
Балльные оценки характеристик нежелательных явлений по результатам клинических исследований препарата трастузумаб
Table 1
Scores for characteristics of adverse events based on the results of clinical trials of trastuzumab
|
Характеристика НЯ / Characteristics of AEs |
Описание характеристики / Description of characteristics |
Балльная оценка / Score |
|
Тяжесть/Severity |
Отсутствует/Not available |
4 балла/points |
|
Легкая/Mild |
3 балла/points |
|
|
Умеренная/Moderate |
2 балла/points |
|
|
Тяжелая/Severe |
1 балл/point |
|
|
Связь/Relation |
Отсутствует/None |
4 балла/points |
|
Сомнительная/Remote |
3 балла/points |
|
|
Возможная/Possible |
2 балла/points |
|
|
Определенная/Certain |
1 балл/point |
|
|
Лечение/Treatment |
Отсутствует/None |
3 балла/points |
|
Не предпринималось/Not available |
2 балла/points |
|
|
Медикаментозная терапия/Medication therapy |
1 балл/point |
|
|
Препарат/Study drug |
Отсутствует/None |
3 балла/points |
|
Действий не требуется/No action required |
2 балла/points |
|
|
Назначение другого лечения/Prescribing another treatment |
1 балл/point |
|
|
Исход/Outcome |
Отсутствует/None |
3 балла/points |
|
НЯ разрешилось/AE resolved |
2 балла/points |
|
|
НЯ не разрешилось/AE not resolved |
1 балл/point |
|
|
Количество/Quantity |
Отсутствует/None |
4 балла/points |
|
1 НЯ/1 AE |
3 балла/points |
|
|
2 НЯ/2 AEs |
2 балла/points |
|
|
3 НЯ/3 AEs |
1 балл/point |
Примечание: НЯ — нежелательное явление.
Note: AE — Adverse Event.
Этап 2 — преобразование балльных оценок в нормированную количественную шкалу
Для решения проблемы валидной интеграции балльных оценок с учётом допустимых преобразований данного вида шкал использовали перевод порядковых признаков в нечёткое число с помощью аппарата теории нечётких множеств и применение функций принадлежности (ФП) нечётких множеств [4]. ФП устанавливает соответствие между элементами универсального множества U = {u1, u2,…, un} и числовыми значениями их степеней принадлежности некоторому новому множеству A µA (u) на отрезке [ 0, 1]. Для построения ФП использовали апостериорный подход [5]:
- каждая характеристика НЯ разбивалась на уровни, соответствующие балльным оценкам;
- для каждой балльной оценки подсчитывали число объектов, имеющих данный уровень (рассчитывали относительную частоту встречаемости);
- ФП строили таким образом, чтобы площади фигур, ограниченных этими функциями и осью абсцисс, соответствовали относительной частоте попадания объектов выборки в заданный интервал.
На основе подходов, представленных в работе [2], строили трапециевидные ФП для каждого из уровней (баллов) характеристик НЯ. Трапециевидная ФП описывается четырьмя основными точками: µ (х) = (k1, k2, k3, k4), где k2 и k3 — граничные значения интервала, на котором ФП принимает значение, равное 1, а точки k1 и k4 — левый и правый нуль функции, соответственно.
Результаты построения трапециевидных ФП для различных уровней (баллов) основных характеристик НЯ представлены в табл. 2.
Таблица 2
Основные точки функций принадлежности балльных оценок характеристик нежелательных явлений
Table 2
Main points of membership functions of scores for adverse event characteristics
|
Характеристика НЯ / Characteristics of AEs |
Балльная оценка / Score |
Частота встречаемости / Occurrence Frequency |
Координаты точек ФП / Coordinates of points of membership functions (k1; k2; k3; k4) |
|
Тяжесть/Severity |
4 балла/points |
0,486 |
(0,284; 0,743; 1,000; 1,000) |
|
3 балла/points |
0,459 |
(0,036; 0,072; 0,284; 0,743) |
|
|
2 балла/points |
0,036 |
(0,009; 0,027; 0,036; 0,072) |
|
|
1 балл/point |
0,018 |
(0,000; 0,000; 0,009; 0,027) |
|
|
Связь/Relation |
4 балла/points |
0,486 |
(0,495; 0,532; 1,000; 1,000) |
|
3 балла/points |
0,036 |
(0,459; 0,495; 0,495; 0,532) |
|
|
2 балла/points |
0,090 |
(0,342; 0,432; 0,459; 0,495) |
|
|
1 балл/point |
0,387 |
(0,000; 0,000; 0,342; 0,432) |
|
|
Лечение/Treatment |
3 балла/points |
0,486 |
(0,270; 0,757; 1,000; 1,000) |
|
2 балла/points |
0,486 |
(0,014; 0,041; 0,270; 0,757) |
|
|
1 балл/point |
0,027 |
(0,000; 0,000; 0,014; 0,041) |
|
|
Препарат/Study drug |
3 балла/points |
0,486 |
(0,270; 0,757; 1,000; 1,000) |
|
2 балла/points |
0,486 |
(0,014; 0,041; 0,270; 0,757) |
|
|
1 балл/point |
0,027 |
(0,000; 0,000; 0,014; 0,041) |
|
|
Исход/Outcome |
3 балла/points |
0,486 |
(0,270; 0,757; 1,000; 1,000) |
|
2 балла/points |
0,514 |
(0,000; 0,000; 0,270; 0,757) |
|
|
1 балл/point |
0 |
(0,000; 0,000; 0,000; 0,000) |
|
|
Количество/Quantity |
4 балла/points |
0,643 |
(0,292; 0,423; 1,000; 1,000) |
|
3 балла/points |
0,131 |
(0,161; 0,292; 0,292; 0,423) |
|
|
2 балла/points |
0,131 |
(0,048; 0,143; 0,161; 0,292) |
|
|
1 балл/point |
0,095 |
(0,000; 0,000; 0,048; 0,143) |
Примечания: НЯ — нежелательное явление; ФП — функция принадлежности.
Notes: AE — Adverse Event.
Для получения из ФП количественных показателей (чёткой оценки) балла проведена процедура дефаззификации центроидным способом по формуле (1):
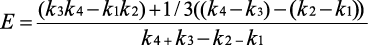 , (1)
, (1)
Полученные чёткие оценки (центроид Е) подверглись процедуре нормализации с использованием способа «отношение» (деление исходных значений на максимальное значение Е) [6]. В результате нормализации данные, имеющие максимальный балл (4 балла или 3 балла), т. е. отнесённые к категории «отсутствует», получили числовую оценку «1» (табл. 3).
Таблица 3
Результаты преобразования функций принадлежности балльных оценок в нормализованные значения на отрезке [ 0, 1]
Table 3
Results of transforming membership functions of point estimates into normalized values on the segment [ 0, 1]
|
Характеристика НЯ/Characteristics of AEs/ |
Балльная оценка/Score |
Центроид/Center/Е |
Нормализованная четкая оценка/Normalized clear evaluation (En) |
|
Тяжесть/Severity |
4 балла/points |
0,739 |
1,000 |
|
3 балла/points |
0,302 |
0,409 |
|
|
2 балла/points |
0,037 |
0,050 |
|
|
1 балл/point |
0,010 |
0,013 |
|
|
Связь/Relation |
4 балла/points |
0,757 |
1,000 |
|
3 балла/points |
0,495 |
0,670 |
|
|
2 балла/points |
0,429 |
0,581 |
|
|
1 балл/point |
0,195 |
0,263 |
|
|
Лечение/Treatment |
3 балла/points |
0,737 |
1,000 |
|
2 балла/points |
0,290 |
0,393 |
|
|
1 балл/point |
0,015 |
0,020 |
|
|
Препарат/Study drug |
3 балла/points |
0,737 |
1,000 |
|
2 балла/points |
0,290 |
0,393 |
|
|
1 балл/point |
0,015 |
0,020 |
|
|
Исход/Outcome |
3 балла/points |
0,737 |
1,000 |
|
2 балла/points |
0,290 |
0,393 |
|
|
1 балл/point |
0,015 |
0,020 |
|
|
Количество/Quantity |
4 балла/points |
0,678 |
1,000 |
|
3 балла/points |
0,292 |
0,431 |
|
|
2 балла/points |
0,163 |
0,241 |
|
|
1 балл/point |
0,051 |
0,076 |
Примечания: НЯ — нежелательное явление; ФП — функция принадлежности.
Note: AE — Adverse Event.
Этап 3 — определение весовых коэффициентов характеристик НЯ
Для определения весовых коэффициентов характеристик НЯ была организована процедура экспертного опроса. В опросе принимали участие 7 экспертов — членов НКМД, организованного на базе ООО «Научно-исследовательский центр Эко-безопасность».
На первой стадии экспертами было проведено ранжирование характеристик НЯ по признаку информативности для оценки «неблагоприятности» НЯ. Ранги использовали для анализа согласованности мнений экспертов. Проводили два этапа получения рангов с дополнительными пояснениями задач экспертного опроса, во время которых удалось повысить показатели согласованности — коэффициент конкордации вырос с 0,402 (р = 0,038) до 0,899 (р = 0,001). Результаты ранжирования использовали на второй стадии экспертного опроса для получения допустимых отношений согласованности (ОС) при помощи теста Саати.
Непосредственную оценку информативности (веса) каждой характеристики НЯ осуществляли на второй стадии экспертного опроса методом парных сравнений (тест Саати) [8]. Для реализации метода строится матрица парных сравнений, которая представляет собой квадратную, обратно симметричную матрицу, на главной диагонали которой стоят единицы. Значения элементов матрицы от 1 до 9 отображают девять степеней важности одной характеристики НЯ по сравнению с другими. Шкала парных сравнений представлена в табл. 4.
Таблица 4
Шкала парных сравнений
Table 4
Scale of paired comparisons
|
Оценка важности/Score importance |
Качественная оценка/Qualitative assessment |
Описание для прямой и обратной матрицы, количественный аналог/Description for direct and inverse matrix, quantitative analogue |
|
1 |
Одинаковая значимость/ Equal importance |
Данный признак (характеристика) имеет одинаковый ранг с другими не очень ценными признаками / This feature (characteristic) has the same rank as other not very valuable features |
|
3 |
Слабое превосходство/Weak superiority |
Соображения о предпочтении одной альтернативы другой малоубедительны, но есть менее значимые признаки / Considerations about the preference of one alternative over another are unconvincing, but there are less significant signs: — немного лучше, важнее / a little better, more important (3); — немного хуже, менее важно/ a little worse, less important (1/3) |
|
5 |
Сильное (или существенное) превосходство/Strong (or significant) superiority |
Имеются надежные доказательства существенного превосходства одной альтернативы / There is reliable evidence of significant superiority of one alternative: — лучше, важнее / better, more important (5); — хуже, менее важно / worse, less important (1/5) |
|
7 |
Очевидное превосходство/ Obvious superiority |
Существует убедительное свидетельство в пользу одной альтернативы / There is compelling evidence in favor of one alternative: — значительно лучше, важнее / much better, more important (7); — значительно хуже, менее важно / much worse, less important (1/7) |
|
9 |
Абсолютное превосходство/ Absolute superiority |
Свидетельство в пользу предпочтения одной альтернативы перед другой в высшей степени убедительно / The evidence for favoring one alternative over another is highly compelling: — принципиально лучше, важнее / fundamentally better, more important (9); — принципиально хуже, менее важно / fundamentally worse, less important (1/9) |
|
2, 4, 6, 8 |
Промежуточные значения между соседними оценками/Intermediate values between neighboring estimates |
Используются, когда необходим компромисс / Used when compromise is necessary |
Процедура обработки данных с использованием метода парных сравнений приведена в различных работах, в частности [8], поэтому подробно не представлена в настоящей. Результатом проведения расчётов являлось получение нормализованного собственного вектора матрицы парных сравнений, значения которого являются весовыми коэффициентами для характеристик НЯ. Пропорциональность предпочтений каждого эксперта оценивали на основе отношения согласованности (ОС), которое для 6 экспертов было менее 10 % и у одного эксперта — 17 %, что считается приемлемым уровнем.
Результаты усреднения данных (среднее геометрическое значение) экспертного опроса представлены в табл. 5.
Таблица 5
Результаты оценки информативности (веса) анализируемых характеристик НЯ
Table 5
Results of assessing the information content (weight) of the analyzed characteristics of AEs
|
Характеристика НЯ / Characteristics of AEs |
Вес / Weight (ωi) |
|
Лечение/Treatment |
0,400 |
|
Тяжесть/Severity |
0,289 |
|
Связь/Relation |
0,113 |
|
Препарат/Study drug |
0,095 |
|
Исход/Outcome |
0,035 |
|
Количество/Quantity |
0,070 |
Примечание: НЯ — нежелательное явление.
Note: AE — Adverse Event.
Этап 4 — агрегация данных для получения интегрального показателя на системно-органном и организменном уровнях
Всего в ходе исследования было установлено 57 НЯ, которые были классифицированы по органам и системам с использованием SOC MedDRA (версия 27.0).
Для получения системного интегрального показателя (WS) балльных оценок всех характеристик каждого НЯ проводили интеграцию взвешенных (ωi) нормализованных чётких оценок балла (Eni), соответствующих установленной характеристике НЯ, по формуле (2), где i — характеристика НЯ, а N — количество характеристик НЯ:
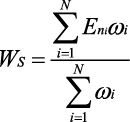 , (2)
, (2)
Если у одного добровольца были установлены несколько НЯ по одной из систем, для анализа оставляли наиболее неблагоприятные характеристики — тяжёлая степень тяжести, определённая связь с приёмом препарата, лечение НЯ и другие (Ws — минимальная). В результате дополнительного отбора из 57 НЯ для окончательного анализа были выделены 39 НЯ, которые были связаны: в 23 случаях (59,0 %) с общими нарушениями и реакциями в месте введения, в 7 случаях (17,9 %) с лабораторными и инструментальными данными, в 4 случаях (10,3 %) с желудочно-кишечными нарушениями, в 2 случаях (5,2 %) с нарушениями со стороны сосудов, в 2 случаях (5,2 %) с нарушениями со стороны нервной системы и в 1 случае (2,6 %) с инфекциями и инвазиями.
Из 84 добровольцев, принимавших участие в исследовании, НЯ были установлены у 30 человек, что при общем количестве принятых к анализу НЯ (39) обусловило наличие нескольких НЯ по различным системам у отдельных добровольцев.
Для получения общего индивидуального интегрального показателя (WI), характеризующего побочные действия анализируемых препаратов на организменном уровне у одного добровольца, проводили интеграцию взвешенных (ωSi) системных показателей (WSi) по всем установленным системам по формуле (3), где i — системы организма, а N — количество анализируемых систем у одного добровольца:
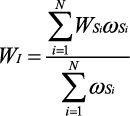 , (3)
, (3)
Для получения весовых коэффициентов отдельных систем организма (ωSi) была проанализирована частота нежелательных реакций в соответствии с классификацией, представленной в Протоколе. Было установлено, что все НЯ отнесены к категории «очень часто», поэтому для дифференцированного подхода к отдельным системам организма учитывали частоту встречаемости НЯ — чем больше относительная частота встречаемости в настоящем исследовании, тем более «неблагоприятна» данная система и, соответственно, больше значение веса. Результаты оценки информативности анализируемых систем организма, полученные с использованием метода Фишберна [9], представлены в табл. 6.
Этап 5 — интерпретация результатов для принятия решения на основе разработанных критериев и полученного уровня интегрального показателя
Интерпретация индивидуальных показателей. Обязательность установления добровольцев с наличием неблагоприятных индивидуальных отклонений в состоянии здоровья — принципиальная особенность и преимущество подхода, основанного на интеграции индивидуальных параметров НЯ.
Для принятия решения по результатам проведённого анализа индивидуальных показателей на системно-органном уровне использовали трёхуровневую шкалу желательности Харрингтона (табл. 7), где Di — интегральный индивидуальный показатель.
Таблица 6
Результаты оценки информативности (веса) анализируемых систем организма
Table 6
Results of assessing the information content (weight) of the analyzed body systems
|
Органы и системы по SOC MedDRA (версия 27.0) / Organs and systems according to SOC MedDRA (version 27.0) |
Вес / Weight (ωSi) |
|
10018065 Общие нарушения и реакции в месте введения / General disorders and reactions at the injection site |
0,333 |
|
10022891 Лабораторные и инструментальные данные / Laboratory and instrumental data |
0,267 |
|
10017947 Желудочно-кишечные нарушения / Gastrointestinal disorders |
0,200 |
|
10047065 Нарушения со стороны сосудов / Vascular disorders |
0,133 |
|
10029205 Нарушения со стороны нервной системы / Nervous system disorders |
0,133 |
|
10021881 Инфекции и инвазии / Infections and infestations |
0,067 |
Примечание: SOC MedDRA — класс системы органов международного словаря нежелательных реакций, возникающих при применении лекарственных препаратов для медицинского применения.
Note: SOC MedDRA — System Organ Class of Medical Dictionary for Regulatory Activities.
Таблица 7
Соответствие диапазонов шкалы Харрингтона уровням интегральных и системных показателей и заключений о вероятности развития НЯ по каждому добровольцу
Table 7
Correspondence of the ranges of the Harrington scale to the levels of integral and systemic indicators and conclusions about the likelihood of developing AE for each volunteer
|
Диапазоны значений шкалы Харрингтона / Harrington scale ranges |
Характеристика уровня индивидуальной оценки / Characteristics of the level of individual assessment |
Заключение / Conclusion |
|
1,00 ≥ Di ≥ 0,37 |
Отсутствие отклонений/No Deviations |
Низкая вероятность развития НЯ/ Low likelihood of developing adverse events |
|
0,37 > Di ≥0,20 |
Умеренные отклонения/Moderate Deviations |
Возможно развитие НЯ/ Possible development of adverse events |
|
Di < 0,20 |
Выраженные отклонения/Expressed deviations |
Высокая вероятность развития НЯ/ High likelihood of developing adverse events |
Примечания: НЯ — нежелательное явление; Di — интегральный индивидуальный показатель.
Notes: AE — Adverse Event; Di — integral individual indicator.
Применительно к настоящему исследованию интегральный индивидуальный показатель Di шкалы Харрингтона соответствует системному интегральному индивидуальному показателю (WS).
Заключение о вероятности развития НЯ на основе индивидуальных показателей было сделано на основании заключений по отдельным группам исследуемого препарата (ИП) и препарата сравнения (ПС) по критериям:
— «НЯ не выявлены», если:
а) 100 % в обоих группах — низкая вероятность развития НЯ;
б) 100 % в группе ИП — низкая вероятность развития НЯ, до 40 % в группе ПС — возможно развитие НЯ.
— «НЯ выявлены», если:
а) более 40 % в обоих группах — высокая вероятность развития НЯ;
б) более 40 % в группе ИП — высокая вероятность развития НЯ, независимо от количества добровольцев с высокой вероятностью развития НЯ в группе ПС;
в) более 40 % добровольцев группах ИП или ПС по одной из систем — высокая вероятность развития НЯ;
— «Неопределённый результат», если не соблюдены условия для случаев «НЯ не выявлены» и «НЯ выявлены».
В табл. 8 представлена характеристика частот встречаемости различных уровней интегральной оценки по системам организма (органоспецифические нарушения) исследуемого препарата и препарата сравнения.
Таблица 8
Характеристики частот встречаемости, n (%), различных уровней интегральной индивидуальной оценки по системам организма для препаратов Трастузумаб (исследуемый препарат) и Герцептин® (препарат сравнения)
Table 8
Characteristics of frequency of occurrence, n (%), of various levels of integral individual assessment by body system for the drugs Trastuzumab (Investigational Drug/ID) and Herceptin® (Comparison Drug/CD)
|
SOC MedDRA |
Уровни индивидуальной оценки для ИП / Levels of individual assessment for ID (n=42) |
Уровни индивидуальной оценки для ПС / Levels of individual assessment for CD (n=42) |
||||
|
Отсутствие отклонений/ No deviations |
Умеренные отклонения/Moderate deviations |
Выраженные отклонения/Severe deviations |
Отсутствие отклонений/ No deviations |
Умеренные отклонения/Moderate deviations |
Выраженные отклонения/Severe deviations |
|
|
Отсутствие НЯ/ No AEs |
26 (61,9 %) |
0 (0,0 %) |
0 (0,0 %) |
28 (66,7 %) |
0 (0,0 %) |
0 (0,0 %) |
|
10018065 Общие нарушения и реакции в месте введения / General disorders and reactions at the injection site |
13 (31,0 %) |
1 (2,4 %) |
0 (0,0 %) |
6 (14,3 %) |
2 (4,8 %) |
1 (2,4 %) |
|
10022891 Лабораторные и инструментальные данные / Laboratory and instrumental data |
2 (4,8 %) |
0 (0,0 %) |
0 (0,0 %) |
5 (11,9 %) |
0 (0,0 %) |
0 (0,0 %) |
|
10017947 Желудочно-кишечные нарушения / Gastrointestinal disorders |
1 (2,4 %) |
3 (7,1 %) |
0 (0,0 %) |
0 (0,0 %) |
0 (0,0 %) |
0 (0,0 %) |
|
10029205 Нарушения со стороны нервной системы / Nervous system disorders |
0 (0,0 %) |
1 (2,4 %) |
0 (0,0 %) |
0 (0,0 %) |
1 (2,4 %) |
0 (0,0 %) |
|
10047065 Нарушения со стороны сосудов / Vascular disorders |
1 (2,4 %) |
0 (0,0 %) |
0 (0,0 %) |
1 (2,4 %) |
0 (0,0 %) |
0 (0,0 %) |
|
10021881 Инфекции и инвазии / Infections and infestations |
1 (2,4 %) |
0 (0,0 %) |
0 (0,0 %) |
0 (0,0 %) |
0 (0,0 %) |
0 (0,0 %) |
Примечания: SOC MedDRA — класс системы органов международного словаря нежелательных реакций, возникающих при применении лекарственных препаратов для медицинского применения; ИП — исследуемый препарат; НЯ — нежелательное явление; ПС — препарат сравнения.
Notes: AE — Adverse Event; CD–Comparison Drug ID–Investigational Drug; SOC MedDRA — System Organ Class of Medical Dictionary for Regulatory Activities.
Анализ данных табл. 8 показал, что в обеих группах установлено наличие добровольцев с наличием умеренных отклонений по отдельным органам и системам — 11,9 % в группе ИП и 7,1 % в группе ПС. Только для ПС установлен 1 доброволец (2,4 %) с «выраженными отклонениями» по SOC MedDRA «10018065 Общие нарушения и реакции в месте введения». В соответствии с представленными критериями по результатам интерпретации индивидуальных показателей по системам организма было сделано заключение «Неопределённый результат». Заключение «Неопределённый результат» означает, что у отдельных добровольцев установлены неблагоприятные изменения в состоянии некоторых органов и систем, однако уровень отклонений не требует проведения дополнительных обследований для установления причинно-следственных связей с приёмом препаратов и позволяет перейти к этапу оценки групповых показателей.
В табл. 9 представлена характеристика частот встречаемости различных уровней интегральной оценки на организменном уровне (общие нарушения) исследуемого препарата и препарата сравнения.
В соответствии с представленными критериями по результатам интерпретации индивидуальных показателей на организменном уровне было сделано заключение «Неопределённый результат», аналогичное по содержательной части характеристике для органоспецифических нарушений, что определяет целесообразность продолжения анализа на основе оценки групповых показателей общих нарушений.
Интерпретация групповых показателей. Для принятия решения по результатам проведённого анализа групповых показателей использовали трёхуровневую шкалу желательности Харрингтона (табл. 10), где Dg — интегральный индивидуальный показатель.
Таблица 9
Характеристики частот встречаемости, n (%), различных уровней интегральной индивидуальной оценки на организменном уровне для препаратов Трастузумаб (исследуемый препарат) и Герцептин® (препарат сравнения)
Table 9
Characteristics of the frequency of occurrence, n (%), of various levels of integral individual assessment at the organismal level for the drugs Trastuzumab (Investigational Drug/ID) and Herceptin® (Comparison Drug/CD)
|
Показатели / Indicators |
Уровни индивидуальной оценки для ИП / Levels of individual assessment for ID (N=42) |
Уровни индивидуальной оценки для ПС / Levels of individual assessment for CD (N=42) |
||||
|
Отсутствие отклонений/ No deviations |
Умеренные отклонения/Moderate deviations |
Выраженные отклонения/Severe deviations |
Отсутствие отклонений/ No deviations |
Умеренные отклонения/Moderate deviations |
Выраженные отклонения/Severe deviations |
|
|
Общие нарушения / General disorders |
40 (95,2 %) |
2 (4,8 %) |
0 (0,0 %) |
39 (92,8 %) |
2 (4,8 %) |
1 (2,4 %) |
Примечания: SOC MedDRA — класс системы органов международного словаря нежелательных реакций, возникающих при применении лекарственных препаратов для медицинского применения; ИП — исследуемый препарат; ПС — препарат сравнения.
Notes: CD–Comparison Drug ID–Investigational Drug; SOC MedDRA — System Organ Class of Medical Dictionary for Regulatory Activities.
Таблица 10
Соответствие диапазонов шкалы Харрингтона уровням групповой оценки интегральных и системных показателей и заключений о вероятности развития НЯ по группе
Table 10
Correspondence of the ranges of the Harrington scale to the levels of group assessment of integral and systemic indicators and conclusions about the probability of developing AE in the group
|
Диапазоны значений шкалы Харрингтона / Harrington scale ranges |
Характеристика уровня групповой оценки / Characteristics of the level of group evaluation |
Заключение по группе / Group Conclusion |
|
1,00 ≥ Dg ≥ 0,37 |
В пределах референтных диапазонов/ Within reference ranges |
Низкая вероятность развития НЯ/Low likelihood of adverse events developing |
|
0,37 > Dg ≥0,20 |
Незначительно выходящий за пределы референтных диапазонов/Slightly out of reference ranges |
Возможно развитие НЯ/ The development of adverse events is possible |
|
Dg < 0,20 |
Значительно выходящий за пределы референтных диапазонов/Significantly outside of reference ranges |
Высокая вероятность развития НЯ/ High likelihood of adverse events developing |
Примечания: НЯ — нежелательное явление; Dg — интегральный групповой показатель.
Notes: AE — Adverse Event; Dg — integral group indicator.
Заключение о вероятности развития НЯ на основе групповых показателей было сделано на основании заключений по отдельным группам исследуемого препарата (ИП) и препарата сравнения (ПС) по критериям:
— «НЯ не выявлены», если:
а) все группы — низкая вероятность развития НЯ;
б) группа ИП — низкая вероятность развития НЯ, группа ПС — возможно развитие НЯ.
— «НЯ выявлены», если:
а) все группы — высокая вероятность развития НЯ;
б) системные показатели групп ИП или ПС — высокая вероятность развития НЯ.
— «Неопределённый результат», если:
а) все группы — возможно развитие НЯ;
б) группа ПС — высокая вероятность развития НЯ, независимо от группового заключения группы ИП.
В табл. 11 представлена количественная интегральная оценка общих нарушений (организменный уровень) для групп ИП и ПС. Как медианные, так и средние групповые показатели относились к диапазону от 0,37 до 1,0, что в соответствии с представленными критериями позволило прийти к итоговому заключению по групповым показателям «НЯ не выявлены».
Таблица 11
Результаты групповой оценки общих нарушений на основе количественных характеристик НЯ
Table 11
Results of group assessment of general disorders based on quantitative characteristics of AEs
|
Группа |
N |
M |
SD |
Min |
Max |
Me |
LQ |
UQ |
р |
|
Исследуемый препарат / Investigational Drug |
42 |
0,762 |
0,308 |
0,269 |
1,000 |
1,000 |
0,386 |
1,000 |
0,603 |
|
Препарат сравнения / Comparison Drug |
42 |
0,784 |
0,313 |
0,062 |
1,000 |
1,000 |
0,397 |
1,000 |
Примечания: р — p-значение в тесте Манна — Уитни; N — количество субъектов в группе; M — мода; SD — стандартное отклонение; Min — минимальное значение; Max — максимальное значение; Me — медиана; LQ — нижний квартиль; UQ — верхний квартиль.
Notes: p — p-value in Mann — Whitney test; N — number of subjects in the group; M — mode; SD — standard deviation; Min — minimum value; Max — maximum value; Me — median; LQ — lower quartile; UQ — upper quartile.
Полученные результаты углублённого анализа НЯ свидетельствует об отсутствии необходимости дополнительных экспертных оценок безопасности препарата Трастузумаб или повторного проведения клинического исследования, что совпадает с результатами базового клинического исследования.
Заключение / Conclusion
Объём НЯ относительно небольшой, однако у 1 добровольца индивидуальные интегральные значения ниже пороговых уровней. Это никак не противоречит «классическим» результатам, но показывает возможности метода к экстраполяции на больших когортах как субъектов исследования в рамках клинических исследований лекарственных препаратов, так и на пациентах в рамках анализа пострегистрационного этапа. Групповые данные (на основе объединения индивидуальных) также не отличаются при интегральной количественной оценке.
Выделение добровольцев с умеренными и выраженными отклонениями — может стать основой для научных исследований возможной индивидуальной чувствительности с учётом различных стратифицирующих факторов (пол, возраст и т. д.) и исходных уровней состояния организма, особенно в сопоставлении с данными автоматизировано информационной системы «Фармаконадзор» для реализации риск-ориентированного подхода.
|
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
ADDITIONAL INFORMATION |
|
|
Конфликт интересов Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи. |
Conflict of interests The team of authors declares that there is no conflict of interest in the preparation of this article. |
|
|
Участие авторов Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределён следующим образом: Верведа А. Б. — концепция исследования, редактирование статьи, написание статьи; Василюк В. Б. — концепция исследования, редактирование статьи, расчёты; Сыраева Г. И. — концепция исследования, редактирование статьи, написание статьи, расчёты; Фарапонова М. В. — написание статьи, обзор литературы; Повов А. В. — написание статьи, обзор литературы. |
Authors’ participation All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows: Verveda AB — research concept, article editing, article writing; Vasilyuk VB — research concept, article editing, calculations; Syraeva GI — research concept, article editing, article writing, calculations; Faraponova MV — article writing, literature review; Popov AV — article writing, literature review. |
|
|
Финансирование Работа выполнена без спонсорской поддержки. |
Funding The study was performed without external funding. |
1 Государственный реестр лекарственных средств https://grls.minzdrav.gov.ru
2 Руководство Международной конференции по гармонизации E6 (6), раздел 5.5
3 Приказ Министерства здравоохранения РФ от 01.04.2016 года N 200н «Об утверждении правил надлежащей клинической практики»
4 Национальный стандарт Российской Федерации ГОСТ Р 52379–2005 «Надлежащая клиническая практика»
5 Рекомендациями Коллегии Евразийской экономической комиссии от 17.07.2018 № 11 «О Руководстве по общим вопросам клинических исследований»
Список литературы
1. Верведа А.Б., Василюк В.Б., Сыраева Г.И., Фарапонова М.В. Оптимизация подходов к анализу нежелательных явлений при проведении клинических исследований биоэквивалентности. Безопасность и риск фармакотерапии. 2024;12(1):24-34. [Verveda AB, Vasilyuk VB, Syraeva GI, Faraponova MV. Optimisation of approaches to adverse event analysis in bioequivalence clinical trials. Safety and Risk of Pharmacotherapy. 2024;12(1):24–34. (In Russ.)]. doi: 10.30895/2312-7821-2023-374.
2. Каган Е.С. Построение комплексных нечетких оценок эффективности деятельности вуза и публичной формализации деятельности преподавателя. Известия Алтайского государственного университета. 2015;1(85):152-7. [Kagan ES. Construction of Comprehensive Fuzzy Evaluations of University Activity Effectiveness and Lecturer Activity Public Formalization. Izvestiya of Altai State University. 2015;1(85):152-7. (In Russ.)]. doi: 10.14258/izvasu(2015)1.1-27.
3. Георгица И.В., Кузнецова А.В. Представление знаний для системы подбора персонала на основе нечеткой логики. Современные проблемы науки и образования. 2015;1(1):125. [Georgitsa IV, Kuznetsova AV. Knowledge representation for fuzzy logic recruitment system. Sovremennye problemy nauki i obrazovaniya. 2015;1(1):125. (In Russ.)].
4. Заде Л.А. Роль мягких вычислений и нечеткой логики в понимании, конструировании и развитии информационных/интеллектуальных систем. Новости искусственного интеллекта. 2001;2-3:7-11. [Zadeh LA. The role of soft computing and fuzzy logic in understanding, designing and developing information/intelligent systems. Novosti iskusstvennogo intellekta. 2001;2-3:7-11. (In Russ.)].
5. Полещук О.М. Построение интегральных моделей в рамках нечеткой экспертной информации. Лесной вестник. 2003;5:155-9. [Poleshchuk OM. Building integral models within the framework of fuzzy expert information. Forestry Bulletin. 2003;5:155-9. (In Russ.)].
6. Адлер Ю.П, Маркова ЕВ, Грановский ЮВ. Планирование эксперимента при поиске оптимальных условий. — М.: Наука; 1976. — 279 с. [Adler YuP, Markova EV, Granovsky SE. Experiment planning in the search for optimal conditions Moscow: Nayka, 197 6. (In Russ.)].
7. Саати Т, Томас Л. Принятие решений : Метод анализа иерархий / Т. Саати; Пер. с англ. Р. Г. Вачнадзе. — Москва : Радио и связь, 1993. — 314. [Saati T, Tomas L. Decision-making : The method of hierarchy analysis. T. Saati; Translated from the English by RG Vachnadze. Moscow: Radio i svyaz', 1993. (In Russ.)]. ISBN 5-256-00443-3.
8. Клюшников ЕВ, Шитова ЕМ. Методические подходы к расчету интегрального показателя, методы ранжирования. Электронный научно-практический журнал «ИнноЦентр». 2016;1(10):4-18. [Klyushnikova EV, Shitova EM. Methodological approaches to calculation of integral index, ranking methods. Electronic Journal “InnoCentre”. 2016;1(10):4-18. (In Russ.)].
9. Макарова ИЛ. Анализ методов определения весовых коэффициентов в интегральном показателе общественного здоровья. Символ науки. 2015;7:87-95. [Makarova IL. Analysis of methods for determining weight coefficients in the integral indicator of public health. Simvol nauki. 2015;7:87-95. (In Russ.)].
Об авторах
А. Б. ВерведаРоссия
Верведа Алексей Борисович — к. м. н., в. н. с.; с. н. с., научно-исследовательского отдела
Санкт-Петербург
В. Б. Василюк
Россия
Василюк Василий Богданович — д. м. н., профессор кафедры токсикологии, экстремальной и водолазной медицины; Управляющий
Санкт-Петербург
Г. И. Сыраева
Россия
Сыраева Гульнара Ислямовна — к. м. н., ассистент кафедры клинической фармакологии и доказательной медицины; заместитель управляющего
Санкт-Петербург
М. В. Фарапонова
Россия
Фарапонова Мария Валерьевна — заместитель управляющего по научной работе
Санкт-Петербург
А. В. Попов
Россия
Попов Андрей Вячеславович — к. м. н., старший преподаватель кафедры военно-полевой терапии
Санкт-Петербург
Рецензия
Для цитирования:
Верведа А.Б., Василюк В.Б., Сыраева Г.И., Фарапонова М.В., Попов А.В. Реализация количественного интегрального анализа при оценке нежелательных явлений при проведении клинических исследований: в фокусе трастузумаб. Качественная клиническая практика. 2024;(4):21-34. https://doi.org/10.37489/2588-0519-2024-4-21-34. EDN: ZEWDXG
For citation:
Verveda A.B., Vasilyuk V.B., Syraeva G.I., Faraponova M.V., Popov A.V. Implementation of quantitative integral analysis in assessing events associated with safety issues during clinical trials: focusing on trastuzumab. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2024;(4):21-34. (In Russ.) https://doi.org/10.37489/2588-0519-2024-4-21-34. EDN: ZEWDXG

















































