Перейти к:
Идеальная скорость набора пациентов в клинических исследованиях II–III фаз
https://doi.org/10.37489/2588-0519-2024-1-63-71
EDN: FAWAWZ
Аннотация
Актуальность. Скорость набора пациентов в клиническое исследование позволяет оценить работу клинического центра, произвести расчёт времени на достижение целевого набора. Авторы оценивают скорость набора на основании сопоставления с целевой величиной набора, и, по данным литературы, на скорость набора влияют множество факторов, которые в основном влияют отрицательно, уменьшая её. Оценки на оптимальность набора или нормальность набора пациентов по данным литературы всегда делались в расчёте на определённый протокол и нозологию, так как данный параметр невозможно сконструировать экспериментально в идеальных условиях при отсутствии влияния того или иного фактора. И, с другой стороны, большинство клинических исследований завершаются неудачей набора пациентов и, соответственно, скорость набора в таких исследованиях находилась под сильным влиянием тех или иных факторов.
Цель исследования. Оценить количественно степень влияния фактора нозологии протокола на скорость набора пациентов в клиническом исследовании.
Материалы и методы. Проведён ретроспективный анализ 4-х международных мультицентровых клинических исследованиях II–III фаз по набору пациентов в зависимости от влияния фактора нозологии протокола. Использованы методы описательной статистики с типированием, методика расчёта отношения шансов.
Результаты. Получена количественная оценка влияния фактора нозологии протокола на скорость набора пациентов, действие которого разнонаправленно — от не имеющего статически значимого влияния на скорость набора пациентов, до значительного влияния.
Выводы. Впервые предложена количественная оценка факторов, влияющих на набор пациентов. Впервые найдена идеальная скорость набора пациентов.
Ключевые слова
Для цитирования:
Милованов С.С. Идеальная скорость набора пациентов в клинических исследованиях II–III фаз. Качественная клиническая практика. 2024;(1):63-71. https://doi.org/10.37489/2588-0519-2024-1-63-71. EDN: FAWAWZ
For citation:
Milovanov S.S. Ideal recruitment rate in clinical trials in phases II–III. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2024;(1):63-71. (In Russ.) https://doi.org/10.37489/2588-0519-2024-1-63-71. EDN: FAWAWZ
Введение / Introduction
Международное руководство по надлежащей клинической практике (ICH GCP) требует определения скорости набора пациентов в клиническом центре (пункт 5.18.4). Для успеха протокола данный параметр должен быть в строгом соответствии с целевым набором [1]. Неуспешных исследований, по данным литературы, кратно больше, чем удачных [2, 3]. Кроме оценки скорости набора пациентов, авторами оцениваются финальный набор, и только единицы авторов оценивают предварительные цифры набора [4][5]. На скорость набора пациентов оказывают влияние множество различных факторов [6], которые в основном снижают скорость набора и в большинстве случаев до полного отсутствия набора. Исследование влияния факторов затруднено из-за их лабильности [7], связанной с большим их количеством и переплетением их взаимного действия, и, если в доклинических исследованиях некоторые процессы для более глубокого изучения можно воспроизвести отдельно и получить значения, то в клинических исследованиях это невозможно, но необходимость поиска значений набора пациентов, неподверженного влиянию факторов, остаётся актуальной по аналогии с поиском «стандартного человека» [8] или позже «условного человека» в анатомии [9]. Для выявления количественного влияния факторов применяют методику отношения шансов с уровнем статистической значимости равной 0,05 [10][11].
Методы и материалы / Methods and materials
Для изучения скорости набора пациентов были отобраны клинические исследования, успешно выполнившие поставленные цели по набору пациентов, по следующим нозологиям:
- рак головы и шеи (распространённым первичным плоскоклеточным раком полости рта / мягкого нёба) — III фазы (CS001P3, EudraCT — 2010-019952-35);
- рак лёгкого (немелкоклеточным раком лёгкого стадии IIIb или IV) (STA9090, EudraCT — 2011-
001084-42); - колоректальный рак (колоректальным раком и рецидивирующими метастазами в печени) (LSO-OL006, EudraCT — 2006-004214-41);
- идиопатическая пурпура (хроническая персистирующая) (SM101–201, EudraCT — 2009-014842-28).
Результаты набора пациентов и связанные с набором данные (скорость набора пациентов и другие) получены из клинических центров России, Украины и Белоруссии, а также для анализа включены основные результаты набора по всем клиническим центрам мира.
Всего набрано 622 пациента из 70 клинических центров, расположенных в 59 городах региона РУБ (Россия, Украина, Белоруссия). Общее количество вовлечённых пациентов по всему миру — 1919 [12].
В исследовании использованы следующие методы статистическго анализа:
- Методы описательной статистики — расчитаны минимум и максимум значений, стандартное отклонение, средние значения, медиана, мода, коэффициент вариации, доверительный интервал для нижеперечисленных параметров и показателей до и после завершения набора пациентов:
- Тип сайта, предложенный для оценки набора;
- Параметр — финальный набор пациентов;
- Параметр — финальная скорость набора пациентов;
- Метод расчёта отношения шансов (OR): (формула 1)
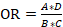 , где (1)
, где (1)
А — количество потенциальных пациентов клинического центра (исходя из данных на сто тысяч населения в год по данным [13–15]), которые активно набирали пациентов, включая пациентов этих центров, вошедших в клиническое исследование (валидных пациентов);
В — количество потенциальных пациентов клинических центров, которые не набрали ни одного пациента;
С — количество потенциальных пациентов клинического центра, которые активно набирали пациентов, НЕ включая пациентов этих центров, вошедших в клиническое исследование (валидных пациентов);
D — количество потенциальных пациентов клинических центров, которые активно набирали пациентов и которые не набрали ни одного пациента,
НЕ включая пациентов этих центров, вошедших в клиническое исследование (валидных пациентов).
Доверительный интервал (ДИ) — 95 % рассчитывали по формуле (2):
ДИ (95 %) = 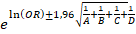 , где (2)
, где (2)
А — количество потенциальных пациентов в клинических центрах, которые активно набирали пациентов, включая пациентов этих центров, вошедших в клиническое исследование (валидных пациентов);
В — количество потенциальных пациентов в клинических центрах, которые не набрали ни одного пациента;
С — количество потенциальных пациентов в клинических центрах, которые активно набирали пациентов, НЕ включая пациентов этих центров, вошедших в клиническое исследование (валидных пациентов);
D — количество потенциальных пациентов в клинических центрах, которые активно набирали пациентов и которые не набрали ни одного пациента,
НЕ включая пациентов этих центров, вошедших в клиническое исследование (валидных пациентов).
Была использована модификация метода, учитывающая незарегистрированное количество заболевших той или иной нозологией, а количество населения с учётом распространённости патологии в данной области нахождения клинического центра с учётом пациентов, вошедших в протокол, и мы расценивали полученное значение как количественную степень влияния.
Результаты / Results
Данные нашего исследования получены в ходе проведения четырех международных мультицентровых рандомизированных исследований — рака головы и шеи, колоректального рака, рака лёгкого и идиопатической пурпуры.
Из причин заболеваемости и смертности все злокачественные заболевания занимают второе место и составляют 17 % после заболеваемости и смертности от ишемической болезни сердца (ИБС) — 33 %. В мире рак лёгкого занимает 1-е место в ряду злокачественных заболеваний, колоректальный рак занимает 3-е место, плоскоклеточный рак головы и шеи находится на 6-м месте [16–20].
Заболеваемость идиопатической тромбоцитопенической пурпурой (ИТП) в мире составляет
1,6–3,9 на 100 тыс. населения в год. Среди взрослых и детей распространённость колеблется от 4,5 до 20 на 100 тыс. населения [16–21].
Клинические исследования проводились в 70 городах трёх стран. Данные о распространённости заболевания, финальном наборе пациентов и типах центров представлены в табл. 1.
Таблица 1
Финальный набор пациентов, численность населения и абсолютные цифры распространённости рака головы и шеи (РГШ), рака лёгкого (РЛ), колоректального рака (КРР) и идиопатической тромбоцитопенической пурпуры (ИТП) в России (Р), Украине (У) и Белоруссии (Б) в 2000–2020 гг.
Table 1
Final patient recruitment, population size and absolute prevalence figures for head and neck cancer (HNC), lung cancer (LC), colorectal cancer (CRC) and idiopathic thrombocytopenic purpura (ITP) in Russia (R), Ukraine (U) and Belarus (B)) in 2000–2020
Город | Код исследования | Страна | Нозология | Население в 2010 году, чел. | Распространённость нозологий протокола | Финальное число набранных пациентов |
Москва | CS001P3 | Р | РГШ | 10 430 000 | 1 018 | 0 |
Сочи | CS001P3 | Р | РГШ | 364 171 | 34 | 0 |
Санкт-Петербург | CS001P3 | Р | РГШ | 5 391 203 | 500 | 0 |
Курск | CS001P3 | Р | РГШ | 1 100 248 | 102 | 1 |
Витебск | CS001P3 | Б | РГШ | 347 900 | 57 | 22 |
Минск | CS001P3 | Б | РГШ | 1 836 800 | 305 | 32 |
Санкт-Петербург | CS001P3 | Р | РГШ | 5 391 203 | 500 | 75 |
Омск | CS001P3 | Р | РГШ | 1 915 170 | 177 | 60 |
Екатеринбург | CS001P3 | Р | РГШ | 4 300 374 | 398 | 68 |
Челябинск | STA9090 | Р | РЛ | 1 150 000 | 489 | 0 |
Пенза | STA9090 | Р | РЛ | 519 948 | 221 | 0 |
Тула | STA9090 | Р | РЛ | 406 725 | 202 | 0 |
Санкт-Петербург | STA9090 | Р | РЛ | 5 391 203 | 2 294 | 0 |
Москва | STA9090 | Р | РЛ | 10 430 000 | 4 914 | 0 |
Сочи | STA9090 | Р | РЛ | 364 171 | 155 | 0 |
Санкт-Петербург | STA9090 | Р | РЛ | 5 391 203 | 2 294 | 0 |
Владивосток | STA9090 | Р | РЛ | 598 927 | 255 | 0 |
Донецк | STA9090 | У | РЛ | 1 000 000 | 411 | 0 |
Черновцы | STA9090 | У | РЛ | 236 691 | 108 | 0 |
Луцк | STA9090 | У | РЛ | 213 950 | 92 | 0 |
Запорожье | STA9090 | У | РЛ | 746 749 | 321 | 0 |
Киев | STA9090 | У | РЛ | 2 625 000 | 1 199 | 0 |
Киев | STA9090 | У | РЛ | 2 625 000 | 1 199 | 0 |
Волгоград | STA9090 | Р | РЛ | 1 019 000 | 434 | 1 |
Пятигорск | STA9090 | Р | РЛ | 144 603 | 62 | 1 |
Самара | STA9090 | Р | РЛ | 1 133 000 | 490 | 2 |
Нижний Новгород | STA9090 | Р | РЛ | 1 289 000 | 541 | 2 |
Воронеж | STA9090 | Р | РЛ | 848 851 | 385 | 1 |
Ставрополь | STA9090 | Р | РЛ | 355 914 | 164 | 2 |
Кривой Рог | STA9090 | Р | РЛ | 695 168 | 292 | 2 |
Сумы | STA9090 | У | РЛ | 292 139 | 123 | 2 |
Киев | STA9090 | У | РЛ | 2 625 000 | 1 199 | 3 |
Казань | STA9090 | У | РЛ | 1 110 000 | 496 | 11 |
Харьков | STA9090 | У | РЛ | 1 419 000 | 610 | 12 |
Москва | STA9090 | Р | РЛ | 10 430 000 | 4 914 | 36 |
Днепропетровск | STA9090 | У | РЛ | 966 400 | 416 | 34 |
Санкт-Петербург | LSO-OL006 | Р | КРР | 5 391 203 | 1 107 | 0 |
Санкт-Петербург | LSO-OL006 | Р | КРР | 5 391 203 | 1 107 | 0 |
Москва | LSO-OL006 | Р | КРР | 10 430 000 | 2 371 | 0 |
Барнаул | LSO-OL006 | Р | КРР | 625 679 | 128 | 3 |
Ярославль | LSO-OL006 | Р | КРР | 597 161 | 123 | 4 |
Екатеринбург | LSO-OL006 | Р | КРР | 4 300 374 | 883 | 3 |
Донецк | LSO-OL006 | У | КРР | 1 000 000 | 181 | 5 |
Черкассы | LSO-OL006 | У | КРР | 279 074 | 53 | 3 |
Днепропетровск | LSO-OL006 | У | КРР | 966 400 | 183 | 3 |
Москва | LSO-OL006 | Р | КРР | 10 430 000 | 2 257 | 7 |
Санкт-Петербург | LSO-OL006 | Р | КРР | 5391203 | 1 107 | 7 |
Москва | LSO-OL006 | Р | КРР | 10 430 000 | 2 371 | 11 |
Санкт-Петербург | LSO-OL006 | Р | КРР | 5391 203 | 1 107 | 11 |
Тамбов | LSO-OL006 | Р | КРР | 281 348 | 58 | 11 |
Запорожье | LSO-OL006 | У | КРР | 746 749 | 141 | 11 |
Нижний Новгород | LSO-OL006 | Р | КРР | 1 289 000 | 261 | 33 |
Москва | LSO-OL006 | Р | КРР | 10 430 000 | 2 371 | 36 |
Киев | LSO-OL006 | У | КРР | 2 625 000 | 527 | 35 |
Харьков | LSO-OL006 | У | КРР | 1 419 000 | 268 | 33 |
Тула | SM101-201 | Р | ИТП | 406 726 | 0 | 0 |
Ижевск | SM101-201 | Р | ИТП | 631 182 | 0 | 0 |
Санкт-Петербург | SM101-201 | Р | ИТП | 5 391 203 | 4 | 0 |
Киев | SM101-201 | У | ИТП | 2 625 000 | 6 | 0 |
Днепропетровск | SM101-201 | У | ИТП | 966 400 | 2 | 0 |
Одесса | SM101-201 | У | ИТП | 993 120 | 2 | 0 |
Электросталь | SM101-201 | Р | ИТП | 156 136 | 0 | 2 |
Екатеринбург | SM101-201 | Р | ИТП | 4 300 374 | 3 | 6 |
Нижний Новгород | SM101-201 | Р | ИТП | 1 289 000 | 1 | 6 |
Рязань | SM101-201 | Р | ИТП | 526 919 | 0 | 2 |
Краснодар | SM101-201 | Р | ИТП | 715 417 | 1 | 3 |
Сочи | SM101-201 | Р | ИТП | 364 171 | 0 | 1 |
Харьков | SM101-201 | У | ИТП | 1 419 000 | 3 | 3 |
Саратов | SM101-201 | Р | ИТП | 838 321 | 1 | 8 |
Москва | SM101-201 | Р | ИТП | 10 430 000 | 8 | 8 |
Примечания: РГШ — рак головы и шеи; РЛ — рак лёгкого; КРР — колоректальный рак; ИТП — идиопатическая тромбоцитопеническая пурпура; Р — Россия; У — Украина; Б — Белоруссия. | ||||||
В представленных данных табл. 1 можно увидеть очень большой разброс количества набранных пациентов — то есть при наличии заболеваемости — отсутствие пациентов и, наоборот, при отсутствии заболеваемости — наличие набора в центрах, и, видно, что клинических центров, не набравших пациентов (26 центров = 37 %), значительно больше, чем центров, набравших максимальные цифры (12 центров = 17 %).
Далее мы проанализировали скорость набора пациентов (см. табл. 2).
Таблица 2
Данные о целевой, предполагаемой и фактической скоростях набора пациентов
Table 2
Data on target, expected and actual patient recruitment rates
Нозология | Расчётная (целевая) скорость набора пациентов | Предполагаемая скорость набора пациентов, мес. (% от целевого) | Скорость набора пациентов фактическая, мес. (% от целевого) |
Рак головы и шеи | 0,65 | 0,2 (31 %) | 1,1 (169 %) |
Рак лёгкого | 1,3 | 1,06 (81 %) | 0,15 (11 %) |
Колоректальный рак | 0,5 | 1,05 (210 %) | 0,43 (86 %) |
Идиопатическая тромбоцито- | 0,35 | 0,7 (200 %) | 0,06 (17 %) |
На основании фактической скорости набора пациентов мы провели типирование клинических центров (см. табл. 3) по значениям среднего и среднеквадратичного отклонения с расчётом статистической разницы по критерию Стьюдента на:
- молчащие клинические центры со скоростью набора 0 пациентов в месяц;
- низкорекрутинговые клинические центры — скорость набора от 0,01 до 0,19 пациентов в месяц (то есть 1 пациент за 5 месяцев);
- среднерекрутинговые клинические центры — скорость набора от 0,20 до 0,89 пациентов в месяц (то есть 1 пациент за 5–1,4 месяца);
- высокорекрутинговые клинические центры — скорость набора от 0,90 до 3 пациентов в месяц, то есть 1 пациент за 1,1–0,3 месяца).
Для поиска количественной оценки влияния фактора нозологии мы рассчитали отношение шансов набора пациентов, исходя из распространённости заболевания (см. табл. 4).
Градация влияния представлена на рис. 1.
На рис. 1 видно, что значения отношения шансов протокола по раку головы и шеи меньше единицы, то есть мы можем говорить об отсутствии влияния нозологии этого протокола на скорость набора пациентов.
Таблица 3
Динамика изменения фактической скорости набора пациентов в зависимости от типа сайта
Table 3
Dynamics of changes in the actual rate of patient recruitment depending on the type of site
Параметр, р | Тип сайта, X±m (N=70) | |||
Молчащие | Низко- | Средне- | Высоко- | |
Финальная скорость набора пациентов в месяц 2/3<0,05 2/4<0,05 3/4<0,05 | 0 | 0,09±0,009 | 0,4±0,05 | 1,7±0,03 |
Таблица 4
Отношение шансов набора пациентов
Table 4
Patient Recruitment Odds Ratio
Нозология | Рак головы и шеи | Идиопатическая тромбоцитопеническая пурпура | Колоректальный рак | Рак лёгкого |
Отношение шансов | 0,996 (95 % ДИ 0,43–1,096) | 7,02 (95 % ДИ 3,1–15,9) | 3,64 (95 % ДИ 3,49–3,79) | 1,708 (95 % ДИ 1,65–1,77) |
Заключение | Влияние на набор пациентов минимально и статистически не существенно | Влияние на набор пациентов очень высокое и статистически существенно | Влияние на набор пациентов среднее | Влияние на набор пациентов слабое и статистически существенно |
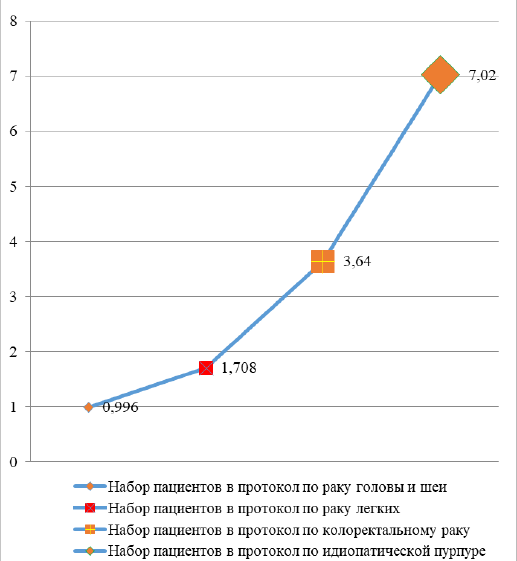
Рис. 1. Влияние нозологии протокола на набор пациентов на основании отношения шансов
Fig. 1. Impact of protocol nosology based on patient recruitment odds ratio
Обсуждение и выводы / Discussion and conclusions
По данным National Center for Biotechnology Information (NCBI) за 2010 год, количество центров, в которых на всем протяжении исследования не было пациентов, составляло до 50 % [22]. Наши данные показывают, что количество таких центров составляло 37 %. Такой высокий процент компенсируется, по нашим данным, 17 % клинических центров, которые набирают максимальные цифры пациентов. Тем не менее, наши данные показывают значительное снижение фактической скорости набора пациентов до 17 % по сравнению с целевой. По данным литературы [23–27] только 2 из 13 клинических исследований выполняют набор пациентов в запланированный срок по протоколу и наблюдается очень большой разброс в количестве набранных пациентов в клинических центрах, и, по нашим данным, мы также наблюдали большой разброс в клинических центрах по набранным пациентам. Влияние факторов на набор пациентов отмечено многими авторами и, в частности, скорость набора пациентов в онкологических исследованиях III фазы составляет 1,47–2,13 пациента в месяц [28], а в исследованиях орфанных заболеваний очень низкая из-за редкости патологии. По нашим данным, скорость набора пациентов с онкологическим заболеванием составляла 1,1 пациента в месяц, с ИТП — 0,06 пациента в месяц, что согласуется с данными литературы. Мы впервые рассчитали количественное влияние фактора нозологии протокола на скорость набора пациентов, и влияние нозологии ИТП как орфанного заболевания составило наибольшее значение — 7,02, в то время как влияние рака головы и шеи было минимальным, что подтверждало отсутствие влияния этого фактора. На основании данного факта, мы можем говорить о том, что скорость набора пациентов в изученном нами протоколе по раку головы и шеи являлась идеальной.
Мы впервые попытались проанализировать скорости набора пациентов под влиянием фактора нозологии. На основании нашего анализа впервые была выявлена идеальная скорость набора пациентов в месяц, что позволит учитывать полученные данные при планировании клинических исследований II–III фаз.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ | ADDITIONAL INFORMATION | |
Конфликт интересов Автор заявляют об отсутствии конфликта интересов. | Conflict of interests The author declares no conflict of interest. | |
Участие авторов Милованов С. С. полностью и единолично разработал модели, проанализировал и интерпретировал результаты, написал текст. | Authors’ participation Milovanov SS completely and single-handedly developed the models, analyzed and interpreted the results, and wrote the text. | |
Финансирование Работа выполнялась без спонсорской поддержки. | Financing The work was carried out without sponsorship. |
Список литературы
1. van den Bor RM, Grobbee DE, Oosterman BJ, Vaessen PWJ, Roes KCB. Predicting enrollment performance of investigational centers in phase III multi-center clinical trials. Contemp Clin Trials Commun. 2017 Jul 20;7:208-216. doi: 10.1016/j.conctc.2017.07.004.
2. Schoenberger JA. Recruitment in the Coronary Drug Project and the Aspirin Myocardial Infarction Study. Clinical Pharmacology and Therapeutics. 1979 May;25(5 Pt 2):681-684. DOI: 10.1002/cpt1979255part2681.
3. Yang E, O'Donovan C, Phillips J, Atkinson L, Ghosh K, Agrafiotis DK. Quantifying and visualizing site performance in clinical trials. Contemp Clin Trials Commun. 2018 Jan 31;9:108-114. doi: 10.1016/j.conctc.2018.01.005.
4. Reuter S, Esche G. How effective are site questionnaires in predicting site performance? Journal of Clinical Research Best Practices. 2007;3(4).
5. Getz K. Predicting successful site performance. Applied Clinical Trials. 11-01-2011. Volume 20. Issue 11. https://www.appliedclinicaltrialsonline.com/view/predicting-successful-site-performance. [дата доступа: 01 march 2024].
6. Fogel DB. Factors associated with clinical trials that fail and opportunities for improving the likelihood of success: A review. Contemp Clin Trials Commun. 2018 Aug 7;11:156-164. doi: 10.1016/j.conctc.2018.08.001.
7. Chin Feman SP, Nguyen LT, Quilty MT, Kerr CE, Nam BH, Conboy LA, Singer JP, Park M, Lembo AJ, Kaptchuk TJ, Davis RB. Effectiveness of recruitment in clinical trials: an analysis of methods used in a trial for irritable bowel syndrome patients. Contemp Clin Trials. 2008 Mar;29(2):24151. doi: 10.1016/j.cct.2007.08.004.
8. Cook MJ. A survey report of the characteristics of the standard man. Oak ridge national laboratory, unpublished data, 1948.
9. Snyder WS, Cook MJ, Nasset ES, Karhausen LR, Parry Howells G, Tipton IH. Report of the task group on reference man. − Oxford, 1975. − 496 p. https://koha.mdc-berlin.de/contents/01-00419.pdf. [дата доступа: 01 march 2024].
10. McDonald AM, Knight RC, Campbell MK, Entwistle VA, Grant AM, Cook JA, Elbourne DR, Francis D, Garcia J, Roberts I, Snowdon C. What influences recruitment to randomised controlled trials? A review of trials funded by two UK funding agencies. Trials. 2006 Apr 7;7:9. doi: 10.1186/1745-6215-7-9.
11. Durant RW, Davis RB, St George DM, Williams IC, Blumenthal C, Corbie-Smith GM. Participation in research studies: factors associated with failing to meet minority recruitment goals. Ann Epidemiol. 2007 Aug;17(8):634-42. doi: 10.1016/j.annepidem.2007.02.003.
12. Милованов С.С. Новые подходы к оценке и классификации параметров набора пациентов для проведения II-III фаз клинических исследований. Южно-Российский журнал терапевтической практики. 2023;4(3):76-86. https://doi.org/10.21886/2712-8156-2023-4-3-76-86.
13. Вопросы здравоохранения. Рак. [Электронный ресурс]. URL: https://www.who.int/ru/news-room/fact-sheets/detail/cancer [дата доступа: 20.11.2022]
14. Cancer today. [Электронный ресурс]. URL https://gco.iarc.fr/ [дата доступа: 20.11.2022]
15. Клинические рекомендации по диагностике и лечению идиопатической тромбоцитопенической пурпуры (первичной иммунной тромбоцитопении) у взрослых. Научное гематологическое общество. [Электронный ресурс] URL https://npngo.ru/uploads/media_document/93/3d47f09e-0500-4d79-8dc0-688e6bc48636.pdf [дата доступа: 09.03.2024]
16. Wild CP, Weiderpass E, Stewart BW, editors (2020). World Cancer Report: Cancer Research for Cancer Prevention. Lyon, France: International Agency for Research on Cancer. URL: http://publications.iarc.fr/586. [дата доступа: 01 марта 2024].
17. Каприн А.Д., Старинский В.В., Шахзадова А.О. Злокачественные новообразования в России в 2020 году (заболеваемость и смертность) − М.: МНИОИ им. П.А. Герцена − филиал ФГБУ «НМИЦ радиологии» Минздрава России, − 2021. − ил. − 252 с.
18. Мерабишвили В.М., Дятченко О.Т. Статистика рака легкого (заболеваемость, смертность, выживаемость). Практическая Онкология. 2000;(3):3-7. https://practical-oncology.ru/articles/547.pdf.
19. Федеральная служба государственной статистики. URL: https://rosstat.gov.ru/storage/mediabank/Demograficheskie_pokazateli.xlsx дата доступа: 09.03.2024
20. Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021 May;71(3):209-249. doi: 10.3322/caac.21660.
21. Provan D, Arnold DM, Bussel JB, Chong BH, Cooper N, Gernsheimer T, Ghanima W, Godeau B, González-López TJ, Grainger J, Hou M, Kruse C, McDonald V, Michel M, Newland AC, Pavord S, Rodeghiero F, Scully M, Tomiyama Y, Wong RS, Zaja F, Kuter DJ. Updated international consensus report on the investigation and management of primary immune thrombocytopenia. Blood Adv. 2019 Nov 26;3(22):3780-3817. doi: 10.1182/bloodadvances.2019000812.
22. Institute of Medicine (US) Forum on Drug Discovery, Development, and Translation. Transforming Clinical Research in the United States: Challenges and Opportunities: Workshop Summary. Washington (DC): National Academies Press (US); 2010. Available from: https://www.ncbi.nlm.nih.gov/books/NBK50892/ doi: 10.17226/12900.
23. Probstfield JL, Wittes JT, Hunninghake DB. Recruitment in NHLBI population-based studies and randomized clinical trials: data analysis and survey results. Control Clin Trials. 1987 Dec;8(4 Suppl):141S-149S. doi: 10.1016/0197-2456(87)90017-1.
24. Lièvre M, Ménard J, Bruckert E, Cogneau J, Delahaye F, Giral P, Leitersdorf E, Luc G, Masana L, Moulin P, Passa P, Pouchain D, Siest G. Premature discontinuation of clinical trial for reasons not related to efficacy, safety, or feasibility. BMJ. 2001 Mar 10;322(7286):603-5. doi: 10.1136/bmj.322.7286.603.
25. Quick AM, Khaw PT, Elkington AR. Problems encountered in recruiting patients to an ophthalmic drug trial. The British Journal of Ophthalmology. 1989 Jun;73(6):432-434. DOI: 10.1136/bjo.73.6.432.
26. Hawkins BS, Prior MJ, Fisher MR, Blackhurst DW. Relationship between rate of patient enrollment and quality of clinical center performance in two multicenter trials in ophthalmology. Control Clin Trials. 1990 Oct;11(5):374-94. doi: 10.1016/0197-2456(90)90177-4.
27. Myers BA, Pillay Y, Guyton Hornsby W Jr, Shubrook J, Saha C, Mather KJ, Fitzpatrick K, de Groot M. Recruitment effort and costs from a multi-center randomized controlled trial for treating depression in type 2 diabetes. Trials. 2019 Nov 6;20(1):621. doi: 10.1186/s13063-019-3712-x.
28. Jenei K, Haslam A, Olivier T, Miljkovíc M, Prasad V. What drives cancer clinical trial accrual? An empirical analysis of studies leading to FDA authorisation (2015-2020). BMJ Open. 2022 Oct 7;12(10):e064458. doi: 10.1136/bmjopen-2022-064458.
Об авторе
С. С. МиловановРоссия
Милованов Святослав Сергеевич — к. м. н., независимый исследователь, аудитор GхP, специалист по клиническим исследованиям.
Москва
Рецензия
Для цитирования:
Милованов С.С. Идеальная скорость набора пациентов в клинических исследованиях II–III фаз. Качественная клиническая практика. 2024;(1):63-71. https://doi.org/10.37489/2588-0519-2024-1-63-71. EDN: FAWAWZ
For citation:
Milovanov S.S. Ideal recruitment rate in clinical trials in phases II–III. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2024;(1):63-71. (In Russ.) https://doi.org/10.37489/2588-0519-2024-1-63-71. EDN: FAWAWZ
















































