Перейти к:
Ассоциации CYP2D6, ABCB1 2677G>T/A и 3435C>T с эффективностью и безопасностью фармакотерапии острого психотического эпизода у подростков в течение 28 дней
https://doi.org/10.37489/2588-0519-2021-3-39-49
Аннотация
Введение. Фармакокинетические генетические факторы являются прогностически значимыми при назначении антипсихотиков взрослым пациентам. В настоящее время отмечается недостаток исследований, проведённых на подростках с острым психотическим эпизодом.
Цель. Выявить возможные ассоциации полиморфных вариантов генов CYP2D6, CYP3A4/5 и ABCB1 с эффективностью и безопасностью фармакотерапии у подростков с острым психотическим эпизодом в течение 28 дней.
Материалы и методы. В исследование были включены 68 подростков с установленным диагнозом «острое полиморфное психотическое расстройство» на момент поступления (F23.0-9 по МКБ-10). Все пациенты получали антипсихотик в качестве основной терапии. Наблюдение за пациентами проводилось в течение 28 дней. Эффективность антипсихотиков оценивалась при помощи шкал Children’s Global Assessment Scale (CGAS), Positive and Negative Symptoms Scale (PANSS), Clinical Global Impression Severity (CGI-S) and Improvement (CGI-I). Безопасность фармакотерапии оценивалась по шкалам UKU Side Effects Rating Scale (UKU SERS), Sympson-Angus Scale (SAS), Barnes Akathisia rating scale (BARS). Определение полиморфных вариантов генов CYP3A4*22 (rs2740574), CYP3A5*3 (6986A>G, rs776746), CYP2D6*4, *9, *10 (rs3892097, rs4986774, rs1065852), ABCB1 1236C>T (rs1128503), 2677G>T/A (rs2032582), 3435C>T (rs1045642) осуществлялось методом полимеразной цепной реакции (ПЦР) в реальном времени.
Результаты. Носители ABCB1 2677G>T/A значимо реже демонстрировали ответ на фармакотерапию согласно шкале PANSS на 14-е сутки по сравнению с гомозиготами GG (64,6 % vs. 94,7 %; p=0,014). Носители полиморфного варианта ABCB1 3435C>T отличались более высоким общим баллом шкалы UKU SERS на 14-е сутки по сравнению с носителями генотипа CC (9,21±5,95 vs. 5,1±4,48; p=0,037). У пациентов с «промежуточным» метаболизмом CYP2D6 чаще отмечено уменьшение длительности сна (13,6 % vs. 0 %; p=0,031). С сухостью во рту чаще ассоциировались полиморфные варианты ABCB1 2677G>T/A (51 % vs. 15,8 %; p=0,012) и 3435C>T (46,6 % vs. 10 %; p=0,039). Также у носителей ABCB1 3435C>T чаще наблюдалось ортостатическое головокружение (34,5 % vs. 0 %; p=0,028).
Заключение. Носительство полиморфного варианта ABCB13435C>T ассоциировано с большей эффективностью фармакотерапии острого психотического эпизода у подростков через 28 дней, но вместе с тем повышает риск нежелательных реакций в первые 2 недели лечения. Полиморфный вариант ABCB1 2677G>T/A связан с повышением риска нежелательных реакций, а также с меньшей редукцией психотической симптоматики на 14-й день приёма фармакотерапии.
Ключевые слова
Для цитирования:
Иващенко Д.В., Буромская Н.И., Шиманов П.В., Дейч Р.В., Настович М.И., Акмалова К.А., Качанова А.А., Гришина Е.А., Савченко Л.М., Шевченко Ю.С., Сычёв Д.А. Ассоциации CYP2D6, ABCB1 2677G>T/A и 3435C>T с эффективностью и безопасностью фармакотерапии острого психотического эпизода у подростков в течение 28 дней. Качественная клиническая практика. 2021;(3):39-49. https://doi.org/10.37489/2588-0519-2021-3-39-49
For citation:
Ivaschenko D.V., Buromskaya N.I., Shimanov P.V., Deitsch R.V., Nastovich M.I., Akmalova K.A., Kachanova A.A., Grishina E.A., Savchenko L.M., Shevchenko Y.S., Sychev D.A. Associations of CYP2D6, ABCB1 2677G>T/A and 3435C>T with effectiveness and safety of pharmacotherapy for acute psychotic episodes in adolescents over 28 days. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2021;(3):39-49. (In Russ.) https://doi.org/10.37489/2588-0519-2021-3-39-49
Введение / Introduction
Антипсихотики применяются в психиатрии при лечении шизофрении, шизоаффективного расстройства, биполярного аффективного расстройства, а также по многим другим показаниям [1]. В первую очередь в назначении антипсихотиков нуждаются пациенты с психотическими симптомами [1]. Механизм действия антипсихотиков основан на блокаде рецепторов дофамина и серотонина [2]. Наряду с лечебным эффектом, применение антипсихотиков приводит к многочисленным нежелательным реакциям [2]. Группой риска являются дети и подростки, чаще склонные к плохой переносимости антипсихотиков по сравнению со взрослыми [3].
Для предупреждения неблагоприятных побочных реакций, а также для повышения эффективности терапии, активно применяется фармакогенетическое тестирование [4]. Сегодня этот метод доступен в кардиологии, онкологии, психиатрии [5]. Но при этом только для четырёх антипсихотиков разработаны рекомендации по фармакогенетическому тестированию [4]. Следовательно, эта область нуждается в продолжении исследований.
Метаболизм лекарств в печени разделяется на 2 фазы. Первая фаза — окисление — зависит от изоферментов цитохрома P450. Изоферменты цитохрома P450 — самое большое семейство энзимов, задействованных в окислительной биотрансформации большинства лекарств и других липофильных ксенобиотиков [6].
Антипсихотики являются субстратами изоферментов CYP2D6, CYP3A4/5 и CYP1A2 [4][7]. Данные изоферменты влияют на скорость изменения концентрации антипсихотика в плазме, а следовательно на эффективность и безопасность.
Многие из антипсихотиков также являются субстратами транспортного белка P-гликопротеина [4][7]. P-гликопротеин относится к семейству АТФ-зависимых трансмембранных переносчиков [8]. Данный переносчик осуществляет двунаправленный транспорт субстратов через клеточные мембраны — этим объясняется его роль во всасывании ксенобиотиков в кишечнике [9]. Но даже более значимым для антипсихотиков является то, что Р-гликопротеин регулирует проникновение через гематоэнцефалический барьер [9]. Более высокая активность P-gp приводит к снижению всасывания ЛС и его проникновения через ГЭБ [9].
Фармакогенетические исследования антипсихотиков проводятся на разных контингентах пациентов [10]. Довольно много работ, выполненных на пациентах с шизофренией [4]. Но отмечается явный дефицит исследований, в которые включают пациентов с острым психотическим эпизодом [10]. Большинство исследований фармакогенетики антипсихотиков у детей выполнены среди пациентов с расстройствами поведения, тиками [10].
Проведённый в 2011 году метаанализ Fleeman et al. установил, что генотипирование CYP2D6 имеет прогностическую ценность только для безопасности антипсихотиков, в частности оценки риска развития экстрапирамидных побочных эффектов [11]. Эти результаты подтверждаются другими подобными работами. В частности, метаанализ Patsoupulos et al. (2005) выявил, что «медленный» метаболизм CYP2D6 значимо повышает риск поздней дискинезии у пациентов с шизофренией [12]. Подтверждено влияние фенотипа CYP2D6 на плазменные концентрации рисперидона и арипипразола как в крупном ретроспективном исследовании [13], так и в метаанализах [14][15]. Но есть и отрицательные результаты: в частности, риск гиперпролактинемии при приёме рисперидона не был достоверно связан с фенотипом CYP2D6 по итогам метаанализа Calafato et al. (2020) [16]. Значимого влияния генотипа CYP2D6 на эффективность антипсихотиков в приведённых исследованиях выявлено не было.
В результате недавно опубликованного метаанализа Milosavljević et al. (2021) появилось больше информации о значимости фармакогенетического тестирования CYP2D6 при назначении антипсихотиков [17]. В данной работе не учитывались данные эффективности и безопасности антипсихотиков, только изменение плазменных концентраций препаратов. Установлено, что «медленный» метаболизм значимо увеличивает концентрации рисперидона и арипипразола, пограничная значимость получена для кветиапина и галоперидола [17]. Ассоциации CYP2D6 с эффективностью и безопасностью антипсихотиков в том числе изучены на российских пациентах. Есть достаточно крупные работы, подтверждающие наличие значимого влияния на антипсихотик-индуцированные экстрапирамидные симптомы, дозировки и длительность госпитализации [18][19].
Исследования других фармакокинетических факторов также не дают надёжных результатов. Полиморфные варианты гена ABCB1, кодирующего P-gp, могут изменять активность белка и, таким образом, плазменные концентрации его субстратов [20]. Но, несмотря на большое количество проведённых исследований, фармакогенетическое тестирование ABCB1 даёт спорные прогностические данные насчёт эффективности и безопасности антипсихотиков [20–22].
На фоне представленных данных выделяется исследование Rafaniello et al. (2018), в котором изучена предиктивная роль фармакокинетических генетических факторов для плазменной концентрации и безопасности рисперидона и арипипразола [23]. Установлено, что полиморфные варианты генов белков-переносчиков ABCG2 (CA/AA) и ABCB1 (2677TT и 3435TT) ассоциированы с плазменной концентрацией рисперидона и арипипразола [23]. Авторы не уточнили диагнозы пациентов, которых они включили в исследование.
Проведённое нами ранее фармакогенетическое исследование продемонстрировало, что CYP2D6 и ABCB1 ассоциированы с параметрами безопасности антипсихотиков у подростков с острым психотическим эпизодом в течение 14 дней [24][25].
Цель настоящего исследования: выявить возможные ассоциации полиморфных вариантов генов CYP2D6, CYP3A4/5 и ABCB1 с эффективностью и безопасностью фармакотерапии у подростков с острым психотическим эпизодом в течение 28 дней.
Материалы и методы / Material and methods
Исследование было одобрено заседанием локального этического комитета ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России (Протокол № 3 от 06.06.2018 г.) и ГБУЗ «Научно-практический центр психического здоровья детей и подростков им. Г. Е. Сухаревой ДЗМ» (Протокол № 2 от 14.06.2018 г.).
Дизайн исследования: проспективное обсервационное. В исследовании участвовали пациенты, госпитализированные в детскую психиатрическую больницу (ГБУЗ «Научно-практический центр психического здоровья детей и подростков им. Г. Е. Сухаревой ДЗМ»). В исследовании участвовали пациенты, госпитализированные в больницу в период с 20.06.2018 по 20.03.2020 г.
В исследовании участвовали 68 подростков с установленным диагнозом на момент поступления в стационар «острое полиморфное психотическое расстройство» (F23.0-9 согласно МКБ-10). Включение в исследование производилось в срок от 1 до 3 дней после госпитализации пациента в психиатрическую больницу. Каждый пациент и его законный представитель подписали добровольное информированное согласие на участие в исследовании. Персональные данные, которые позволяют идентифицировать пациента, не были внесены в базы данных. Все пациенты идентифицировали себя этнически русскими.
Критерии включения:
1. Возраст от 12 до 18 лет.
2. Клинически верифицированный острый психотический эпизод.
3. Назначение антипсихотика в качестве основного вида фармакотерапии.
4. Согласие пациента и родителя (законного представителя) на участие в исследовании.
Критерии невключения:
1. Наличие соматического или инфекционного заболевания в состоянии декомпенсации.
2. Положительный результат теста на употребление психоактивных веществ, что указывает на экзогенный характер психотического расстройства.
3. Противопоказания к приёму антипсихотиков.
4. Отказ пациента или его родителя (законного представителя) от участия в исследовании.
Наблюдение за пациентами проводилось в течение 28 дней. Оценка психического состояния пациента проводилась три раза: на момент включения в исследование, на 14-й день наблюдения и на 28-й день наблюдения. После этого пациент завершал своё участие в исследовании.
Для оценки тяжести психического состояния применялись специальные шкалы: Children’s Global Assessment Scale (CGAS) [26], Positive and Negative Symptoms Scale (PANSS) [27], Clinical Global Impression Severity (CGI-S) and Improvement (CGI-I) [28]. Динамические изменения данных шкал использовались для оценки эффективности психофармакотерапии.
Безопасность психофармакотерапии оценивалась при помощи шкал UKU Side Eff ects Rating Scale (UKU SERS) [29], Sympson-Angus Scale (SAS) [30], Barnes Akathisia rating scale (BARS) [31]. Эти шкалы имеют числовые значения, чем выше значение — тем больше выраженность симптомов. Но UKU SERS также позволяет оценить наличие отдельных неблагоприятных побочных реакций у пациента.
Исследователь не мог влиять на назначение психофармакотерапии лечащим врачом. Все получаемые пациентом психотропные препараты были учтены в исследовании. Все пациенты получали антипсихотик в качестве основной терапии. Некоторым пациентам дополнительно назначали второй антипсихотик, антидепрессант, нормотимик, антихолинергический препарат или транквилизатор. Подобные случаи рассматривались как полипрагмазия и обязательно учитывались при анализе. Для анализа учитывали суточную дозу антипсихотика, не разделяя один и тот же препарат по пути введения. Дозы антипсихотиков были переведены в хлорпромазиновый эквивалент для унификации дальнейшего анализа [32]. В анализ включались только те лекарственные средства, которые назначались пациенту не менее чем на 3 дня.
Лабораторная часть / Laboratory part
От каждого пациента был взят соскоб эпителия внутренней стороны щеки (буккального эпителия) в день включения в исследование с целью генотипирования. Биоматериал замораживался, транспортировался в лабораторию и в дальнейшем хранился при температуре -77 °С.
Лабораторная часть исследования проводилась на базе НИИ молекулярной и персонализированной медицины ФГБОУ ДПО РМАНПО Минздрава России (Москва). Выделение ДНК и генотипирование образцов происходило по мере их поступления в период с 25 апреля 2019 г. по 15 мая 2020 г.
Выделение ДНК из буккального эпителия было проведено сорбентным методом.
Определение полиморфных вариантов генов CYP3A4*22 (rs2740574), CYP3A5*3 (6986A>G, rs776746), CYP2D6*4, *9, *10 (rs3892097, rs4986774, rs1065852), ABCB1 1236C>T (rs1128503), 2677G>T/A (rs2032582), 3435C>T (rs1045642) осуществлялось методом полимеразной цепной реакции (ПЦР) в реальном времени с применением коммерческих наборов реактивов (ООО «Синтол»), оборудование: детектирующий амплификатор CFX96 TouchTM Real Time PCR Detection System (Bio-Rad, USA).
Генотипы CYP2D6*4, *9, *10 были трансформированы в фенотип пациента согласно консенсусу сообществ CPIC и DPWG [4]. Носители одной низкоактивной аллели (*4, *9, *10) рассматривались как «промежуточные» метаболизаторы (intermediate metabolizers — IM), носители диплотипов *4/*4, *9/*9 или *4/*10 — как «медленные» метаболизаторы (poor metabolizers — PM). Отсутствие у пациента данных аллелей мы расценивали как «нормальную» скорость метаболизма CYP2D6. В настоящей выборке присутствовали 46 пациентов с «быстрым» типом метаболизма (EM) и 22 пациента с «промежуточным» типом метаболизма (IM).
Статистическая обработка результатов / Statistical processing of results
Статистическая обработка проводилась в программе SPSS Statistics 21.0.
Проводился анализ параметров эффективности и безопасности фармакотерапии на 14-й и 28-й день наблюдения. Это позволяло оценить влияние полиморфных вариантов генов в зависимости от срока приёма терапии.
Учитывая небольшой размер выборки, для сравнения количественных переменных между группами применялись непараметрические критерии (Манна — Уитни, Крускала — Уоллеса). Частоты категориальных переменных сравнивались между собой при помощи хи-квадрата Пирсона, для сравнений 2x2 использовался точный критерий Фишера. Для коррекции множественных сравнений вводилась поправка Бонферрони.
Расчёт соответствия распределения генотипов закону Харди — Вайнберга был выполнен при помощи онлайн-калькулятора [33].
Носители разных аллелей полиморфных вариантов были разбиты на две группы: гомозиготы «дикого» типа и носители полиморфной аллели в гомо- и гетерозиготном состоянии. Например, для полиморфного варианта ABCB1 1236C>T было выделено две группы: CC и CT+TT.
При анализе данных всегда учитывалось влияние демографических и клинических характеристик пациентов на изучаемые исходы, в том числе — влияние полипрагмазии. Это было сделано с целью установить значимость ассоциаций полиморфных вариантов исследуемых генов с параметрами эффективности и безопасности антипсихотиков.
Результаты / Results
Описание пациентов, включённых в исследование / Description of the patients included in the study
Средний возраст участников исследования составлял 15,06±1,67 года. Большинство участников были мужского пола (60,3 %, n=41).
При поступлении все подростки соответствовали критериям диагноза F23 по МКБ-10 «острое полиморфное психотическое расстройство». В процессе клинического наблюдения устанавливался уточнённый диагноз. У 34 (50 %) пациентов диагноз F23 остался без изменений, у 20 человек (29,4 %) установлен диагноз параноидной шизофрении (F20 по МКБ-10), у 6 (8,8 %) — шизоаффективного расстройства (F25 по МКБ-10). Также встречались диагнозы F21 (8,8 %) и F22 (2,9 %). В 57,6 % случаев острый психотический эпизод у пациента был впервые в жизни. Наиболее часто в качестве ведущего диагностировался галлюцинаторно-параноидный синдром (69,1 %), на втором месте — параноидный (14,7 %), одинаково часто наблюдались депрессивно-параноидный (7,4 %) и маниакально-параноидный (7,4 %); у одного пациента ведущий синдром был кататонический.
Назначенные пациентам антипсихотики представлены в табл. 1. Кроме того, в первые 2 недели антидепрессант дополнительно назначался 12 пациентам (17,6 %), нормотимик — 11 пациентам (16,2 %). В период с 15-й по 28-й день антидепрессант назначался 21 пациенту (30,9 %), нормотимик — 19 пациентам (27,9 %). Было также учтено использование тригексифенидила для коррекции экстрапирамидных симптомов: 52 пациента в первые 14 дней и 49 пациентов в период с 15-й по 28-й день.
Таблица 1
Антипсихотики, назначенные пациентам в качестве основного и сопутствующего на период наблюдения
Table 1
Antipsychotics prescribed to patients as the main and concomitant for the period of observation

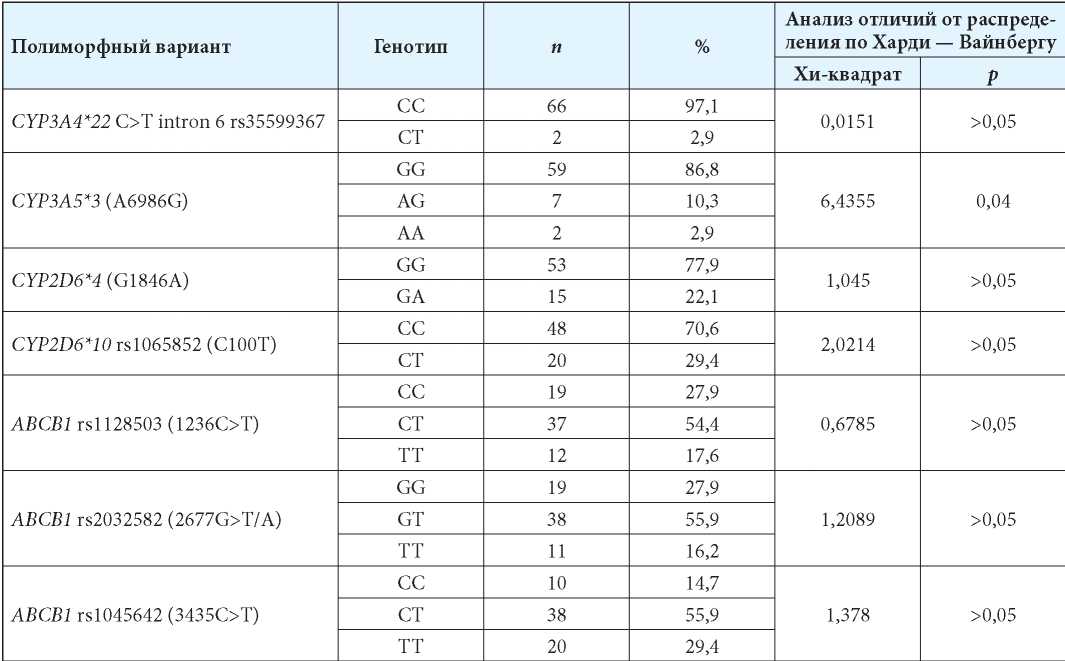
В табл. 2 представлено распределение генотипов изученных полиморфных вариантов с результатами анализа на соответствие закону Харди — Вайнберга. Полиморфный вариант CYP2D6*9 не был обнаружен ни у одного пациента.
Таблица 2
Частоты изученных полиморфных вариантов генов фармакокинетических факторов с результатами анализа отличий от равновесия Харди — Вайнберга
Table 2
The frequencies of the studied polymorphic variants of pharmacokinetic factor genes with the results of the analysis of differences from the Hardy-Weinberg equilibrium
Ассоциации полиморфных вариантов генов с эффективностью терапии / Associations of polymorphic gene variants with the effectiveness of therapy
Были получены значимые ассоциации полиморфных вариантов ABCB1 с ответом на фармакотерапию.
Носители полиморфного варианта ABCB1 3435C>T (CT+TT) отличались выраженным улучшением состояния по изменению балла шкалы CGAS по сравнению с носителями гомозигот СС на 28-й день (3,33±1,49 vs. 2,2±1,03; p=0,024).
Интересным также является факт того, что ранний ответ на фармакотерапию (через 14 дней) существенно чаще наблюдался у носителей «дикого» генотипа ABCB1 2677G>T/A (рис. 1). Пациенты с генотипами GT+TT реже демонстрировали редукцию общего балла шкалы PANSS >20 % на 14-е сутки.
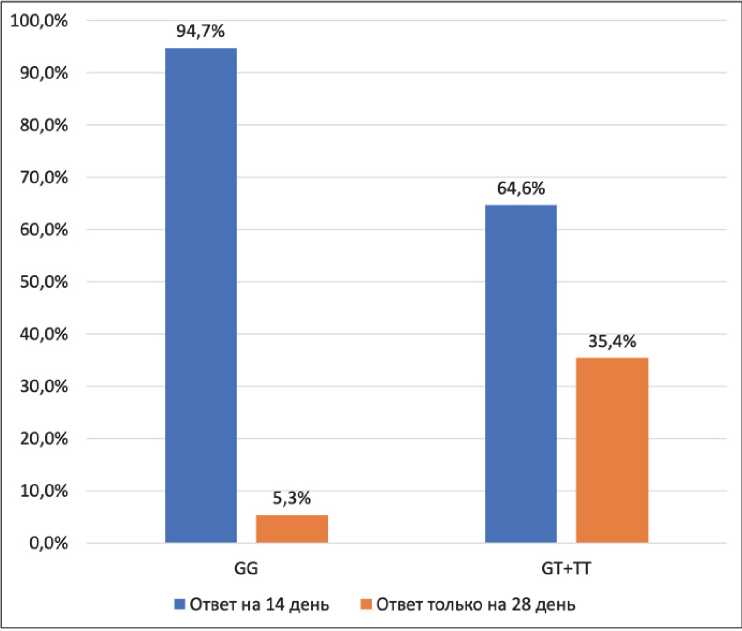
Рис. 1. Поздний ответ на фармакотерапию среди носителей ABCB1 2677G>T/A согласно снижению общего балла шкалы PANSS >20 % от значения на момент включения в исследование
Примечание: достоверность различий p=0,014.
Fig. 1. Late response to pharmacotherapy among carriers of ABCB1 2677G>T/A according to a decrease in the overall score of the PANSS scale >20 % of the value at the time of inclusion in the study
Note: the significance of the differences is p=0.014.
Ассоциации полиморфных вариантов генов с безопасностью терапии / Associations of polymorphic gene variants with the safety of therapy
Проведённый анализ значений шкал для оценки безопасности фармакотерапии показал следующие результаты.
Носители полиморфного варианта ABCB1 3435C>T отличались более высоким общим баллом шкалы UKU SERS на 14-е сутки по сравнению с носителями генотипа CC (9,21±5,95 vs. 5,1±4,48; p=0,037).
На рисунке 2 показаны различия по шкале акатизии BARS на 14-е сутки в зависимости от носительства полиморфного варианта ABCB1 3435C>T. В противоположность шкале UKU SERS, носители генотипов CT+TT в меньшей степени проявляли признаки акатизии.
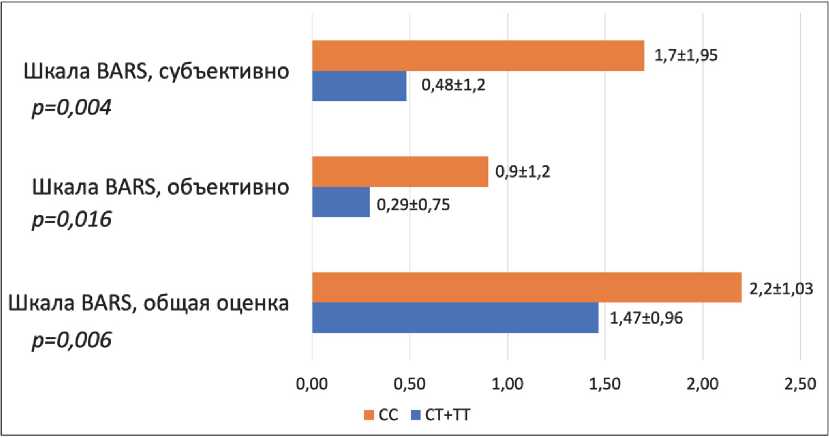
Рис. 2. Различия шкалы BARS между носителями разных генотипов полиморфного варианта ABCB1 3435C>T
Fig. 2. BARS scale differences between carriers of different genotypes of polymorphic variant ABCB1 3435C>T
Значимых различий значений шкал между носителями разных генотипов на 28-е сутки выявлено не было.
Проведённый анализ частоты встречаемости отдельных нежелательных реакций установил несколько значимых ассоциаций для CYP2D6, ABCB12677G>T/A и 3435C>T (табл. 3).
Таблица 3
Ассоциации частоты отдельных нежелательных реакций на 14-е сутки с носительством полиморфных вариантов ABCB1 2677G>T/A, 3435C>T и фенотипа CYP2D6
Table 3
Associations of the frequency of individual adverse reactions on day 14 with the carrier of polymorphic variants ABCB1 2677G>T/A, 3435C>T and the CYP2D6 phenotype

Примечание / Note: EM — extensive metabolizer; IM — intermediate metabolizer.
Было показано, что более склонны к нежелательным реакциям «промежуточные» метаболизаторы CYP2D6, носители полиморфных вариантов ABCB1 2677G>T/A и 3435C>T. Полученные ассоциации имеют значимость только на 14-е сутки.
На 28-е сутки не было получено значимых ассоциаций полиморфных вариантов генов фармакокинетических факторов с нежелательными реакциями.
Обсуждение / Discussion
Проведённое исследование позволило оценить ассоциации фармакокинетических генетических факторов с эффективностью и безопасностью фармакотерапии острого психотического эпизода у подростков. Сильной стороной исследования является возможность оценить ассоциации как через 14, так и через 28 суток приёма терапии. Как показали полученные результаты, разница является принципиально важной.
Мы установили, что параметры эффективности фармакотерапии ассоциированы с полиморфными вариантами ABCB1. Вполне логично, что носители ABCB1 3435C>T отличались более высокой эффективностью фармакотерапии. Действительно, носительство данного полиморфного варианта может привести к уменьшению активности P-gp, как следствие — увеличению проницаемости мембран для психотропных препаратов. Значит, благодаря более высокой плазменной концентрации при стандартной дозировке лечебный эффект может быть выше.
Но при этом прямо противоположные результаты получены для полиморфного варианта ABCB1 2677G>T/A. Носители генотипов GT+TT намного реже достигали значимого улучшения психического состояния на 14-й день по сравнению с гомозиготами GG. Также гомозиготы GG отличались ранним ответом на фармакотерапию в 95 % случаев. Это выглядит противоречиво, так как носительство ABCB1 2677G>T/A повышает проницаемость клеточных мембран для ксенобиотиков. Данную находку не получается объяснить, и это не единственное противоречие для полиморфных вариантов ABCB1 в нашем исследовании.
Исследование безопасности выявило, что носители ABCB1 3435C>T демонстрировали большую выраженность нежелательных реакций согласно шкале UKU SERS, но при этом реже отмечали акатизию. Это является очень интересной находкой. В данном случае ошибка со стороны исследователя исключена, так как нежелательная реакция «акатизия» включена в UKU SERS. Но, видимо, в настоящем исследовании общий балл шкалы UKU SERS выше не за счёт экстрапирамидных нежелательных реакций. Поэтому данную находку о меньшей выраженности акатизии у носителей ABCB1 3435C>T не удаётся объяснить логически. Полученные результаты требуют репликации в новых исследованиях на аналогичных контингентах пациентов.
В других исследованиях носительство полиморфных вариантов ABCB1 также показывало противоречивые ассоциации с параметрами безопасности фармакотерапии [20][21][23].
При исследовании безопасности фармакотерапии установлено, что «промежуточные» метаболизаторы CYP2D6 чаще отмечали нежелательные реакции на 14-е сутки. Это согласуется с проведёнными ранее исследованиями: действительно, замедление метаболизма CYP2D6 способно увеличить риск непереносимости антипсихотиков [19].
Аналогично анализ частоты отдельных нежелательных реакций на 14-й день терапии выявил ассоциации с носительством ABCB1 2677G>T/A и 3435C>T. Конкретно данный анализ продемонстрировал в целом ожидаемые результаты: нежелательные реакции чаще встречались у носителей полиморфных аллелей.
Фармакокинетические генетические факторы не ассоциировались с безопасностью фармакотерапии на 28-е сутки наблюдения. Но предиктивная роль для эффективности сохранялась, как видно на примере шкалы CGAS и ABCB1 3435C>T.
Вероятно, что наиболее ярко концентрация препаратов в крови влияет на переносимость только в первые 2 недели лечения. В дальнейшем происходит установление равновесной концентрации, которую в том числе регулирует врач путём клинической оценки эффективности и безопасности. На 28-й день фармакокинетические генетические факторы уже не так значимы, поскольку дозировка препарата подобрана исходя из клинического статуса пациента. Следовательно, даже у «промежуточных» метаболизаторов редуцируются НР, поскольку в ответ на их появление за первые 14 дней лечащий врач, вероятно, отреагировал коррекцией дозировки.
Из этого следует высокая прогностическая значимость фармакокинетических генетических факторов для безопасности фармакотерапии именно при её инициации.
Заключение / Conclusion
В результате проведённого исследования установлены значимые ассоциации фармакокинетических генетических факторов с параметрами эффективности и безопасности фармакотерапии.
Носительство полиморфного варианта ABCB1 3435C>T ассоциировано с большей эффективностью фармакотерапии острого психотического эпизода у подростков через 28 дней, но вместе с тем повышает риск нежелательных реакций в первые 2 недели лечения.
Носительство полиморфного варианта ABCB1 2677G>T/A увеличивало риск нежелательных реакций на 14-й день приёма фармакотерапии, а также может быть предиктором фармакорезистентности: у носителей отмечена меньшая редукция психотической симптоматики в первые 14 дней наблюдения. «Промежуточный» метаболизм CYP2D6 значимо не ассоциировался с параметрами эффективности и безопасности фармакотерапии на 28-й день наблюдения. Данный биомаркер имел значение только при анализе результатов на 14-е сутки лечения подростков с острым психотическим эпизодом.
Противоречивые результаты, полученные в нашем исследовании для ABCB1 2677G>T/A и 3435C>T, требуют репликации в дальнейших исследованиях у подростков с острым психотическим эпизодом.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
ADDITIONAL INFORMATION
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interest. The authors state that there is no conflict of interest.
Финансирование. Исследование выполнено при финансовой поддержке Российского научного фонда, проект № 18-75-00046.
Financing. Th e research was carried out with the financial support of the Russian Science Foundation, project No. 18-75-00046.
Список литературы
1. Krause M, Zhu Y, Huhn M, et al. Antipsychotic drugs for patients with schizophrenia and predominant or prominent negative symptoms: a systematic review and meta-analysis. Eur Arch Psychiatry Clin Neurosci. 2018;268(7):625–39. doi: 10.1007/s00406-018-0869-3
2. Minjon L, van den Ban E, de Jong E, et al. Reported Adverse Drug Reactions in Children and Adolescents Treated with Antipsychotics. J Child Adolesc Psychopharmacol. 2019;29(2):124–32. doi: 10.1089/cap.2018.0139
3. Stafford MR, Mayo-Wilson E, Loucas CE, et al. Efficacy and safety of pharmacological and psychological interventions for the treatment of psychosis and schizophrenia in children, adolescents and young adults: a systematic review and meta-analysis. PLoS One. 2015;10(2):e0117166. doi: 10.1371/journal.pone.0117166
4. van Westrhenen R, Aitchison KJ, Ingelman-Sundberg M, Jukic M. Pharmacogenomics of Antidepressant and Antipsychotic Treatment: How Far Have We Got and Where Are We Going? Front Psychiatry. 2020;11:94. doi: 10.3389/fpsyt.2020.00094
5. van Schaik RHN, M?ller DJ, Serretti A, et al. Pharmacogenetics in Psychiatry: An Update on Clinical Usability. Front Pharmacol. 2020;11:575540. doi: 10.3389/fphar.2020.575540
6. Zanger UM, Schwab M. Cytochrome P450 enzymes in drug metabolism: regulation of gene expression, enzyme activities, and impact of genetic variation. Pharmacol Ther. 2013;138(1):103–41. doi: 10.1016/j.pharmthera.2012.12.007
7. Hiemke C, Bergemann N, Clement HW, et al. Consensus Guidelines for Therapeutic Drug Monitoring in Neuropsychopharmacology: Update 2017. Pharmacopsychiatry. 2018;51(01-02):e1-e1. doi: 10.1055/s-0037-1600991
8. Bruhn O, Cascorbi I. Polymorphisms of the drug transporters ABCB1, ABCG2, ABCC2 and ABCC3 and their impact on drug bioavailability and clinical relevance. Expert Opin Drug Metab Toxicol. 2014;10(10):1337–54. doi: 10.1517/17425255.2014.952630
9. Davis TP, Sanchez-Covarubias L, Tome ME. P-glycoprotein trafficking as a therapeutic target to optimize CNS drug delivery. Adv Pharmacol. 2014;71C:25–44. doi: 10.1016/bs.apha.2014.06.009
10. Wehry AM, Ramsey L, Dulemba SE, et al. Pharmacogenomic Testing in Child and Adolescent Psychiatry: An Evidence-Based Review. Curr Probl Pediatr Adolesc Health Care. 2018;48(2):40–9. doi: 10.1016/j.cppeds.2017.12.003
11. Fleeman N, Dundar Y, Dickson R, et al. Cytochrome P450 testing for prescribing antipsychotics in adults with schizophrenia: systematic review and meta-analyses. Pharmacogenomics J. 2011;11(1):1–14. doi: 10.1038/tpj.2010.73
12. Patsopoulos NA, Ntzani EE, Zintzaras E, et al. CYP2D6 polymorphisms and the risk of tardive dyskinesia in schizophrenia: a meta-analysis. Pharmacogenet Genomics. 2005;15(3):151–8. doi: 10.1097/01213011-200503000-00003
13. Jukic MM, Smith RL, Haslemo T, et al. Effect of CYP2D6 genotype on exposure and efficacy of risperidone and aripiprazole: a retrospective, cohort study. Lancet Psychiatry. 2019;6(5):418–26. doi: 10.1016/S2215-0366(19)30088-4
14. Zhang L, Brown SJ, Shan Y, et al. CYP2D6 Genetic Polymorphisms and Risperidone Pharmacokinetics: A Systematic Review and Meta-analysis. Pharmacotherapy. 2020;40(7):632–47. doi: 10.1002/phar.2434
15. Zhang X, Xiang Q, Zhao X, et al. Association between aripiprazole pharmacokinetics and CYP2D6 phenotypes: A systematic review and metaanalysis. J Clin Pharm Ther. 2019;44(2):163–73. doi: 10.1111/jcpt.12780
16. Calafato MS, Austin-Zimmerman I, Thygesen JH, Sairam M, Metastasio A, Marston L, Abad-Santos F, Bhat A, Harju-Seppänen J, Irizar H, Zartaloudi E, Bramon E. The effect of CYP2D6 variation on antipsychoticinduced hyperprolactinaemia: a systematic review and meta-analysis. Pharmacogenomics J. 2020;20(5):629–37. doi: 10.1038/s41397-019-0142-9
17. Milosavljevic F, Bukvic N, Pavlovic Z, et al. Association of CYP2C19 and CYP2D6 Poor and Intermediate Metabolizer Status With Antidepressant and Antipsychotic Exposure: A Systematic Review and Meta-analysis. JAMA Psychiatry. 2021;78(3):270–80. doi: 10.1001/jamapsychiatry.2020.3643
18. Ivanova SA, Filipenko ML, Vyalova NM, et al. CYP1A2 and CYP2D6 Gene Polymorphisms in Schizophrenic Patients with Neuroleptic DrugInduced Side Effects. Bull Exp Biol Med. 2016 Mar;160(5):687–90. doi: 10.1007/s10517-016-3250-4
19. Kurylev AA, Brodyansky VM, Andreev BV, et al. The combined effect of CYP2D6 and DRD2 Taq1A polymorphisms on the antipsychotics daily doses and hospital stay duration in schizophrenia inpatients (observational naturalistic study). Psychiatr Danub. 2018;30(2):157–63. doi: 10.24869/psyd.2018.157
20. Moons T, de Roo M, Claes S, et al. Relationship between P-glycoprotein and second-generation antipsychotics. Pharmacogenomics. 2011;12(8):1193–211. doi: 10.2217/pgs.11.55
21. Geers LM, Pozhidaev IV, Ivanova SA, et al. Association between 8 P-glycoprotein (MDR1/ABCB1) gene polymorphisms and antipsychotic drug-induced hyperprolactinaemia. Br J Clin Pharmacol. 2020;86:1827–35. doi: 10.1111/bcp.14288
22. Hattori S, Suda A, Kishida I, Miyauchi M, Shiraishi Y, Fujibayashi M, Tsujita N, Ishii C, Ishii N, Moritani T, Taguri M, Hirayasu Y. Effects of ABCB1 gene polymorphisms on autonomic nervous system activity during atypical antipsychotic treatment in schizophrenia. BMC Psychiatry. 2018;18(1):231. doi: 10.1186/s12888-018-1817-5
23. Rafaniello C, Sessa M, Bernardi FF, et al. The predictive value of ABCB1, ABCG2, CYP3A4/5 and CYP2D6 polymorphisms for risperidone and aripiprazole plasma concentrations and the occurrence of adverse drug reactions. Pharmacogenomics J. 2018;18(3):422–30. doi: 10.1038/tpj.2017.38
24. Иващенко Д. В., Федина Л. В., Юделевич Д. А. и др. Полиморфные варианты генов рецепторов дофамина DRD2, DRD3 и DRD4 ассоциированы с ранней эффективностью и безопасностью антипсихотиков у подростков с острым психотическим эпизодом. Клиническая фармакология и терапия. 2021;30(2):75–80 [Ivaschenko DV, Fedina LV, Yudelievich DA, et al. The polymorphic variants DRD2, DRD3, and DRD4 are associated with early efficacy and safety of antipsychotics in adolescents with an acute psychotic episode. Klinicheskaya farmakologiya i terapiya = Clin Pharmacol Ther. 2021;30(2):75–80 (In Russ).]. doi: 10.32756/0869-5490-2021-2-75-80
25. Ivashchenko DV, Khoang SZ, Makhmudova BV, Buromskaya NI, Shimanov PV, Deitch RV, Akmalova KA, Shuev GN, Dorina IV, Nastovich MI, Shagovenko EN, Grishina EA, Savchenko LM, Shevchenko YS, Sychev DA. Pharmacogenetics of antipsychotics in adolescents with acute psychotic episode during first 14 days after admission: effectiveness and safety evaluation. Drug Metab Pers Ther. 2020;4(35): 20200102. doi: 10.1515/dmpt-2020-0102
26. Kay SR, Opler LA, Spitzer RL, et al. SCID-PANSS: two-tier diagnostic system for psychotic disorders. Compr Psychiatry. 1991;32(4):355–61. doi: 10.1016/0010-440X(91)90085-Q
27. Busner J, Targum SD. The clinical global impressions scale: applying a research tool in clinical practice. Psychiatry (Edgmont). 2007;4(7):28–37.
28. Lingjaerde O, Ahlfors UG, Bech P, et al. The UKU side effect rating scale. A new comprehensive rating scale for psychotropic drugs and a crosssectional study of side effects in neuroleptic-treated patients. Acta Psychiatr Scand Suppl. 1987;334:1–100. doi: 10.1111/j.1600-0447.1987.tb10566.x
29. Simpson GM, Angus JW. A rating scale for extrapyramidal side effects. Acta Psychiatr Scand Suppl. 1970;212:11–9. doi: 10.1111/j.1600-0447.1970.tb02066.x
30. Barnes TR. The Barnes Akathisia Rating Scale — revisited. J Psychopharmacol. 2003;17(4):365–70. doi: 10.1177/0269881103174013
31. Gardner DM, Murphy AL, O’Donnell H, et al. International consensus study of antipsychotic dosing. Am J Psychiatry. 2010;167(6):686–93. doi: 10.1176/appi.ajp.2009.09060802
32. Rodriguez S, Gaunt TR, Day IN. Hardy-Weinberg equilibrium testing of biological ascertainment for Mendelian randomization studies. Am J Epidemiol. 2009;169(4):505–14. doi: 10.1093/aje/kwn359
Об авторах
Д. В. ИващенкоРоссия
Иващенко Дмитрий Владимирович, к. м. н., с. н. с. отдела персонализированной медицины НИИ молекулярной и персонализированной медицины
SPIN-код: 9435-7794
Москва
Пенза
Н. И. Буромская
Россия
Буромская Нина Ивановна, заведующий отделением № 1
Москва
П. В. Шиманов
Россия
Шиманов Павел Викторович, заведующий отделением № 12
Москва
Р. В. Дейч
Россия
Дейч Роман Витальевич, к. м. н., зав. отделением № 14
Москва
М. И. Настович
Россия
Настович Марина Игоревна, врач-психиатр
Москва
К. А. Акмалова
Россия
Акмалова Кристина Анатольевна, н. с. отдела молекулярной медицины НИИ молекулярной и персонализированной медицины
Москва
А. А. Качанова
Россия
Качанова Анастасия Алексеевна, м. н. с. отдела молекулярной медицины НИИ молекулярной и персонализированной медицины
Москва
Е. А. Гришина
Россия
Гришина Елена Анатольевна, д. б. н., доцент, директор НИИ молекулярной и персонализированной медицины
Москва
Л. М. Савченко
Россия
Савченко Людмила Михайловна, к. м. н., доцент, профессор кафедры наркологии
Москва
Ю. С. Шевченко
Россия
Шевченко Юрий Степанович, д. м. н., профессор, зав. кафедрой детской психиатрии и психотерапии
Москва
Д. А. Сычёв
Россия
Сычёв Дмитрий Алексеевич, д. м. н., профессор, член-корр. РАН, ректор, зав. кафедрой клинической фармакологии и терапии
SPIN-код: 4525-7556
Москва
Рецензия
Для цитирования:
Иващенко Д.В., Буромская Н.И., Шиманов П.В., Дейч Р.В., Настович М.И., Акмалова К.А., Качанова А.А., Гришина Е.А., Савченко Л.М., Шевченко Ю.С., Сычёв Д.А. Ассоциации CYP2D6, ABCB1 2677G>T/A и 3435C>T с эффективностью и безопасностью фармакотерапии острого психотического эпизода у подростков в течение 28 дней. Качественная клиническая практика. 2021;(3):39-49. https://doi.org/10.37489/2588-0519-2021-3-39-49
For citation:
Ivaschenko D.V., Buromskaya N.I., Shimanov P.V., Deitsch R.V., Nastovich M.I., Akmalova K.A., Kachanova A.A., Grishina E.A., Savchenko L.M., Shevchenko Y.S., Sychev D.A. Associations of CYP2D6, ABCB1 2677G>T/A and 3435C>T with effectiveness and safety of pharmacotherapy for acute psychotic episodes in adolescents over 28 days. Kachestvennaya Klinicheskaya Praktika = Good Clinical Practice. 2021;(3):39-49. (In Russ.) https://doi.org/10.37489/2588-0519-2021-3-39-49